Дипломная работа: Проектирование производства фосфорсодержащего вещества
Дипломная работа: Проектирование производства фосфорсодержащего вещества
СОДЕРЖАНИЕ
ЗАДАНИЕ НА ПРОЕКТИРОВАНИЕ ОБЪЕКТА
ВВЕДЕНИЕ
ОБЩИЕ СВЕДЕНИЯ О ТЕХНОЛОГИИ
ТЕХНИКО-ЭКОНОМИЧЕСКОЕ ОБОСНОВАНИЕ РЕКОМЕНДУЕМОГО СПОСОБА ПРОИЗВОДСТВА. ПЕРСПЕКТИВЫ ПРОИЗВОДСТВА
МЕТОДЫ ПОЛУЧЕНИЯ ФОСФОРСОДЕРЖАЩИХ (МЕТ)АКРИЛАТОВ (ЛИТЕРАТУРНЫЙ ОБЗОР)
ПРИМЕНЕНИЕ ФОСФОРСОДЕРЖАЩИХ (МЕТ)АКРИЛАТОВ
МЕТОДЫ СИНТЕЗА ФОСФОРСОДЕРЖАЩИХ (МЕТ)АКРИЛАТОВ
ПЕРЕЭТЕРИФИКАЦИЯ СРЕДНИХ ФОСФИТОВ
ПЕРЕЭТЕРИФИКАЦИЯ КИСЛЫХ ФОСФИТОВ
МЕХАНИЗМ РЕАКЦИИ ПЕРЕЭТЕРИФИКАЦИИ ЭФИРОВ КИСЛОТ ТРЕХВАЛЕНТНОГО ФОСФОРА
НОРМАТИВНО-ТЕХНИЧЕСКАЯ ДОКУМЕНТАЦИЯ НА СЫРЬЁ, ВСПОМОГАТЕЛЬНЫЕ МАТЕРИАЛЫ И ГОТОВУЮ ПРОДУКЦИЮ
ФИЗИКО-ХИМИЧЕСКИЕ И ТЕПЛОФИЗИЧЕСКИЕ СВОЙСТВА ИСХОДНЫХ, ПРОМЕЖУТОЧНЫХ, ПОБОЧНЫХ, ЦЕЛЕВЫХ ПРОДУКТОВ И ОТХОДОВ ПРОИЗВОДСТВА
ФИЗИКО-ХИМИЧЕСКИЕ ОСНОВЫ ТЕХНОЛОГИЧЕСКИХ ПРОЦЕССОВ
ОПИСАНИЕ ТЕХНОЛОГИЧЕСКОЙ СХЕМЫ
ДАННЫЕ ДЛЯ РАСЧЕТА И ВЫБОРА ОСНОВНОГО ТЕХНОЛОГИЧЕСКОГО ОБОРУДОВАНИЯ
АНАЛИТИЧЕСКИЙ КОНТРОЛЬ ПРОИЗВОДСТВА
ВЫВОДЫ И РЕКОМЕНДАЦИИ
СПИСОК ЛИТЕРАТУРНЫХ ИСТОЧНИКОВ
Задание на проектирование объекта
| № п/п | Перечень основных данных и требований | Основные параметры |
| 1 | Основание для проектирования | Учебный план по специальности |
| 2 | Основные технико-экономические показатели объекта (мощность, производительность) | 30 т/год |
| 3 | Узел (отделение, стадия, аппарат), который подвергается изменению (реконструкция, модернизация, совершенствование) по сравнению с действующим объектом | Предложена новая технологическая схема |
| 4 | Требования к качеству, конкурентоспособности и экологическим параметрам продукции | Предлагаемый продукт по сравнению с аналогичным, не имеет в своем составе хлора |
| 5 | Требования к технологии и режиму предприятия | Режим работы – периодический; число рабочих дней в году 350 |
| 6 | Исходные данные к разработке проекта |
Выход 63,2%; Температура реакции 170-180°С; Время реакции 5,5 часов Соотношение МЭГ:диметиловый эфир β-цианоэтилфосфоновой кислоты составляет 1,667:1 (масс.) |
| 7 | Состав графических материалов |
Технологическая схема Химизм процесса |
Введение
Фосфорсодержащие полимеры привлекают внимание многих исследователей своими ценными качествами и потенциальными возможностями. К ним, прежде всего, относятся: огнестойкость, хорошая адгезия к ряду материалов, ионообменная и хелатообразующая способность, биологическая активность и другие свойства. Благодаря этим качествам фосфорсодержащие полимеры широко используются в качестве добавок и модификаторов традиционных полимеров, для придания им тех или иных специфических свойств, биологически активных препаратов, сорбентов благородных металлов стабилизаторов полимеров.
Акриловые кислоты, а также и их производные ((мет)акрилаты), являются широко распространенными мономерами, которые нашли применение в производстве пластмасс, каучуков, синтетических волокон, органического стекла, и т.д. Однако эти материалы горючи, поэтому все более остро встает проблема снижения их горючести. Поиск материалов, способных снизить горючесть полимеров, уменьшающих образование вредных продуктов и дыма при горении, продолжается. Как правило, основные способы ингибирования горения полимеров основаны на применении хлор- и бромсодержащих антипиренов, а также на модификации полимеров хлор- или бромсодержащими соединениями. Но, как было установлено, эти вещества, попадая в атмосферу, способствуют разрушению озонового слоя Земли, а также являются опасными для человека. Поэтому одной из главных задач современного полимерного материаловедения является разработка безгалоидных способов снижения горючести. Однако никакими добавками нельзя полностью предотвратить горение полимеров. Но можно существенно уменьшить скорости горения и распространения пламени и получить самозатухающий материал.
Анализ литературных источников позволил сделать вывод о том, что, как и в ряде других случаев, введение фосфора в структуру акрилатных мономеров (фосакрилаты) может быть успешно использовано для решения этой проблемы.
Целью данной работы является изучение синтеза фосфорсодержащих метакрилатов на примере переэтерификации диметилового эфира β - цианоэтилфосфоновой кислоты 2-гидроксиэтилметакрилатом (МЭГ) с образованием ди(2-метакрилоил β-оксиэтилового) эфира 2 - цианоэтилфосфоновой кислоты, а также подготовка исходных данных для проектирования производства этого фосфорсодержащего соединения.
Для достижения поставленной выше цели, проводились экспериментальные работы по проведению и изучению протекания реакции. Реакция переэтерификации, как правило, является довольно длительно идущей реакцией (от 3 до 7 часов), при проведении ее с использованием традиционного нагревания. Представляется перспективным также использование в этом синтезе микроволнового излучения, значительно снижающего время протекания реакции (в десятки и сотни раз) по сравнению с традиционно используемым нагреванием.
На основании проведенных лабораторных исследований этого процесса, а также в результате анализа литературных источников, были получены данные, представленные в настоящей работе.
Пояснительная записка содержит следующие разделы:
· Общие сведения о технологии, где представлено производство аналогов предлагаемого продукта, а также их сравнение. Кроме того, указаны характеристики и схема лабораторной установки, на которой проводилось изучение процесса переэтерификации диметилового эфира β -цианоэтилфосфоновой кислоты 2-гидроксиэтилметакрилатом;
· Технико-экономическое обоснование рекомендуемого способа производства, а также его перспективы. В этом разделе показаны возможности использования побочных продуктов для получения исходных реагентов. Таким образом, достигается безотходность производства;
· Литературный обзор представляет собой анализ литературных источников по проектируемому производству;
· Нормативно-техническая документация на сырье, вспомогательные материалы и продукцию, где указаны нормативные документы на эти соединения, а также условия их хранения, транспортировки, упаковки;
· Физико-химические и теплофизические свойства исходных, промежуточных, побочных, целевых продуктов и отходов. В этом разделе приводятся физико-химические константы и характеристики исходных, побочных и конечных продуктов;
· Физико-химические основы технологических процессов, где проводится анализ физико-химических превращений, их химизм, приведен механизм основной реакции;
· Описание технологической схемы. В этом разделе предлагается новая технологическая схема производства целевого продукта методом переэтерификации, а также ее описание;
· Данные для расчета основного оборудования. Приведены рекомендации и обоснования выбора оборудования;
· Аналитический контроль производства. Приводится перечень необходимых методов анализа, применяемых в предлагаемой технологии, а также периодичность аналитических испытаний;
· Выводы и рекомендации. В этом разделе обобщены основные выводы всех разделов и приводятся рекомендации к разрабатываемому технологическому процессу.
Общие сведения о технологии
Производств предлагаемого продукта переэтерификации (ди (2- метакрилоил β-оксиэтилового) эфира 2-цианоэтилфосфоновой кислоты) в России в настоящее время не существует.
Аналогичный продукт – фосфорсодержащий диметакрилат. Он образуется в результате взаимодействия дихлорангидрида метилфосфоновой кислоты с глицидиловым эфиром метакриловой кислоты:
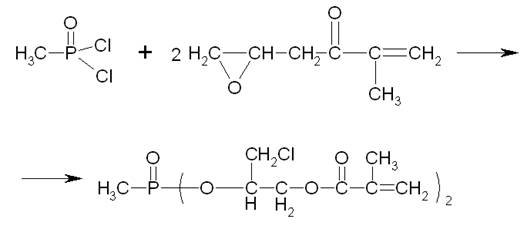
Массовая доля фосфора в этом продукте составляет 6,5-7,5%. Кислотное число, на 1 г продукта, не более 25,0 мг КОН. Массовая доля гидрохинона, %, в пределах 0,3-0,4. Массовая доля глицидинметакрилата, %, не более 2,0. Вязкость кинематическая, в пределах 500-1200 сСт. Трудногорючее вещество с температурой вспышки в открытом тигле 196 °С. Температура воспламенения – 218 °С.
В предлагаемом продукте переэтерификации диметилового эфира β-цианоэтилфосфоновой кислоты МЭГом, содержание фосфора составляет 8,62%.
Следовательно, для получения одинакового эффекта – снижения горючести, требуется меньшее количество вещества.
Кроме этого, в составе производимого ФОМ-II имеется хлор, что является отрицательным фактором, поскольку при пиролизе соединений, полученных на его основе, образуются вредные соединения, например, HCl и фосген.
В предлагаемом продукте хлор отсутствует. Сравнительная характеристика ФОМ-II и ди(2-метакрилоил β-оксиэтилового) эфира 2 - цианоэтилфосфоновой кислоты представлена в табл. 1.
Таблица 1 Сравнительная характеристика ФОМ-II и ди(2-метакрилоил β-оксиэтилового) эфира 2-цианоэтилфосфоновой кислоты
| Характеристики | ФОМ-II | Ди(2-метакрилоил β-оксиэтиловый) эфир 2-цианоэтилфосфоновой кислоты |
| Молекулярная масса | 417 | 359,3 |
| Содержание фосфора | 6,5-7,5% | 8,62% |
| Наличие галогена | 2 атома Cl в молекуле | нет |
| Наличие азота | нет | есть |
Для получения указанного продукта в лабораторных условиях проводился синтез на установке, показанной на рис. 1.
Установка состоит из колбы Кляйзена 2 с обратным водяным холодильником 3, силиконовой бани 4, термометров 1, электроплитки 5, а также приемника метанола 6.
Синтез в лаборатории проводился следующим образом: в колбу Кляйзена 2, снабженную водяным холодильником 3, помещали отмеренное количество диметилового эфира β-цианоэтилфосфоновой кислоты. Добавляли моноэтиленгликольметакрилат (МЭГ), в расчетном количестве, необходимом для протекания реакции переэтерификации, а также около 1 % (от массы МЭГ) гидрохинона для ингибирования полимеризации МЭГа. Нагревали с помощью электроплитки силиконовую баню 4 до температуры 170-180°С и выдерживали эту температуру в течение 5-6 часов.
По мере протекания реакции переэтерификации, проходя через водяной холодильник, конденсируются пары метанола, который собирается в приемник. По количеству собранного в приемнике метанола судят о степени завершенности реакции.
При проведении лабораторного синтеза были использованы количества реагентов, представленные в табл. 2.
Таблица 2
Количества исходных и конечных продуктов лабораторного синтеза
| Исходные вещества | Количество | Конечные вещества | Количество | ||||
| Теоретич. | Практич. | ||||||
| г | моль | г | моль | г | моль | ||
| МЭГ | 11,1 | 0,085 | Метанол (отгон) | 2,72 | 0,085 | 8,36 | 0,261 |
| Диметиловый эфир β-циано-этилфосфоновой кислоты | 6,96 | 0,043 | Продукт переэтерификации (остаток в кубе) | 15,35 | 0,043 | 9,7 | 0,027 |
| Гидрохинон | 0,1 |
9,1·10-4 |
Гидрохинон | 0,1 |
9,1·10-4 |
0,1 |
9,1·10-4 |
| ИТОГО | 18,16 | 0,129 | ИТОГО | 18,16 | 0,129 | 18,16 | 0,345 |
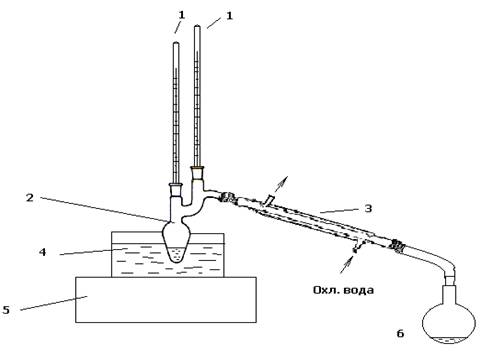
Рис.1 Лабораторная установка для проведения переэтерификации диметилового эфира β-цианоэтилфосфоновой кислоты 2 - гидроксиэтилметакрилатом1-термометры; 2-колба Кляйзена; 3-обратный холодильник; 4-силиконовая баня; 5-электроплитка; 6-приемник метанола
Таким образом, в результате лабораторного синтеза были получены следующие экспериментальные данные:
· Выход целевого продукта 63,2 %;
· Температура реакции 170-180°С;
· Время реакции 5,5 часов.
Технико-экономическое обоснование рекомендуемого способа производства. Перспективы производстваПотребность в негорючих и самозатухающих полимерных материалах на сегодняшний день является актуальной в связи с тем, что полимеры занимают все больше места во всех сферах промышленности, строительстве, и т.д.
Предлагаемый продукт может найти свое применение в качестве антипиреновой добавки в различные полимерные материалы, например, его можно добавлять при полимеризации дивинила, винилхлорида, и др.
Образующийся как побочный продукт, метанол, используется для синтеза диметилфосфита (ДМФ), из которого, взаимодействием его с акрилонитрилом (в присутствии алкоголята натрия, при охлаждении), получают требующийся диметиловый эфир β-цианоэтилфосфоновой кислоты:
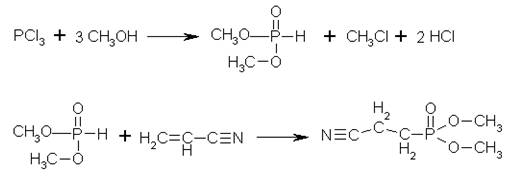
Таким образом, получаем практически безотходное производство, в котором конечный продукт – метанол идет на производство исходного реагента.
Все исходные реагенты – МЭГ, акрилонитрил, треххлористый фосфор, гидрохинон – производятся в промышленных масштабах, поэтому их использование не представляет никаких затруднений.
В предлагаемом продукте переэтерификации содержание фосфора составляет 8,62%, что снижает его необходимое количество при добавлении в полимеры, для снижения их горючести, по сравнению с аналогом.
Отсутствие атомов галогенов в составе продукта также является бесспорно положительным, поскольку при нагревании модифицированных этим соединением полимеров не выделяется вредных веществ.
Таким образом, рекомендуемое производство является перспективным для получения малотоксичных полимерных материалов пониженной горючести.
Методы получения фосфорсодержащих (мет)акрилатов (литературный обзор)Применение фосфорсодержащих (мет)акрилатов
Многие основные способы ингибирования горения полимеров основаны, как правило, на применении хлор- бромсодержащих антипиренов, а также на модификации полимеров хлор- или бромсодержащими соединениями. Но «в то же время, сейчас уже однозначно установлено, что эти элементы, попадая в атмосферу, способствуют разрушению озонового слоя Земли. Поэтому одной из главных задач современного полимерного материаловедения является разработка безгалоидных способов снижения горючести» [1]. Однако никакими добавками нельзя полностью предотвратить горение полимеров. Но можно существенно уменьшить скорости горения и распространения пламени и получить самозатухающий материал.
Анализ литературных источников [2], [4] по снижению горючести полимерных материалов позволил сделать вывод о том, что, как и в ряде других случаев, введение фосфора в структуру акрилатных мономеров (фосакрилаты) может быть успешно использовано для решения этой проблемы.
Эффективное действие соединений фосфора в качестве замедлителей горения обеспечивают следующие факторы [3]:
1) специфическое влияние фосфорных соединений на процессы, протекающие в конденсированной фазе при горении полимера: химические превращения полимеров осуществляются в направлении увеличения выхода нелетучего карбонизованного остатка и уменьшения летучих продуктов пиролиза;
2) образование поверхностного стеклообразного или вязкого расплавленного слоя полифосфорных кислот, который служит физическим барьером для переноса тепла от пламени к полимеру и диффузии реагентов;
3) ингибирование газофазных пламенных реакций;
4) влияние на гетерогенное окисление карбонизованного остатка, образующегося при пиролизе полимеров.
Как показали исследования процессов термической и термоокислительной деструкции полимерных материалов в присутствии замедлителей горения, наибольший огнезащитный эффект дают вещества, замедляющие массо-теплопередачу за счет разложения с эндотермическим эффектом в узком температурном интервале, совпадающем с началом интенсивного разложения модифицируемого полимера. По информации [3] «фосфорсодержащие соединения, включающие С—Р и Р—N связи, обеспечивают более высокую термостабильность полимера, причем наличие фосфорамидной группы может способствовать проявлению фосфор-азотного синергизма — усиливать процесс дегидратации и карбонизации полимера».
Методы синтеза фосфорсодержащих (мет)акрилатов
Ниже рассмотрены различные способы получения фосфорсодержащих мономеров и олигомеров акрилового ряда.
Общим универсальным методом синтеза фосфорорганических веществ является перегруппировка Арбузова. Этот способ используется также и для получения непредельных фосфорсодержащих соединений [2].
Триалкил(арил)фосфиты вступают в реакцию Арбузова и с галогеналкиловыми эфирами акриловых кислот. Фосфорорганические эфиры акриловой кислоты, содержащие амидные группировки, получают реакцией эфира α-бромакриловой кислоты с диамидофосфитами.
Помимо использования для синтеза фосакрилатов по реакции Арбузова триалкил(арил)фосфитов с галогенакрилатом, применяются реакции фосфитов с N-оксиметил-, N-алкоксиметил-, N-ацетоксиметиламидами α, β-непредельных кислот. Скорость процесса при прочих равных условиях лимитируется нуклеофильностью заместителя и зависит также от строения исходного фосфита, температуры и соотношения реагирующих веществ. Достаточно большие выходы целевых продуктов можно получить только при температурах около 100 °С и значительном избытке исходного метакрилата. Но, в таких условиях возможна и нежелательная полимеризация мономеров и образование побочных продуктов.
Фосфорорганические акрилаты получены также реакцией солей щелочных металлов кислот фосфора с галогенсодержащими производными α ,β-ненасыщенных карбоновых кислот.
Так диалкиловые эфиры (мет)акрилоилалкилфосфоновых кислот получают по схеме [2]:
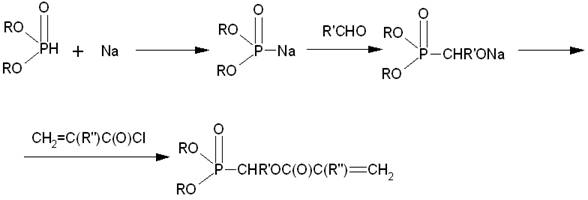
Диалкилфосфонакрилаты таким способом получают при температурах 20-40 °С за 1-2 часа. При взаимодействии диметилфосфита натрия с менее реакционноспособным β-хлорэтиловым эфиром метакриловой кислоты (реакция Михаэлиса-Беккера) целевой продукт β - метакрилоксиэтилдиметилфосфонат образуется с низким выходом.
Для синтеза фосакрилатов могут быть использованы реакции калиевых и натриевых солей кислот акрилового ряда с галогенпроизводными фосфора. Этим методом получены смешанные ангидриды α-замещенных акриловых кислот и кислот фосфора. Ангидриды кислот пятивалентного фосфора термически неустойчивы, и при перегонке в вакууме происходит их диспропорционирование с образованием ангидридов непредельных кислот и соответствующих производных пирофосфорной и пирофосфоновой кислот. В отличие от них диэтилметакрилоилфосфиты более стабильны, в процессе перегонки не претерпевают диспропорционирования и получаются с удовлетворительными выходами.
Нитрилы кетокарбоновых кислот с хлоридами фосфора в присутствии третичных аминов образуют фосфорилированные производные акрилонитрилов.
Диалкил-1-акрилоилокси-, диалкил-1-метакрилоилокси-2-алкенил-1-фосфо- наты синтезированы присоединением диалкилфосфита к α-, β-ненасыщенным альдегидам по карбонильной группе с последующей обработкой образующихся α-оксиспиртов хлорангидридами акриловой и метакриловой кислот. В реакцию с хлорангидридами акриловой и метакриловой кислот вступают и оксиалкилфосфиновые кислоты, а также производные циклических фосфиновых кислот фосфоленового ряда.
Для получения фосфорсодержащих олигоэфирметакрилатов применяется метод конденсационной теломеризации: введение в реакцию поликонденсации наряду с ди- и полифункциональными соединениями, монофункциональных производных кислот акрилового ряда. Например, поликонденсацией дихлорангидрида фенилфосфоновой кислоты с гидрохиноном (или диэтиленгликолем) и хлорангидридом метакриловой кислоты могут быть получены фосфорорганические олигоэфирметакрилаты. Реакция проводится при температуре от 30 до 140 °С с постоянной отдувкой выделяющегося хлористого водорода [2]. Полученные таким способом олигомеры отличаются повышенной кислотностью, что, скорее всего, связано с частичным разрушением эфирных связей, выделяющимся в процессе реакции хлористым водородом.
Реакции этерификации и переэтерефикации, используемые для синтеза сложных эфиров, применяют также и для получения фосфорсодержаших метакрилатов.
Хлорметилированные олигомеры также получают совместной поликонденсацией триарил-, три(алкиларил)-, трихлоралкиларилфосфатов с хлорметилированными производными дифенилоксида, обрабатывая реакционную массу пятикратным избытком смеси ненасыщенной кислоты и амина при температуре 70-100 °С в инертном растворителе. Продукты хорошо растворимы во многих органических растворителях, а также в стироле и бензилметакрилате, что позволяет использовать их для получения сополимеров [2].
Переэтерификацией триалкил- или тригалогеналкилфосфитов монометакриловыми и акриловыми эфирами этиленгликоля синтезированы диалкиловые и ди-β-галогеналкиловые эфиры акрилоил(метакрилоил)оксиэтилфосфористой кислоты. Переэтерификация осуществляется при температурах 70-140 °С и пониженном давлении (15-55 мм.рт.ст.).
Переэтерификация средних фосфитов
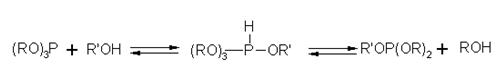
Эфиры кислот трехвалентного фосфора легко вступают в реакцию переэтерификации, причем, в зависимости от условий ее проведения, строения исходных реагентов и, что особенно важно, их соотношения, она протекает с участием всех эфирных групп или только части их [12], [13]. В первом случае образуются симметричные эфиры, во втором — смешанные:
(RO)3P + 3 R'OH![]() (R'O)3P
(R'O)3P
(RO)3P + 2 R'OH![]() (R'O)2POR
(R'O)2POR
(RO3)P + R'OH![]() (RO)2POR'
(RO)2POR'
Наиболее подробно реакция изучена на примере алкоголиза триэтилфосфита.
Так, например, [5] при молярном соотношении триэтилфосфит : спирт, близком к 1:3—1:4, в присутствии ортофосфорной кислоты могут быть получены с выходами 30—50% тригексил-, триоктил-, тринонил-, трицетил- и трициклогексилфосфиты. Достаточно небольшой выход продуктов полной переэтерификации объясняется тем, что при указанном соотношении реагентов образуются в значительных количествах смешанные фосфиты. Даже при соотношении фосфит:спирт более чем 1:5, в продуктах реакции обнаруживаются несимметричные фосфиты. Если соотношение фосфит:спирт достигает 2:1, то реакция может быть остановлена на первой стадии, т. е. на образовании главным образом продуктов монозамещения [5].
Образующиеся при этом смешанные фосфиты, (RO)2POR', могут вступать в реакцию с другим спиртом, образуя фосфиты, содержащие три различных алкоксигруппы:
(RO)2POR' + HOR"![]() (RO) (R'O) (R"O)P
(RO) (R'O) (R"O)P
Производные низших спиртов неустойчивы и легко диспропорционируют при перегонке. Смешанные эфиры с остатками высших спиртов более стойки к диспропорционированию: бутилдигексилфосфит при перегонке практически не изменяется.
Большое влияние на характер переэтерификации оказывает строение исходного спирта. В то время как алкоголиз триалкилфосфитов первичными и вторичными спиртами протекает нормально, при взаимодействии триэтилфосфита с трет-амиловым спиртом были выделены диэтилфосфит и амилен:
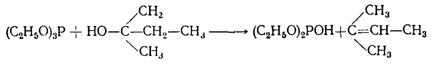
Триалкилфосфиты переэтерифицируются не только одноатомными, но и многоатомными спиртами. Однако данные по этому вопросу малочисленны и недостаточно обоснованы.
При взаимодействии триалкилфосфитов с триметилолалканами образуются продукты полной переэтерификации — бициклические фосфиты, синтез которых другими способами затруднителен:
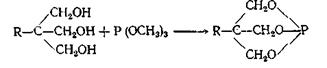
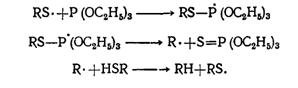
Фосфиты не переэтерифицируются меркаптанами; при взаимодействии этих реагентов получаются углеводороды и тиофосфаты:
![]()
Реакция катализируется свободными радикалами и, скорее всего, протекает по радикальному механизму:
При использовании гликолей с пространственно удаленными гидроксилами (n>5) отмечено образование полимерных продуктов, которые, однако, не были охарактеризованы.
Переэтерификация кислых фосфитов
Диалкил- и диарилфосфиты, аналогично средним фосфитам, переэтерифицируются одноатомными спиртами, гликолями и многоатомными фенолами. Реакция протекает ступенчато (полная и частичная) и может быть оборвана на стадии образования несимметричных фосфитов.
Полную переэтерификацию диалкилфосфитов использовали впервые Арбузов и Виноградова для синтеза высших диалкилфосфитов [5]. При молярном соотношении фосфит:спирт, равном 1:2, в присутствии ортофосфорной кислоты они получили симметричные диалкилфосфиты в смеси со значительными количествами несимметричных фосфитов — продуктов частичного алкоголиза.
При взаимодействии диалкилфосфитов с циклогексанолом, бензиловым спиртом, 2-октанолом и этиленгликолем получалась сложная смесь, из которой не удалось выделить индивидуальные вещества. Позднее было установлено, что образование продуктов переэтерификации ускоряется в присутствии щелочных катализаторов и увеличении молярного соотношения спирт:фосфит. При соотношении фосфит:спирт, равном 1:3, в присутствии алкоголята натрия симметричные диалкилфосфиты были получены с выходом 70—90%.
Полная переэтерификация диалкилфосфитов алифатическими спиртами гладко протекает в ксилоле (с выходами до 85%) и в отсутствие катализаторов. Этим способом получены ди-(2-этилгексил)-фосфит и ди-β-хлорэтилфосфит; последний в присутствии ортофосфорной кислоты без растворителя образуется с выходом только 43%.
Так, при молярном соотношении реагентов 1:1 в присутствии ортофосфорной кислоты, алкоголята натрия, или в отсутствие катализатора образуются смешанные диалкилфосфиты с выходом 24—45% [5].
Несимметричные фосфиты можно применять для получения разнообразных несимметричных эфиров фосфорной и фосфиновых кислот отдельные представители которых обладают физиологической активностью.
Большой интерес представляет переэтерификация диалкилфосфитов гликолями. В результате переэтерификации диалкилфосфитов гликолями, главным образом этиленгликолем (в сходных условиях), получаются полимерные продукты.
Например, при переэтерификации диэтилфосфита диэтиленгликолем, тетраэтиленгликолем, гексаэтиленгликолем, пропиленгликолем-1,2; бутиленгликолем-1,3; бутиленгликолем-1,4; 2-бутиндиолом-1,4 и диэтаноламином образуются полиэфиры, состоящие из 2—3 остатков исходных веществ [5].
Высокомолекулярные полифосфиты легко образуются при реакции диэтилфосфита и других простейших диалкилфосфитов с гликолями, обладающими пространственно-разобщенными гидроксилами или неустойчивыми в конформациях со сближенными гидроксилами:
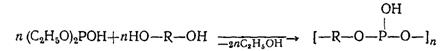
Механизм реакции переэтерификации эфиров кислот трехвалентного фосфора
Механизм реакции переэтерификации эфиров кислот трехвалентного фосфора подробно не изучен. Предполагается, что механизм этой реакции состоит в чередующихся процессах присоединения протона к атому фосфора, алкоксил-аниона — к фосфоний-катиону и отщепления спирта от промежуточного продукта с пятивалентным фосфором с образованием исходного или другого фосфита или фосфинита:
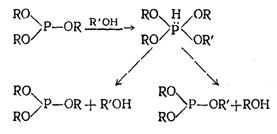
Косвенным подтверждением образования промежуточного продукта присоединения являются данные по изучению механизма реакции Арбузова и ее различных вариантов, а также экспериментальные материалы по алкоголизу зфиров кислот трехвалентного фосфора.
Первый акт реакции является необходимым, но недостаточным для осуществления переэтерификации фосфита (фосфинита). Образовавшийся аддукт, как показано выше, может расщепляться по двум направлениям. При алкоголизе любого фосфита любым спиртом устанавливается равновесие:
Переэтерификация произойдет в том случае, если равновесие сдвинуто вправо, т. е. если отщепится от аддукта алкоксил (или остаток фенола) исходного фосфита, а не алкоксил спирта, взятого для переэтерификации. Таким образом, решающее влияние на процесс переэтерификации оказывает второй акт реакции — расщепление продукта присоединения, который, по-видимому, определяет не только направление реакции, но и ее скорость.
Решение вопроса о том, какая молекула спирта будет отщепляться от промежуточного продукта, находится в прямой зависимости от электрофильности алкокси(фенокси)-групп, входящих в его состав. Очевидно, чем электрофильнее алкоксил, тем предпочтительнее он будет отщепляться вместе с протоном в виде «более кислого» спирта. Следовательно, при получении фосфитов методом переэтерификации желательно брать исходный фосфит с алкоксигруппами более электрофильными, чем алкоксил спирта, используемый в реакции.
Равновесие реакции переэтерификации можно сдвинуть вправо и путем отгонки выделяющегося спирта. Этим приемом широко пользуются при получении разнообразных фосфитов, когда выделяющийся спирт кипит ниже исходного.
Другой возможный механизм [5] заключается в атаке атома кислорода алкилкатионом (образующимся в результате гетеролитического расщепления спирта) и одновременного выделения алкилкатиона исходного эфира:

Однако это направление реакции имеет второстепенное значение, как при переэтерификации l- и d-бутанолами-2 и оптически активным пентанолом получаются фосфиты, дающие при гидролизе спирты, в первом случае — с 75% оптической активности от первоначальной, и во втором,— 100%. В том случае, если бы реакция протекала только по второму направлению, при гидролизе продуктов переэтерификации должны были бы образоваться оптически неактивные спирты.
Представляется перспективным использование в этих синтезах микроволнового излучения, значительно снижающего время протекания реакции (в десятки и сотни раз) по сравнению с традиционно используемым нагреванием.
Нормативно-техническая документация на сырьё, вспомогательные материалы и готовую продукциюГидрохинон
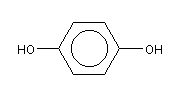
Химическая формула:
C6H4(OH)2
Квалификация «ч», ГОСТ 19627-74;
Внешний вид: кристаллы от белого до беловато-серого цвета (возможен желтоватый оттенок). При продолжительном воздействии света кристаллы гидрохинона темнеют и теряют блеск.
Фасовка: мешки по 0,5 или 25 кг.
Метакриловый эфир этиленгликоля (МЭГ) C6H10O3
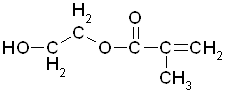
Величина ПДК рабочей зоны 20 мг/м3 (согласно ГОСТ 12.1.005-88), класс опасности IV.
Плотность (20 °C) 1.069 - 1.072 г/см3, массовая доля основного вещества 97%.
Поставляется наливом (ж/д цистерны, автоцистерны, кубы 1000 л, бочки 200л, 100 л).
Нормативно-технических документов (ГОСТ, ТУ) на диметиловый эфир β-циано-этилфосфоновой кислоты, а также конечный продукт нет, поскольку эти вещества не производятся промышленно.
Физико-химические и теплофизические свойства исходных, промежуточных, побочных, целевых продуктов и отходов производстваГидрохинон
При нормальных условиях представляет собой кристаллы от белого до беловато-серого цвета. При продолжительном воздействии света кристаллы гидрохинона темнеют и теряют блеск.
Хорошо растворим в воде, спирте, МЭГ, эфире.
Температура плавления равна 172 °С;
Температура кипения составляет 285 °С;
Метакриловый эфир этиленгликоля (МЭГ) C6H10O3
Бесцветная прозрачная жидкость.
Величина pH 4.0 (500 г/л, H2O, 20 °C);
Температура плавления -12°C;
Температура воспламенения 101 °C;
Температура кипения: 250 °C (760 мм.рт.ст.); 95°C (9 мм.рт.ст.);
Плотность (20 °C) 1,069 – 1,072 г/см3;
Содержание основного вещества 97%;
Хорошо растворим в воде, спирте.
Диметиловый эфир β-цианоэтилфосфоновой кислоты [26]:
Бесцветная жидкость.
Температура кипения составляет 127-129 °С при давлении 4 гПа;
Плотность (20 °С) составляет 1,1970 г/см3;
Продукт переэтерификации (ди(2-метакрилоил β-оксиэтиловый) эфир 2-цианоэтилфосфоновой кислоты)
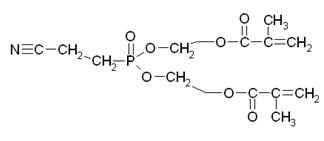
Представляет собой бесцветную, прозрачную, подвижную жидкость склонную к самопроизвольной полимеризации. Для ее предотвращения необходима стабилизация продукта гидрохиноном (около 1% масс.).
Метанол (карбинол) СH3ОН:
Бесцветная легкоподвижная жидкость с характерным запахом этилового спирта.
Молекулярная масса 32,04;
Плотность 0,7923;
Температура плавления -97,8 °С;
Температура кипения 64,7 °С;
Неограниченно растворим в воде, этиловом спирте и эфире.
Физико-химические основы технологических процессовОсновная реакция, протекающая в данном технологическом процессе – переэтерификация. Ее механизм представлен ниже:
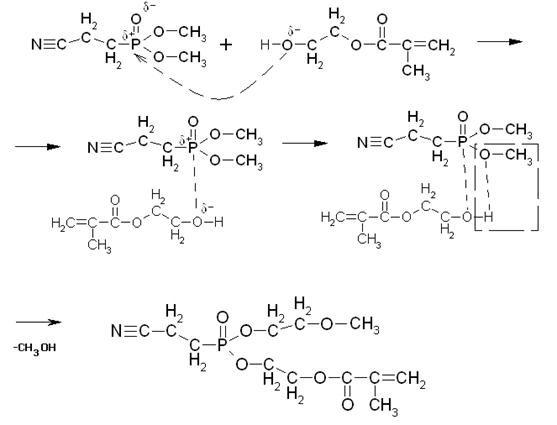
Кислородный атом имеет свойство оттягивать на себя электронную плотность с соседних менее электроотрицательных атомов. В связи с этим, на атоме кислорода образуется частичный отрицательный заряд δ-, а на атоме фосфора – положительный δ+.
Атом кислорода гидроксильной группы в молекуле МЭГ также имеет частичный отрицательный заряд δ-, и под действием сил электростатического притяжения приближается к атому фосфора, имеющему противоположный заряд.
Таким образом, образуется новая связь между атомом фосфора и кислородом МЭГ. Причем эта связь более сильная, чем имеющаяся в эфире связь Р-О, которая ослабляется, и в конечном итоге разрывается, при этом образуется продукт неполной переэтерификации и молекула метанола.
Далее со второй молекулой МЭГ механизм аналогичен:
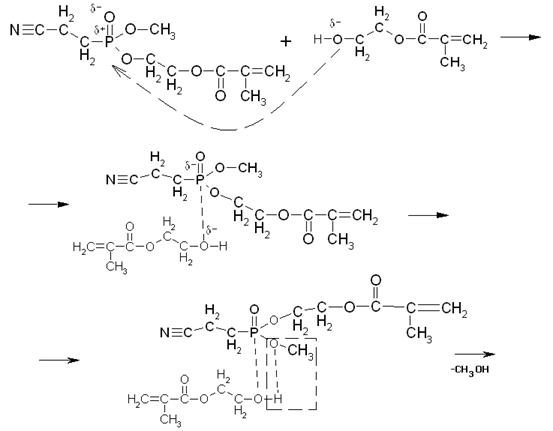
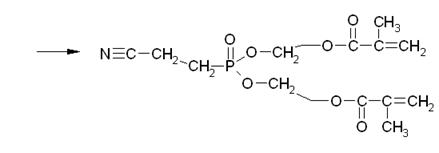
Таким образом, в результате переэтерификации может образоваться и побочный продукт неполной переэтерификации.
Кроме того, в системе также могут протекать и другие побочные реакции, например, полимеризация МЭГ, полимеризация продукта переэтерификации и т.д.:
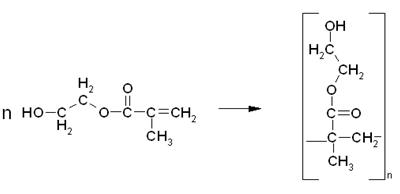
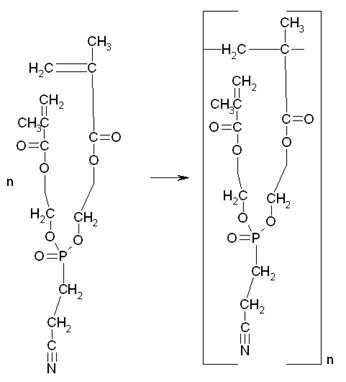
Таким образом, в реакционной смеси может присутствовать, как продукт полной переэтерификации, так и продукт неполной, а также полимеры и олигомеры 2-гидроксиэтилметакрилата, и продукта переэтерификации.
Определенный согласно закону Гесса, тепловой эффект реакции составляет -10986,9 Дж/моль, реакция протекает с поглощением тепла.
Кинетические закономерности переэтерификации рассмотрены. Более подробно в литературе рассматриваются реакции переэтерификации в присутствии катализаторов (третичные и четвертичные амины, а также большое число различных солей металлов). Катализаторами переэтерификации является множество веществ самого разного характера, что позволяет отнести описываемый процесс к реакциям кислотно-основного типа катализа, в котором имеет место промежуточное кислотно-основное взаимодействие реагирующих веществ с катализатором, т. е. переход протона от катализатора к одному из реагирующих веществ или, наоборот, от реагирующего вещества к катализатору. При последующих стадиях протон перемещается обратно, и катализатор восстанавливает свой состав. Случай катализа недиссоциированными молекулами является частным случаем кислотно-основного катализа.
На рис. 2 приведены кинетические кривые хода переэтерификации при разных температурах для смешанного катализатора, состоящего из ацетата цинка и окиси свинца [27]. Практически реакция переэтерификации, о ходе которой, чаще всего, судят по выделению метилового спирта, не начинается ниже 150 °С. Только при 175 °С и выше достигается достаточно высокая степень конверсии.
Реакция переэтерификации с различными катализаторами может заканчиваться на разном кажущемся равновесии. Последнее объясняется потерей активности катализатором в ходе процесса. Для соединений с различными катионами потеря активности не одинакова.
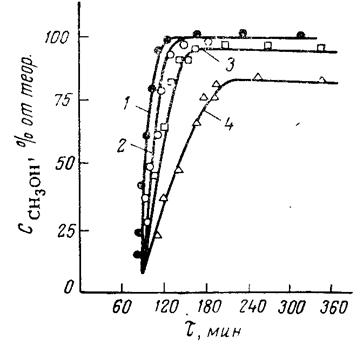
Рис. 3. Кинетика переэтерификации при различных температурахс катализатором Zn(OAc)2 + PbO (0,2%) 1 – 215 °С; 2 – 200 °С; 3 – 175 °С; 4 – 152 °С;
Описание технологической схемыПоскольку изучаемый процесс переэтерификации проводился лишь в лабораторных условиях и не имеется в промышленном производстве, была предложена технологическая схема, которая представлена на рис. 3.
Согласно предложенной технологической схеме, процесс протекает следующим образом. Из емкостей хранения поз. 7 и 8, насосами 10 подаются соответственно диметиловый эфир β-цианоэтилфосфоновой кислоты и МЭГ подаются в мерные емкости поз. 2 и 1. Необходимое количество ингибитора полимеризации МЭГа – гидрохинона взвешивают на весах поз. 4 и добавляют в реактор 6 непосредственно перед началом реакции.
Далее, МЭГ и диметиловый эфир β-цианоэтилфосфоновой кислоты из мерных емкостей поступают в реактор. Реактор герметизируют, включают привод мешалки, подают высокотемпературный органический теплоноситель (например, дифенильную смесь) с температурой не менее 180 °С в рубашку реактора, устанавливают требуемую температуру (170 °С) и поддерживают ее во время реакции. ВОТ нагревается в газовой трубчатой печи 12, и непрерывно циркулирует с помощью насоса.
По мере протекания реакции, выделяющиеся пары метанола конденсируются в конденсаторе 5, и поступают в сборник 9. Полученное количество метанола регистрируется датчиком уровня, и, исходя из его показаний, определяется степень завершенности реакции.
После отгонки рассчитанного количества метанола в сборник 9, реакция считается завершенной, подачу теплоносителя в рубашку реактора прекращают, продукт реакции самотеком сливают в емкость 11.
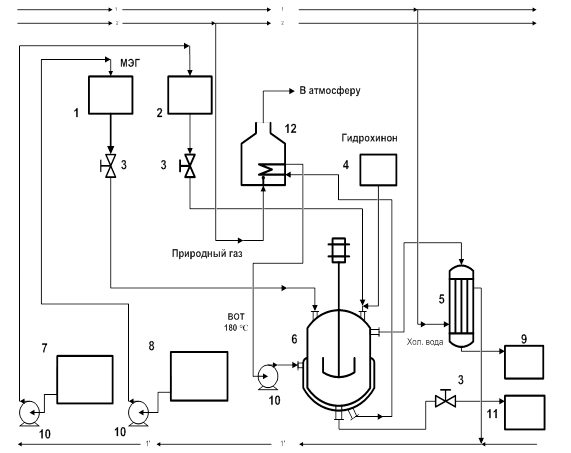
Рис. 3. Технологическая схема произведения процесса переэтерификации диметилового эфира β-цианоэтилфосфоновой кислоты МЭГом
1-мерная емкость для МЭГ; 2-мерная емкость для эфира; 3- регулирующая запорная арматура; 4-весы для дозировки гидрохинона; 5- холодильник-конденсатор; 6-реактор; 7- емкость для хранения эфира; 8-емкость хранения МЭГ; 9-емкость для сбора метанола; 10-насосы; 11-емкость для целевого продукта переэтерификации ,12-трубчатая печь.
1-1 – линия холодной воды;
2-2 – линия природного газа;
1΄-1΄ - обратная линия воды.
Данные для расчета и выбора основного технологического оборудованияВ предлагаемой технологической схеме производства применяется процесс переэтерификации, протекающий в одну стадию, подготовка и загрузка реагентов, а также удаление из реактора продуктов.
Технологическое оборудование на стадии подготовки реагентов включает в себя емкости для хранения – стальные сосуды, объемом около 0,5 м3, применяемые без эмалирования, поскольку как диметиловый эфир β-цианоэтилфосфоновой кислоты, так и 2-гидроксиэтилметакрилат являются неагрессивными жидкостями. Дополнительным условием является содержание емкости с моноэтиленгликольметакрилатом при температуре ниже нормальной (достаточно поместить их в грунт на глубину около 1 м), поскольку склонность к полимеризации даже при нормальных условиях достаточно высока.
В технологической схеме используется реактор смешения объемом около 0,1 м3, снабженный рубашкой и якорной мешалкой, приводом мешалки. Изнутри реактор необходимо покрыть эмалью, поскольку при нарушении параметров технологического процесса может образоваться полимеризат, налипающий на стенки и дно реактора.
Холодильник, используемый для конденсации метанола – стандартный, так как, метанол, его пары в трубном пространстве, и охлаждающая вода – в межтрубном, не являются агрессивными или веществами со специфическими свойствами.
Приемники для метанола и продукта переэтерификации, по конструкции и материалу, из которого они изготовлены, аналогичны сосудам для хранения эфира или 2-гидроксиэтилметакрилата.
Аналитический контроль производстваАналитический контроль производства ди(2-метакрилоил β- оксиэтилового) эфира 2-цианоэтилфосфоновой кислоты сводится к определению количества метанола, выделяющегося в процессе производства, и анализу конечного продукта – на содержание фосфора и азота.
Степень завершенности реакции, определяемая по количеству метилового спирта в сборнике может контролироваться автоматически с помощью, например, ультразвукового датчика уровня метанола. Как только достигается требуемый уровень метанола, соответствующий заданной степени превращения, автоматизированная система прекращает подачу теплоносителя в реактор.
Анализ содержания фосфора и азота в конечном продукте – лабораторные методы.
Анализ содержания фосфора проводится в заводской лаборатории методом мокрого калориметрического сжигания с фосфор-молибденовым комплексом.
Содержание азота в конечном продукте определяют микрометодом – сжиганием по Кьельдалю в токе кислорода в платиновой корзинке.
Перечень специального оборудования:
1. Установка для сжигания по Кьельдалю – 1шт;
2. Установка для мокрого сжигания – 1шт;
3. ФЭК – 1 шт;
4. Автоматизированная система контроля и управления технологическим процессом на базе ЭВМ, с датчиком уровня метанола, и соответствующим программным обеспечением – 1 шт;
5. Лабораторная посуда.
Может применяться также универсальный прибор DK-20 итальянской фирмы VELP Scientifica, имеющий широкий диапазон температур сжигания (от комнатной до 450°C), и способный удовлетворить требования, как стандартного метода сжигания, так и метода Кьельдаля. Температура нагревательного элемента контролируется электронной системой с микропроцессором, что обеспечивает высокую воспроизводимость параметров сжигания (стабильность температуры нагревательного блока ±0.5 °C). Благодаря эффективной системе удаления дыма, состоящей из помпы и скруббера, прибор может работать без использования колпака или вытяжного шкафа.
Выводы и рекомендации
Как было показано предлагаемый синтез на основе переэтерификации диметилового эфира β-цианометилфосфоновой кислоты 2-гидрокси-этилметакрилатом является перспективным для производства мономеров для получения полимеров пониженной горючести.
Был поведен анализ литературных источников по аналогичным синтезам, и показан механизм протекания основной реакции.
Кроме того, был рассмотрен технологический процесс переэтерификации, предложена технологическая схема для реализации этого процесса в промышленных условиях.
На основании изложенного выше, можно сделать выводы о том, что используемый процесс – периодический, выход продукта составляет 63,2%; реакция протекает при температуре 170-180°С; время реакции 5,5 часов.
Основной аппарат технологической схемы – реактор с якорной мешалкой, внутренняя поверхность которого покрыта эмалью. Реактор снабжен рубашкой, в которую подается высокотемпературный теплоноситель с температурой 170-180 °С.
Основным критерием оценки степени завершенности реакции является количество выделившегося метанола.
Реализацию автоматического контроля и управления за ходом реакции можно осуществить с помощью ЭВМ.
Список литературных источников
1. Горение полимеров и полимерные материалы пониженной горючести, Берлин, А.А. // СОЖ, 1996, №9, с.57-63.
2. Тужиков О.И [и др.] Эластомеры и пластики с пониженной горючестью. Волгоград, ВолгГТУ, 2005. – с.113-114.
3. Снижение горючести текстильных материалов – решение экологических и социально-экономических проблем, Зубкова, Н.С., Антонов, Ю.С.// Российский химический журнал, 2002, Т.XLVI, №1, с.96-102.
4. Новаков И.А., Бахтина Г.Д., Кочнов А.Б. Применение фосфорсодержащих метакрилатов для получения полимерных материалов пониженной горючести. - Материалы науч. конф. – Волгоград, ВолгГТУ, 2000. – С.92-105.
5. Переэтерификация фосфитов и фосфинитов одноатомными и многоатомными спиртами и фенолами, Петров К. А., Гольцова Р. Г // Успехи химии, 1966, Т. 35, Вып. 8, с.1477-1492.
6. Н.Н. Романова, А.Г. Гравис, Н.В. Зык. Микроволновое облучение в органическом синтезе // Успехи химии, 2005, № 11, С. 1059 – 1101.
7. И.В.Целинский, А.С. Брыков, А.А. Астратьев. Влияние микроволнового нагрева на протекание органических реакций различных типов // Журнал общей химии, 1996, № 10, С. 1696 - 1704.
8. О механизме переэтерификации эфиров кислот трехвалентного фосфора, Пудовик А.Н., Евстафьев Г.И // Доклады АН СССР, 1968, Т. 183, №4, с. 842-845.
9. Ремонт микроволновых печей, Сапунов, Г.С. – М.: Солон-Р, 2000. 268 с.
10. Применение микроволновой техники в лабораторных исследованиях и промышленности, Рахманкулов Д.Л. [и др.] // Журнал прикладной химии, 2002, Т. 75, Вып. 9, с. 1409-1416.
11. Высокочастотный нагрев диэлектрических материалов, Княжевская, Г.С., Фирсова, М.Г., Килькеев, Р.Ш. – Л.: Машиностроение, 1989, С. 4.
12. Пурдела Д., Вылчану Р. Химия органических соединений фосфора. – М.: Химия, - 1972. – 752 с.
13. Кирби А., Уоррен С. Органическая химия фосфора. Пер. с англ. Мукменева Э.Т., под ред. Пудовика А.Н. - М.:Мир, 1971.
14. А.С. № 809856 СССР, три-(β-метакрилоил-α-галогенметилэтил)фосфиты в качестве мономеров для термо- и теплостойких полимеров / Хардин А.П.; Каргин Ю.Н.; Ленин А.С.; Тужиков О.И. - 1994.
15. Синтез, свойства и применение гидрофильных полимеров и сополимеров оксиалкиловых эфиров (мет)акриловой кислоты, Асадов З.Г., Алиев В.С. // Успехи химии, 1992, Т. 61, Вып. 5, с.1002-1019.
16. Исследование полипереэтерификации диметилфосфита пентандиолом-1,5, Кириллович, В. И., Рубцова, И. К. Пластические массы, 1966, №7, с. 19 21.
17. Синтез фосфорсодержащих полиэфиров и их применение для получения огнестойких пенополиуретанов, Кирилович, В.И. [и др.] // Пластические массы, 1966, №2, с.10-11.
18. Гефтер Е. Л. Фосфорорганические мономеры и полимеры. М., Изд-во АН СССР, 1960.
19. Рахимов А.И. Синтез фосфорорганических соединений. Гомолитические реакции. - М.: Наука, 1985.
20. Кабачник М.И. Фосфорорганические вещества. - М.: Знание, 1967.
21. Кормачев, В.В., Федосеев, М.С. Препаративная химия фосфора. - Пермь, 1992.
22. Корбридж Д.Е. Фосфор. Основы химии, биохимии, технологии. - М.: Мир, 1982.
23. Нифантьев Э.Е., Кильдишева В.Р., Насоновский И.С., Синтез кислых фосфитов путем этерификации фосфористой кислоты и фосфонистых кислот. Журнал прикладной химии, 1969, №11, с.2590-2593.
24. Гидрофильные сополимеры на основе акрилатов, Е.С. Клюжин, Т.Л. Переплетчикова, М.Б. Фисенко, [и др.] // Пластические массы, 1999, №6, с.40-46.
25. База термодинамических, физических и химических свойств индивидуальных веществ [Электронный ресурс]. – [2006]. – Режим доступа: http://www.webbook.nist.gov/chemistry/
26. Справочник химика. Т.2 Физико-химические свойства веществ. - Л.: 1963, 1168 с.
27. Петухов Б.В., Полиэфирные волокна. – М.: Химия, 1976, 272 с.
28. Эммануэль, Н.М., Кнорре, Д.Г. Курс химической кинетики. – М.: Высшая школа, 1974, 400 с.
29. Аналитическая химия фосфора / Ред. Ю.С.Ляликов; АН СССР. Институт геохимии и аналитической химии. - М.: Б.и., 1974.-219с.
30. Аналитическая химия азота / Волынец В.Ф., Волынец М.П.; Ред. Ю.А. Золотов. - М.: Б.и., 1977.-307с.
Перепечатка материалов без ссылки на наш сайт запрещена