Дипломная работа: Гематологическая характеристика линя из узв и окуня оз. Виштынецкого
Дипломная работа: Гематологическая характеристика линя из узв и окуня оз. Виштынецкого
ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
«КАЛИНИНГРАДСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ»
(ФГОУ ВПО «КГТУ»)
КАФЕДРА АКВАКУЛЬТУРЫ
Зав. Кафедрой Допущена к защите:
проф., д-р биол. Наук Декан факультета биоресурсов
Г.Г. Серпунин и природопользования
доц., канд. биол. наук
К.В. Тылик
ГЕМАТОЛОГИЧЕСКАЯ ХАРАКТЕРИСТИКА ЛИНЯ ИЗ УЗВ И ОКУНЯ ОЗ. ВИШТЫНЕЦКОго
Магистерская диссертация
по направлению 110900.68– Водные биоресурсы и аквакультура
МД 12. 110900.68.802
Научный руководитель диссертации Диссертацию выполнила
проф., д-р биол. наук тудентка гр. 02 ВА/м
Г.Г. Серпунин Е.И. Ушакова
Нормоконтролер
ст. преподаватель Н.Г. Батухтина
2008
Магистерская диссертация 65 с., 28 рис., 11 табл., 69 источников.
ЛИНЬ, ОКУНЬ, САМКИ, САМЦЫ, КРОВЬ, ГЕМАТОЛОГИЯ, ОБЩИЙ БЕЛОК, ГЕМОГЛОБИН, ЭРИТРОЦИТЫ, ЛЕЙКОЦИТАРНАЯ ФОРМУЛА, ЦИТОМЕТРИЧЕСКИЕ ПАРАМЕТРЫ ЭРИТРОЦИТОВ, ВИШТЫНЕЦКОЕ ОЗЕРО.
Объектами исследования являются линь из установки с замкнутым водоснабжением и окунь оз. Виштынецкого Калининградской обл.
Цель работы – изучить гематологические параметры линя, выращенного в искусственных условиях установки с замкнутым водоснабжением и окуня оз. Виштынецкого.
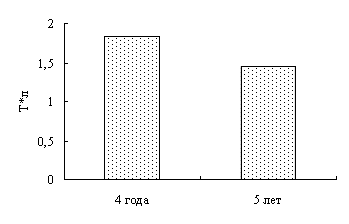
В магистерской диссертации представлена гематологическая характеристика двухгодовалых линей и производителей линя, выращенных в УЗВ. Впервые представлен гематологический статус окуня оз. Виштынецкого.
В результате исследований установлено, что у двухгодовалых линей повышена доля эозинофилов в крови, что указывает на возможное проявление аллергической реакции. Также показано, что кровь самок линя не отличается от крови самцов по концентрационным показателям и составу клеток белой крови. Установлено, что эритроциты самцов имеют большую площадь и периметр, в сравнении с эритроцитами самок линя.
Впервые установлен гематологический статус окуня оз.Виштынецкого.
Наши исследования показали, что с возрастом увеличивается концентрация гемоглобина в крови окуней оз. Виштынецкого, при этом снижается концентрация эритроцитов, доля нейтрофильных метамиелоцитов и больших лимфоцитов. Также с возрастом прослеживается увеличение размеров эритроцитов.
Лейкоцитарная формула окуня, выловленного на двух станциях оз. Виштынецкого, свидетельствует о нормальном физиологическом состоянии окуня и, следовательно, отражает благоприятные экологические условия в оз. Виштынецком.
Для окуня оз. Виштынецкого характерны лучшие гематологические показатели в сравнении с окунем Куршского залива, что свидетельствует о лучшем его физиологическом состоянии,
Masters Dissertation: 65 with. 28 fig., 11 tab., 69 sources.
ТENCH, PERCH, FEMALE, MALE, HAEMATOLOGY, COMMON ANALBUMEN, HAEMOGLOBIN, ERYTROCYTES, LEUKOCYTAL FORMULA, CYTOMETRICAL FACTORS OF ERYTHROCYTES, LAKE MASTER'S THESIS, BLOOD.
The objects of the research is a blood of a tench, raised in unnatural (artificial) conditions of the plant with an self-contained water supply and a blood of perch of Vishtenets in Kaliningrad region.
The purpose of research is to study haemotological factors of tench, raised in unnatural (artificial) conditions of the plant (setting) with an exclusive water supply and to study haemotological factors of perch of Vishtenets.
The haemotological characteristic of two year old Tenchens and sires of a tench, raised in unnatural (artificial) conditions of the plant (setting) with an exclusive water supply presents in the master's thesis. For the first time the haemotological status of a perch of Vishtenets producet here.
As a result of the research is found that in the blood of two year old Tenchens increased the quantity of eosinophils. That could be a demonstration of allergic reaction. Also it shows no difference between indexes of concentration and the structure of white blood cells in the blood of a female atb a male of a tench. Was find out that erythrocytes of a male of tench have bigger area and perimeter compare with the erythrocytes of a female.
Our research shows that the concentracion of haemoglobin in blood of a perch of Vishtenets in Kaliningrad region increases with age, as well the concentracion of erythrocetes, neutrophilic metamyelocites und large lymphocytes reduce. Also the proportions of erythrocetes extend. According to a leucocytal formula of perch of Vishtenets in Kaliningrad region we come to conclusion that physiological condition of perch of Vishtenets in Kaliningrad region is auspicions. It indicates favourable ecological cobditions of the lake.
In comparison with physiological condition of perch of Kyrshskyj Bay a perch of Vishtenets in Kaliningrad region has better haemotological characteristics.
ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
«КАЛИНИНГРАДСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ»
(ФГОУ ВПО «КГТУ»)
Факультет Биоресурсов и природопользования
Кафедра Аквакультуры
Направление 110900.68 – Водные биоресурсы и аквакультура
УТВЕРЖДАЮ
Зав. кафедрой Г.Г.Серпунин
« » 2008 г.
ЗАДАНИЕ
По магистерской диссертации (МД)
Ушаковой Екатерине Ивановне
1. Тема МД «Гематологическая характеристика линя из УЗВ и окуня оз. Виштынецкого»
утверждена приказом по университету от 24.04.2008 № 686оч.
2. Срок сдачи студентом законченной МД 10.06.2008.
3. Исходные данные в МД линь, выращенный в экспериментальной установке с замкнутым водоснабжением аквариальной кафедры аквакультуры и окунь оз. Виштынецкого, кровь, взятая у живых рыб.
4. Содержание расчетно-пояснительной записки (перечень подлежащих разработке вопросов):
1) определить длину, массу, индекс почки, печени и селезенки, лейкоцитарную формулу двухгодовалых линей, выращенных в УЗВ;
2) определить концентрацию гемоглобина, эритроцитов, лейкоцитов, общего белка в сыворотке крови, среднее содержание гемоглобина в эритроците, лейкоцитарную формулу производителей линя, выращенных в УЗВ;
3) определить цитометрические параметры эритроцитов производителей линя, выращенных в УЗВ;
4) определить концентрацию гемоглобина, эритроцитов, лейкоцитов, количество общего белка в сыворотке крови, среднее содержание гемоглобина в эритроците, лейкоцитарную формулу окуня оз. Виштынецкого;
5) определить цитометрические параметры эритроцитов окуня оз. Виштынецкого;
8) провести статистическую обработку полученных результатов.
4.1. Узловой вопрос МД: Характеристика красной и белой крови линя, выращенного в искусственных условиях и окуня из естественных условий
5. Перечень графического материала (с точным указанием обязательных чертежей)
1) Схема экспериментальной УЗВ
2) Копия карты оз. Виштынецкого с указанием места вылова окуня
3) Гистограммы показателей крови линя и окуня
4) Лейкограммы линя и окуня
6. Консультанты по МД, с указанием относящихся к ним разделов работы:
Раздел |
Консультант |
Подпись, дата |
|
| Задание выдал | Задание принял | ||
7. Дата выдачи задания 12.02.08
Руководитель проф., д-р. биол. наук Г.Г.Серпунин
Задание принял к исполнению Е.И.Ушакова
Календарный план
| № п.п | Наименование этапов МД | Срок выполнения этапов работы | Примечание |
| 1 | Изучение литературы по теме диссертации, написание обзора литературы | 12.02.08-14.04.08 | |
| 2 | Изучение методов гематологических исследований и написание раздела «Материал и методика» | 20.10.07-15.05.08 | |
| 3 | Сбор материала по двухгодовалым линям | 29.10.07 | |
| 4 | Сбор материала по производителям линя | 12.05.08 | |
| 5 | Сбор материала по окуню оз. Виштынецкого | 19-20.05.08 | |
| 6 | Обработка материала | 29.10.07-25.05.08 | |
| 7 | Написание разделов по результатам собственных исследований | 15.04.08-02.06.08 | |
| 7 | Составление списка использованных источников | 03.06.08-05.06.08 | |
| 8 | Оформление МД | 09.06.08-10.06.08 |
Студент-магистрант Е.И. Ушакова
Руководитель МД Г.Г. Серпунин
Содержание
Задание
Обозначения и сокращения
Введение
1 Обзор литературы
1.1 Рыбоводно-биологическая характеристика объектов исследования
1.2 Характеристика оз. Виштынецкого
1.4 Основные функции крови в организме рыб
1.5 Органы, участвующие в процессе кроветворения
1.6. Состав, общие свойства крови и причины изменения ее состава
1.7 Форменные элементы крови и их значение
2 Материал и методика
3 Характеристика крови линя, выращенного в искусственных условиях УЗВ
3.1 Характеристика крови двухгодовалого линя.
3.2 Характеристика крови производителей линя, выращенных в условиях УЗВ
4. Гематологическая характеристика окуня оз. Виштынецкого
Выводы
Список использованных источников
Блф – большой лимфоцит
Г – гига (109)
Л – лейкоциты
М – среднее значение показателя
Мн – миелоцит нейтрофильный
Мо – моноцит
Млф – малый лимфоцит
Ммн – метамиелоцит нейтрофильный
ОЧЛф – общее число лимфоцитов
ОЧН – общее число нейтрофилов
Пб – псевдобазофил
Пн – палочкоядерный нейтрофил
Пэ – псевдоэозинофил
Сн – сегментоядерный нейтрофил
Т – тера (1012)
ЦП – цветной показатель
Э – эозинофил
Эр – эритроцит
Эр/Л – отношение эритроцитов к лейкоцитам
А – большая ось эритроцита
В – малая ось эритроцита
Fk – фактор формы круга, Fk = 4РS/P2
Fе – фактор формы эллипса, Fе = S/PAB
Fo – округлость, Fo = 45/Pf2, где f2 - максимальный индекс Фере
Hb – гемоглобин
m – ошибка средней
n – количество исследованных рыб
Р – периметр эритроцита
р – уровень значимости
S – площадь эритроцита
t – температура воды
Важнейшей составной частью обеспечения населения страны пищевой продукцией является рыба, доля которой в рационе питания должна составлять не менее 20 кг в год на душу населения. Однако в последние годы объемы промысла ценных в пищевом отношении видов рыбы значительно сократились. По этой причине потребление рыбы в России на душу населения в настоящее время находится на уровне всего 10-11 кг в год, что значительно ниже медицинской нормы [42].
В условиях, когда уловы океанической рыбы сокращаются, а рыбные запасы внутренних водоемов поддерживаются за счет искусственного воспроизводства, единственным и надежным источником увеличения объемов пищевой рыбопродукции является аквакультура.
Физиологическое состояние рыбы зависит от условий ее выращивания. Поэтому поиск оптимальных решений, направленных на повышение жизнестойкости рыбы и наиболее полной реализации ее роста в различных условиях, становится все более актуальным [9].
Рыбы, как в естественных, так и в искусственных условиях выращивания, подвергаются воздействию различных по природе и происхождению стресс-факторов. При этом стрессовая реакция у рыб сопровождается изменением функционального состояния защитных систем организма и отражается, в первую очередь, на гематологических и иммунологических показателях [41].
Периферическая кровь, как и система крови в целом, обладает ярко выраженными трофической и защитной функциями. Благодаря нейрогуморальной регуляции и другим факторам клеточный состав периферической крови поддерживается на определенном уровне и в определенных соотношениях. Изменения в системе крови являются ответной реакцией организма рыб на изменения внешних и внутренних факторов. Таким образом, морфологический анализ крови является одним из тонких и объективных методов контроля за физиологическим состоянием организма [26]. Поэтому значение морфологических показателей крови в определении физиологического состояния организма рыб огромно, тем более, что сведения по показателям крови окуня оз. Виштынецкого и линя весьма ограничены.
Линь отличается высокими пищевыми качествами и востребован на потребительском рынке. Он является популярным объектом спортивного рыболовства. В странах Западной Европы линь ценится лишь немногим ниже форели. Он неприхотлив по отношению к комбикормам и в целом этот вид лабилен к условиям окружающей среды [43].
В отечественной научной литературе имеются ограниченные сведения по гематологической характеристике производителей линя, выращенных в различных условиях.
Окунь оз. Виштынецкое является многочисленным видом. Обладает высокими вкусовыми качествами. Однако данных, характеризующих кровь этого ценного объекта, до настоящего времени нет. Определение гематологических показателей окуня позволяет оценить не только его физиологическое состояние, но и установить экологические условия места обитания.
Целью наших исследований являлось изучение гематологических показателей производителей линя, выращенных в УЗВ и окуня оз. Виштынецкого.
Для достижения поставленной цели необходимо было решить следующие задачи:
1) определить длину, массу, индекс почки, печени и селезенки; и лейкоцитарную формулу крови двухгодовалых линей, выращенных в условиях (УЗВ);
2) определить концентрацию гемоглобина, эритроцитов, лейкоцитов, общего белка в сыворотке крови, среднее содержание гемоглобина в эритроците, отношение эритроцитов к лейкоцитам, лейкоцитарную формулу крови, цитометрические параметры эритроцитов производителей линя, выращенных в условиях (УЗВ);
3) определить показатели красной и белой крови окуня, выловленного на различных станциях оз. Виштынецкого.
1.1 Рыбоводно-биологическая характеристика объектов исследования
Линь (Tinca tinca L.). Эта относительно теплолюбивая донная рыба известна в Малой Азии, на Кавказе, в Сибири, вплоть до Енисея, и по всей Европе, за исключением Скандинавских стран и Кольского полуострова [36]. В Калининградской области населяет водоемы различных типов, от мелких озер до среднего и нижнего течения рек [67, 68].
Тело у линя короткое, слабо стиснуто с боков, толстое и высокое. Хвостовой стебель - короткий, с небольшой выемкой. Все плавники закруглены. Спинной плавник начинается немного позади вертикали заднего края основания брюшных плавников или над ними. Лучи брюшного плавника удлинены и заходят за анальное отверстие. Грудные плавники длинные. Формула плавников: D III-IV 7-9; A III-IV 6-8. Чешуя очень мягкая, плотно прилегает к телу, счищается очень плохо. Обычно тело покрыто слизью, особенно при пониженной температуре воды. Голова маленькая, рыло тупое, рот небольшой, конечный. В уголках рта - короткие усики. Глаза маленькие, лоб широкий и плоский. Глоточные зубы однорядные, кончик каждого зуба утолщен. В боковой линии 87-105 чешуй [36, 67, 68].
Окраска линя зависит от цвета воды водоема, где он обитает. Обычно сверху она темно-зеленая, на боках тела бронзовая и на брюшной стороне желтоватая. Плавники темно- коричневые или серые. Глаза ярко-красные. В заросших и сильно заиленных водоемах линь значительно темнее, чем в проточных водах и чистых озерах. Вынутый из воды линь очень быстро меняет окраску, особенно в местах прикосновения с другими рыбами. Эти места светлеют, линяют. Есть гипотеза, что отсюда и происходит его название [34, 68].
Линь – пресноводная рыба. Обитает в заливах рек и озер, заросших камышом или мягкой водной растительностью. Держится линь поодиночке у дна среди зарослей, избегает яркого света, на зиму зарывается в ил. Линь - рыба оседлая и больших миграций не совершает. Даже совершая небольшие перекочевки во время половодья, скоплений не образует. Поздней осенью скапливается на глубоких местах и залегает на зимовку. Самцы растут несколько медленнее самок, но созревают раньше. Половой диморфизм проявляется в утолщении наружных лучей брюшных плавников у самца, поэтому его легко можно отличить от самки. Линь очень устойчив к дефициту кислорода (ниже 1 мг/л) и некоторое время может жить без воды [32, 36, 67. 68,].
Длина до 60 см, масса до 7,5 кг. В естественных водоемах растет медленно (табл. 1). Созревает при длине 25 см на 3-4-м году жизни. Размножается в мае - июле при температуре 18-20°C. Нерест порционный. Промежутки между выметыванием отдельных порций – около двух недель. Общая продолжительность нереста 1,5–2 мес. Икру откладывает на растительность. Средняя плодовитость 300-400 тыс. икринок. Продолжительность инкубционного периода 3-7 дней при температуре 22—24°С [45, 67, 68].
Таблица 1 - Линейный рост линя в естественных водоемах [36]
| Возраст, лет | 1+ | 2+ | 3+ | 4+ | 5+ | 6+ | 7+ |
| Длина, см | 3-7 | 8-12 | 11-17 | 15-23 | 17-26 | 20-29 | 25-32 |
По характеру питания линь – бентофаг. Питается он ракообразными, личинками насекомых, моллюсками, другими мелкими донными беспозвоночными, реже водорослями. Молодь в первые месяцы жизни поедает зоопланктон [67, 68].
Линя можно выращивать как добавочную рыбу вместе с карпом в прудах. Мясо линя сладковатое на вкус и очень сочное, средней жирности (3,8%) [32, 36, 67 68].
Окунь (Perca fluviatilis L.). Тело окуня
довольно высокое. Голова короткая, рыло округлое. Спинные плавники
обособленные, хотя и соединены у основания перепонкой. Щеки
сплошь покрыты чешуей. Крышечная кость с одним плоским шипом, предкрышечная —
сзади зазубрена, снизу с крючковатыми шипиками. Щетинковидные зубы расположены
в несколько рядов на челюстях, сошнике, нёбных, внешнекрыловидных, на глоточных
костях; клыков нет. Брюшные плавники тесно сближены, расстояние между ними
составляет менее двух третей ширины основания. Боковая линия 57![]() . Позвонков 40-43. Формула
плавников: D1 XII-XVI, D2 I-IV 12-17; A II-III 7-11; I.I. 53-74. На
жаберной крышке несколько острых шипов. Чешуя мелкая ктеноидная [6, 51, 52, 68].
. Позвонков 40-43. Формула
плавников: D1 XII-XVI, D2 I-IV 12-17; A II-III 7-11; I.I. 53-74. На
жаберной крышке несколько острых шипов. Чешуя мелкая ктеноидная [6, 51, 52, 68].
Окунь красиво и ярко окрашен. Спина у него темно-зеленая, бока зеленовато-желтые с пятью-девятью поперечными полосами. Хвостовой, анальный, брюшные плавники ярко-красного цвета, грудные плавники желтые. В конце первого спинного плавника хорошо заметное темное пятно. Глаза оранжевые [67, 68].
Окунь населяет почти всю Европу, в том числе бассейны Балтийского, Черного, Каспийского, Азовского морей. В водоемах Калининградской области живет повсеместно [68].
Окунь является типичной озерно-речной рыбой. Он часто встречается в низовьях озер и прудах, а также в реках с медленным течением. Обитает он и в солоноватых заливах Балтийского моря. Хорошо переносит высокую кислотность воды, водится в торфяных и лесных озерах, где иногда является единственной рыбой в водоеме. Для окуня требуется, однако, сравнительно высокое содержание кислорода в воде. Окунь ведет дневной образ жизни. Молодь окуня обычно собирается в небольшие стайки среди подводных корней деревьев, вблизи мостов, пристаней, зарослей водорослей. Полосатая окраска позволяет им скрываться на таком фоне. Иногда, не в нерестовый сезон, можно увидеть большие стаи окуня на чистой воде в озерах. Крупные рыбы держатся на большой глубине. Окунь не совершает длительных миграций и даже заметных кочевок. В период нереста он образует стаи, которые затем распадаются на мелкие группы и держатся на постоянных местах. Самцы растут медленнее самок. В Куршском заливе окунь живет до 15-ти и более лет. Созревает он в возрасте двух-пяти лет. Достигает длины 40 см и массы более 1,5-2,0 кг [6, 52, 68].
Половой зрелости окуни достигают рано: самцы - в 1-2 года, самки - в 3 года и позже [51].
Нерест окуня происходит в апреле-мае на мелководьях при температуре 6-7°C и выше. В этот период наблюдаются скопления окуня, например, в Куршском заливе в районе каменистых гряд и у мыса Вентес рагас. Икра крупная, откладывается в виде длинных лент, главным образом на прошлогоднюю растительность, корни деревьев и другие предметы, на залитой пойме рек или в прибрежье озер. В озерах, где нет или мало растительности, окунь откладывает икру на камни. В этих лентах икринки соединены наподобие сети или кружева Размер икринок 2-2,5 мм, в процессе развития они увеличиваются до 3,5 мм; желток содержит большую жировую каплю. Плодовитость до 200 тыс. и более икринок. Выклев предличинок при температуре 13°C происходит через восемь дней. Выклюнувшиеся предличинки бывают длиной до 5,3 мм [6, 68].
После рассасывания желточного мешка (через 2-4 суток после выклева) личинки питаются мелким планктоном. По мере роста молоди она переходит на кормовые организмы все большего размера. По достижении 15 см окунь начинает более интенсивно питаться рыбой: мелким окунем, плотвой и другими карповыми. Особенно сильно хищничает окунь в конце лета, когда многочисленные подросшие мальки рыб являются обильной, легкодоступной пищей. Окунь более прожорлив, чем щука: на 1 кг мяса окуня тратится 4,9 кг другой рыбы, а на 1 кг щуки — 3,5 кг. В озерах, бедных кормовыми организмами, окунь растет исключительно медленно; в таких озерах обитают обычно популяции с угнетенным ростом, отличающиеся мелкими размерами [6, 38, 51, 68].
Благодаря широкому распространению и высокой численности в водоемах окунь является доступной добычей для многих рыб. Сом, щука, судак, налим охотно питаются им. Чайки, крачки и скопа так же нападают на него [51].
Окунь имеет важное промысловое значение. В Куршском заливе его общий вылов в последние годы составляет 90-115 т. Кроме того, окунь является одним из основных объектов любительского рыболовства. Однако, в озерах, водохранилищах и прудах, богатых ценными промысловыми видами (сиги, форель, лещ, карп, судак), окунь является сорной рыбой: он питается тем же кормом и поедает отложенную этими рыбами икру. В таких водоемах необходимо стремиться уменьшить численность окуня - усилить его вылов, а главное, ограничить размножение. Для этой цели в водоем выставляют искусственные нерестилища, которые затем удаляют вместе с отложенной на них икрой окуня [51, 68].
1.2 Характеристика оз. Виштынецкого
Сувалкская возвышенность - озерный край, расположенный на юго-восточной границе с Польшей и Литвой. |Подлинной жемчужиной края, несомненно, является самое большое и красивое озеро - Виштынецкое. Необычайно большая глубина (54 м) и значительная площадь зеркала (16,6 км2), а также приподнятость над уровнем моря (+172 м) определяют своеобразие и уникальность этого бассейна не только для Калининградского региона, но и для прилегающих территорий Польши и Литвы. Это своего рода "Байкал" Центральной Европы, рекреационное значение |которого будет, несомненно, возрастать [15].
Озеро Виштынецкое - самый крупный пресноводный водоем Калининградской области, объем воды которого составляет около 258 млн. км3. Озеро вытянуто с северо-северо-запада на юго-юго-восток, его длина составляет 9,1 км, наибольшая ширина - 4,2 км; длина береговой линии - 25 км. В озеро впадает 12 рек и ручьев; в частности, в южную часть озера впадают две небольшие речки - Черница и Безымянная, текущие с территории Польши; на севере из водоема вытекает одна река - Писса, которая через р. Анграпу соединяет озеро с р. Преголей [15, 68].
Виштынецкое озеро - озеро ледникового типа. Оно образовалось под действием флювиогляциальных потоков ледниковой экзарации и термокарстовых явлений во время южно-литовской фазы померанской стадии Валдайского оледенения. Возраст его почти на 10 тыс. лет старше возраста Балтийского моря и составляет около 22-25 тыс. лет. Озеро расположено в зоне конечных краевых моренных гряд. При этом зеркало поверхности озера расположено на отметке +172 м выше уровня моря. В плане чаша озера имеет клинообразную форму и простирается с северо- запада на юго-восток, имея ширину в северной части 2,6 км, и в южной оконечности 0,8 км, наиболее широкая часть озера (на широте бухты Тихая) составляет 4,2 км [15].
Рельеф дна имеет сложную форму. Через всю центральную часть озера протягивается цепочка узких глубоких троговых долин с максимальными отметками глубин от 54 до 31 м. Следует отметить, что максимальная глубина Виштынецкого озера ранее определялась в 47 м. На широте горы Лысой (203,2 м) найдена глубина 54 м, что на 7 метров глубже. На сегодняшний день эта отметка определяет наибольшую глубину Виштынецкого озера. Крутизна склонов подводных порогов в верхней части более пологая, чем в нижней, и меняется от 2-4 до 10-12 градусов и более. В южной части бухты Тихая в районе мыса Пионерский обнаружена в пределах мелководья не известная ранее впадина изометрической формы глубиной свыше 10 м [15].
Цепочка глубоких впадин, установленная в центральной части озера, разделяется подводными порогами субширотного простирания высотой до 20 м относительно дна прилегающих котловин. Эти пороги как бы изолируют впадины. По-видимому, в образовании центральной группы впадин наряду с размывом принимали участие термокарстовые процессы. Тем не менее значительная крутизна и пороговый характер большей части подводных долин свидетельствуют о ведущей роли флювиогляциальных потоков при формировании рельефа дна будущего Виштынецкого озера [15].
В пределах дна озера Виштынецкое выделяются следующие впадины: Северная (54 м), Центральная (46 м), Пионерская (45 м), Узкая (31 м) и Южная (44 м) [15].
Донные отложения Виштынецкого озера представлены широким спектром гранулометрических типов: от песков с примесью гальки, гравия, раковинного детрита до глинистых илов. На отдельных участках крутых склонов глубоких впадин рыхлые осадки практически отсутствуют. В частности, юго-восточный склон самой глубоководной впадины Северной (район горы Лысая), а также восточный, южный и западный склоны впадины Южной заняты отложениями гравия, гальки, валунами, образовавшимися за счет разрушения морены [15, 16].
Дно глубоководных впадин покрыто темными (главным образом черными) полужидкими илами (влажность – до 90%) со значительной примесью органогенного материала (в основном - остатки наземной и водной растительности). Нередко эти илы содержат незначительную примесь песчаных частиц, в связи с чем их отличает плохая сортировка. По мере продвижения от центра впадин к берегам глинистые илы сменяются мелкоалевритовыми и крупноалевритовыми илами; последние на глубинах около 10 м сменяются песками. Размещение осадков на дне нередко отличается пестротой из-за больших неровностей дна и значительной крутизны склонов. Зачастую среди мелкоалевритовых илов встречаются пятна крупноалевритового ила и песков. Сортировка
мелко- и крупноалевритовых илов и песков (среди них преобладают мелкозернистые), как правило, хорошая и средняя [15]. Грунты озера содержат от 43 до 87% кремнезема, в основном терригенного происхождения, хотя в осадках встречаются и остатки диатомовых водорослей. При этом
количество SiО2 возрастает от 43% в глинистых илах до 87% в песках. В меньшем количестве в донных отложениях обнаружены карбонаты (от 7 до 20%), имеющие терригенное и органогенное происхождение. В частности, источником кальцита в осадках могут служить раковины моллюсков (в Виштынецком озере обитает 41 вид моллюсков). Так, большое количество этих представителей фауны встречено в осадках западной части озера (бухта Тихая) на глубинах до 10 м. Источником кальцита терригенного происхождения могут служить карбонатные породы, входящие в состав моренных отложений [15].
Большой интерес вызывает высокое содержание в осадках органического углерода. Его концентрации колеблются от 0,5% в песках до 26% в мелкоалевритовых илах. Источником органики в осадках озера является главным образом растительный детрит. Как показывают многолетние наблюдения, на Виштынецком озере происходит постепенное зарастание водорослями западной, мелководной части водоема. Можно предположить, что причиной этого процесса является интенсивная эвтрофикация водоема за счет поступления соединений фосфора и азота из бухты Тихой. В северном заливе бухты в 60-е - начале 70-х гг. размещалась утиная ферма ("утятник"). Органические остатки, накопленные в больших количествах в заливе, являются, по-видимому, источником азотсодержащих и фосфорсодержащих соединений, которые не только поступают в бухту Тихая, но и обогащают воды озера, прежде всего его западной части. На возрастании массы водной растительности сказался также факт резкого сокращения биомассы рыб в водоеме, в частности растительноядных. Уменьшение численности данных представителей ихтиофауны обусловлено неконтролируемым промыслом рыбы в озере жителями как Калининградской области, так и Литвы, широким распространением браконьерства в течение последних лет [15].
Основным источником донных осадков Виштынецкого озера является несортированный грубый моренный материал с прослоями песка, заключенный в ледниковых и водно-ледниковых отложениях, широко распространенных в водосборном бассейне озера. В котловине озера видна четкая зависимость распределения донных отложений различной крупности от рельефа дна: глубокие впадины заняты тонкодисперсными осадками, у берегов распространены пески. Наибольшая площадь дна занята мелкоалевритовыми илами [15].
Только пять из двенадцати впадающих в озеро ручьев имеют сток круглый год. Суммарный расход этих ручьев - около 4 м3/с. Остальные ручьи в сухие летние месяцы пересыхают или не имеют стока зимой. В южную часть озера две небольшие речки, берущие начало в Польше. Их суммарный расход не более 1 м3/с.
Сток озера осуществляется через р.Писсу, которая соединяет оз. Виштенецкое с р. Преголей. Таким образом, оз. Виштынецкое относится к продольно-осевому типу проточности. Это значит, что почти вся его площадь, за исключением Западного залива, является активной зоной, в которой осуществляется перенос вод в генеральном направлении с юга на север. Однако скорость постоянного течения во всем водоеме, кроме приустьевого участка р. Писсы, мала - ниже порога чувствительности морской вертушки (1-2 см/с). Тем не менее многочисленные наблюдения за температурой воды и основными гидрохимическими характеристиками показывают, что это вдольосевое перемещение вод существует, но охватывает в основном верхний слой до 10-15 м. т.е. до глубины порога, разделяющего северную и южную части котловины [15].
Скорость ветра 2-5 м/с имеет наибольшую повторяемость над озером Виштынецким (от 52 до 64%) в течение всех месяцев. Повторяемость ветра со скоростью 0-1 м/с составляет 21 - 40%; 6-10 м/с - 5-17%; сильные ветры (скорость более 11 м/с) имеют повторяемость от 0 до 2%. По направлению в среднем за год в районе оз. Виштынецкого преобладает юго-западный ветер (повторяемость 25-40%). Кроме того, ветры этого направления чаще всего встречаются в июле - сентябре (повторяемость 40-60%) и в декабре (повторяемость 25-40%). В феврале - марте и в октябре - ноябре ветер направлен преимущественно с юга (от 20 до 60% случаев), в январе и апреле - в основном с юго-востока (от 25 до 50% случаев), в июне - с запада (40 - 50%), в мае - с востока (40-50%) [5, 15].
Вода в центре озера отличается довольно высокой для малых водоемов величиной условной (относительной) прозрачности - до 6-8 м. Эта величина подвержена значительным колебаниям как по площади озера, так и во времени. Наиболее низкая прозрачность - менее 1 м (в вегетационный период) в Западном заливе. В открытом озере максимальная прозрачность обычно наблюдается в северной котловине, в южной она, как правило, меньше. Цвет воды преимущественно зеленоватых-зеленовато-бурых тонов [15].
Термические процессы в озере развиваются по классической схеме, характерной для пресноводных глубоких водоемов. Зимой температура воды с глубиной уменьшается от значений близких к температуре замерзания воды у поверхности до приблизительно 4°C в придонных горизонтах, т.е. складывается обратная стратификация (расслоение). В начале весны, по мере прогрева воды, температура воды в озере в результате ветрового и конвективного перемешивания становится во всей толще одинаковой (близкой к 4°C), т.е. устанавливается весенняя гомотермия. Летом формируется слой воды с большим, до 2,5 град/м, вертикальным градиентом температуры. Слой скачка делит водную толщу на три слоя: эпилимнион (верхний, расположенный над слоем скачка), средний (металимнион) - сам слой скачка и гиполимнион (нижний, под слоем скачка). Под слоем скачка температура воды летом не бывает выше 8-9°C, опускаясь в придонных горизонтах до 6°C и менее [15,68].
Около четырех месяцев в году озеро покрыто льдом. Толщина льда в феврале может доходить до 40-45 см, в марте - до 30-35 см. Однако продолжительность ледостава и толщина льда зависят от суровости зимы и погодных условий каждого конкретного года [15].
Воды озера - маломинерализованные гидрокарбонатно-кальциевые, второго типа (т.е. содержание гидрокарбонат-ионов меньше суммы содержания ионов кальция и магния), олиготрофные с некоторыми чертами мезотрофности. На распределение всех основных гидрологических показателей большое влияние оказывают циркуляция вод, стратификация, сгонно-нагонные процессы [15].
Биомасса зоопланктона и зообентоса соответствует степени трофности водоемов. Так, в олиготрофном Виштынецком озере этот показатель имеет наименьшее значение. В мезотрофных озерах Мариново и Островное биомасса возрастает. Еще выше она в эвтрофных озерах Камышовом и Боровиково (за исключением биомассы зоопланктона в Боровиково, что связано со спецификой его гидрологических условий) [15].
Изменение числа видов гидробионтов в целом тоже отражает закономерности хода сукцессионных изменений в озерах различного трофического статуса. В оз. Виштынецком наблюдается наибольшее разнообразие видов, включающее реликты ледниковых водоемов, представителей бореально-предгорного и бореально-равнинного комплексов. В Мариново и Островном, в Камышовом и др. озерах число видов сокращается; исключение составляет оз. Боровиково, где обнаружено наибольшее число видов хирономид. В этих водоемах обитают типичные представители бореально-равнинного комплекса [15].
1.4 Основные функции крови в организме рыб
Кровь - это жидкая подвижная ткань, циркулирующая в кровеносных сосудах и важнейшая часть внутренней среды организма, выполняющая многообразные физиологические функции:
- питательную (трофическую) - при движении крови происходит перенос питательных веществ от органов пищеварения к тканям;
- дыхательную - с кровью переносятся газы - кислород к тканям и углекислота к органам дыхания;
- выделительную - кровь выносит из тканей и переносит к органам выделения конечные продукты обмена веществ при этом химический состав крови в значительной мере отражает обмен веществ;
- регуляторную - с помощью крови от желез внутренней секреции к органам и, тканям доставляются гормоны и другие биологически активные вещества, осуществляющие гуморальное взаимодействие между органами и тканями;
- защитную - в кров содержатся различные противомикробные и антитоксические вещества (лизоцим, пропердин, комплемент, интерферон). В ответ на поступление в организм возбудителей различных заболеваний в крови образуются антитела [50, 61].
1.5 Органы, участвующие в процессе кроветворения
![]()
![]()
![]() Исследование органов,
участвующих в гемопоэзе рыб, позволило установить качественный состав и структурные особенности клеток крови
на всех этапах развития. Кроветворение как процесс гистогенеза является
ответной реакцией ряда тканевых систем организма рыбы на изменение как внешних,
так и внутренних факторов [26, 39].
Исследование органов,
участвующих в гемопоэзе рыб, позволило установить качественный состав и структурные особенности клеток крови
на всех этапах развития. Кроветворение как процесс гистогенеза является
ответной реакцией ряда тканевых систем организма рыбы на изменение как внешних,
так и внутренних факторов [26, 39].
Кроветворение у рыб специфично не только по интенсивности, но и по локализации процесса. У рыб отсутствует красный костный мозг - основной орган кроветворения высших позвоночных. У рыб функцию гемопоэза выполняют другие органы. К ним относятся: жабры, кишечник, сердце. Но наиболее активно кроветворение происходит в лимфоидных органах, почках и селезенке [26, 48].
Важное место в процессе образования белой крови отводится тимусу и лимфоидному органу. Тимус имеет различное расположение и морфологию у разных видов рыб. В отличие от млекопитающих тимус у рыб функционирует всю жизнь. Он имеет корковый и мозговой слой. Мозговой слой отвечает за образование Т-лимфоцитов.
Лимфоидный орган представляет собой скопление лимфоидной ткани и находится у осетровых рыб под крышей черепа. На гистологических срезах лимфоидного органа всегда присутствуют нейтрофилы, эозинофилы, базофилы, тромбоциты и даже незрелые эритроциты, т.е. лимфоидный орган причастен к процессу формирования всех клеток крови [14, 39].
Из литературных данных как советских, так и зарубежных гематологов следует, что в кроветворении рыб особое место занимают почки. Почки у рыб выполняют не только выделительную, как у других позвоночных, но и кроветворную функцию. У большинства рыб повышенная кроветворная активность зафиксирована в каудальной и головной частях почки [26, 62].
У костистых, как, впрочем, и у хрящевых, в результате развития стенки подкишечной вены образуется селезенка. На первых этапах развития происходит активное деление клеток. Затем через ряд постепенных переходов в сформировавшемся синцитии образуются первые клетки крови [26].
По исследованиям А.П. Скворцова селезенка приспособлена не только к функции кроветворения, но и разрушения, и фагоцитоза. По мнению автора, последнее, наиболее ярко выражены [26].
И.И. Шмальгаузен, А.А. Заварзин, А.А. Заварзин и С.С. Щелкунов [цит. по 26] утверждают, что селезенка рыб и амфибий служит органом гемопоэза, в ней вырабатываются эритроциты и она скорее напоминает костный мозг, чем селезенку позвоночных. А.А. Максимов, А.А. Заварзин и многие другие считают селезенку основным органом эритротромбопоэза, что не вполне согласуется с мнением Н.Т. Ивановой, которая считает, что в селезенке осуществляется и лимфогранулопоэз [26].
Так, установлено, что жаберный аппарат у современных сетровых и костистых рыб, являясь пограничным органом, наряду с дыхательной и другими функциями участвует и в кроветворении. Гемопоэз в этом органе осуществляется за счет не только эндотелия сосудов, но и малодифференцированных, свободно лежащих клеток ретикулярного синцития. Последний сосредоточен в области жаберных дужек у основания жаберных лепестков [7, 26, 39].
Рассматривая жаберный аппарат как орган, участвующий в кроветворении, следует подчеркнуть, что из эпителия спинной части жаберных мешков развивается еще один орган эндокринной системы рыб - вилочковая железа (зобная). Она состоит из соединительнотканной стромы и лимфоцитов, заключенных в эпителиальную капсулу. Сверху железа покрыта плотной соединительной тканью. У различных представителей класса костистых рыб он функционирует всю жизнь. Во время метаморфоза тимус сильно увеличивается за счет разрастания соединительнотканной стромы и лимфоцитов [26].
До последнего времени функция этого органа не была достаточно изучена даже у высших позвоночных и человека. Особи с сильно развитой зобной железой всегда считались наиболее крепкими, обладали хорошим ростом [26].
Во время метаморфоза железа сильно увеличивается, в нее врастают соединительная ткань, кровеносные сосуды, и она разделяется на две лопасти. К концу метаморфоза в ней можно различать корковый и мозговой слои. Лимфоциты сосредоточены в основном в мозговом слое. Позднее железа делится на части и обрастает жировой тканью [26].
Исходным материалом в формировании остальных отделов пищеварительной трубки так же, как и ее глоточного аппарата, в области которого находятся жабры, служит энтодермальная пластинка. Сложность гистологической структуры исследуемых отделов пищеварительного тракта обусловлена не только пищеварительной, но и гемопоэтической функцией [26].
Внутренняя пограничная зона системы органов выстлана слизистой оболочкой. В состав этого слоя входят элементы рыхлой и ретикулярной тканей. В этом слое находятся подэпителиальные лимфоидные скопления в виде фолликулярных образований. Лимфатические фолликулы представляют собой очаговые образования кроветворной ткани, способной к постоянному продуцированию форменных элементов крови. В слизистой кишечника рыб подэпителиальные лимфатические участки, несомненно, являются своего рода резервуарами, за счет которых происходит постоянное пополнение форменных элементов белой крови, преимущественно агранулоцитов, в том числе лимфоцитов, которые в основном расходуются при выполнении как защитной, так и ферментативной функций. Говоря о защитной роли рассматриваемых органов, следует особо подчеркнуть, что у рыб всякий пограничный орган безотносительно к специальной функции, если судить по составу форменных элементов крови, несет и функцию защиты [26].
Центральный орган кровообращения костистых рыб - сердце - развивается из промежуточной массы, отделившейся от спинного сомита. Из нее в первую очередь формируются сердце и кровеносные сосуды, по которым первоначально течет бесцветная кровь, лишенная клеток. Только через некоторое время появляются форменные элементы крови. Источники развития форменных элементов крови и взаимоотношение клеток крови пока изучены слабо. Лишь общность происхождения всех форменных элементов крови из единого источника является общепризнанной [8, 26].
Основную массу сердца составляет миокардий. Этот мышечный слой слагается из продольных и радиально разветвленных мышечных поперечнополосатых пучков. Внутренние полости желудочков и предсердий выстланы эндокардием, в состав которого входят тончайшие эластичные волокна и клетки однослойного плоского эпителия, составляющие основную массу внутренней выстилки сердца [26].
Эпителиальный слой сердца и эндотелий сосудов служат источником образования клеток крови в этой системе органов. Поверхностный слой - эпикардий - состоит из соединительнотканных эластических волокон и клеток плоского эпителия. У осетровых на вентральной стороне сердца расположен перикардиальный орган, представляющий собой плоское лопастное образование, усеянное бугорками – фолликулярными узелками, содержащими форменные элементы крови. В момент исследования эти лимфатические очажки гемопоэза плотно были заполнены лимфоцитами [26].
Клеточный состав мазков крови сердца представлен преимущественно лимфоцитами, однако встречаются и другие категории клеток. Судя по качественному составу форменных элементов крови, сердце параллельно с основной работой выполняет и гемопоэтическую функцию [26].
Наиболее активный гемопоэз у канального сома, карпа, верховки, плотвы, окуня, язя и линя происходит в периферической части почек. Другие авторы указывают на активностъ гемопоэза в переднем отделе почек. По данным Ивановой Н.Т. [26], в кроветворении участвует и каудальная часть почки.
Рассматривая гемопоэз следует отметить, что о нем нет единого мнения. Так, одни исследователи считают, что помимо второстепенных основными органами кроветворения у рыб являются почки. Другие отдают предпочтение селезенке. И.Н. Остроумова (1957) составила довольно наглядную сводку о гемопоэзе у рыб по материалам различных авторов. Из приведенных данных следует, что одни авторы местами образования форменных элементов крови считают почки, другие - селезенку, третьи - почки и селезенку. При этом надо отметить, что ни один из авторов кроме почек и селезенки, не отмечают у рыб наличия других органов гемопоэза или структур в виде оформленных скоплений кроветворной ткани типа лимфоидного органа, тимуса, псевдобранхии и др. [26].
При таком распределении очагов гемопоэза у рыб, по-видимому, достигается необходимое для жизни соответствие между уровнем деятельности очагов гемопоэза и удовлетворением потребностей организма, прежде всего в кислороде. В связи с этим становится понятной и гемопоэтическая функция селезенки, кишечника, жабр и головного отдела в целом [26].
Все клетки крови имеют единое происхождение от гемоцитобласта. Созревание отдельных форм лейкоцитов протекает в лимфоидной ткани пищеварительной трубки, лимфоидном органе, тимусе. Созревание тромбоцитов, скорее всего, происходит в селезенке [12].
Интенсивность гемопоэза зависит от внешних и внутренних факторов. Так, при дефиците кислорода наблюдается усиление эритропоэза; пониженная температура воды и ее загрязненность органическими веществами стимулируют лейкопоэз за счет фагоцитирующих форм. Инфицирование рыбы, кроме фагоцитоза, усиливает и морфогенез лимфоцитов [25, 39].
Содержание форменных элементов крови в органах, исследованных на гемопоэз, в сосудистой крови и распределение по классам свидетельствуют о том, что наряду с основными функциями в них осуществляется нормальный процесс гемопоэза за счет кроветворной ткани, входящей в состав гистоструктуры этих органов. Основная масса клеток приходится на долю зрелых элементов, приспособленных к выполнению специфических функций. У рыб преобладающей формой клеточных элементов всегда являются лимфоциты, нередко составляющие 90% и более. В период активного питания резко возрастает количество гранулоцитов [25, 39].
1.6. Состав, общие свойства крови и причины изменения ее состава
Кровь - непрозрачная маслянистой консистенции на ощупь жидкость ярко-красного цвета, состоящая из двух частей: плазмы и форменных элементов. Как и у других животных, кровь рыб делится на циркулирующую и депонирующую. Роль депо крови у них выполняют почки, печень, селезенка, жабры и мышцы. Распределение крови по отдельным органам неодинаково. Доля крови в процентах от всего объема крови в организме рыб высока в почках и сосудах (до 60 %), белых мышцах (16 %), жабрах (8 %), красных мышцах (6 %). Депонированная кровь почти не смешивается с циркулирующей [3, 10, 39].
При необходимости увеличение количества циркулирующей крови происходит за счет, выбрасываемой крови из депо. Значение депонирования крови заключается в том, что при уменьшении количества циркулирующей крови благодаря ее застаиванию в депо падает нагрузка на сердце во время покоя организма. А при кровопотерях, удушье, вдыхании углекислого газа, стрессе - в случаях необходимости в экстренном увеличении количества циркулирующей крови, рефлекторно происходит ее выбрасывание из депо в кровяное русло [13].
Необходимо учесть, что депонированная кровь, в силу механических причин и всасывания воды из плазмы в ткани, содержит больше форменных элементов, чем циркулирующая кровь. Поэтому поступление депонированной крови в общее кровяное русло вызывает не только абсолютное, но и относительное возрастание в крови количества эритроцитов и гемоглобина [13].
Морфологический и химический состав крови изменяется при раздражении хеморецепторов кровеносных сосудов продуктами обмена веществ. Рефлекторные изменения состава крови происходят и при раздражении интерорецепторов пищеварительного канала (пищеварительный лейкоцитоз) [11, 13].
При удлинении светового дня увеличивается общее количество белков в плазме, при этом одновременно увеличивается количество альбуминов и снижается количество глобулинов. Состав крови изменяется также нервно-гумморальным путем, например, при поступлении гомона адреналина и др. [13].
Даже внутри одного вида возможны многократные изменения количественного состава крови, которые могут быть вызваны факторами внешней среды и физиологическим состоянием рыбы [3].
Существенное влияние на характеристику красной крови оказывает зимовка рыб. Общее количество гемоглобина за зиму может снизиться на 20 %. Однако, в весенний период эритропоэз настолько активизируется, что показатели красной крови восстанавливаются до осеннего уровня за 10-15 дней нагула. В это время в крови рыб можно наблюдать повышенное содержание незрелых форм всех клеток [3].
Увеличение количества незрелых форм эритроцитов связано с сезонным усилением обмена веществ, кровопотерями, а также с возрастными и половыми особенностями рыб. Так у производителей наблюдается 2-3-кратное увеличение незрелых эритроцитов по мере созревания гонад, достигающее 15 % у самцов перед нерестом [3].
На протяжении жизненного цикла лейкоцитарная формула меняется под влиянием фактов внешней среды. Во время нереста снижается количество лимфоцитов в пользу моноцитов и полиморфноядерных клеток [3].
Ухудшение условий содержания рыбы (гипоксия, бактериальная и химическая загрязненность водоема, голодание) проводит к увеличению фагоцитирующих форм. Таким образом, за физиологическую норму следует принимать показатели рыб, выращенных в хороших условиях [3].
1.7 Форменные элементы крови и их значение
Кровь - это жидкая ткань, поэтому ее клетки не соединены друг с другом. Среди клеток крови рыб различают три основных типа - эритроциты, лейкоциты и тромбоциты [39].
Эритроциты. Эритроциты взрослых рыб имеют эллиптическую форму, а у молоди она округлая. В центре эритроцита имеется ядро, имеющее овальную форму. Благодаря наличию ядер эритроциты рыб обладают более высоким уровнем собственного обмена, время их жизни в норме весьма длительно - может превышать год. Размеры эритроцитов рыб в основном больше, чем у высших позвоночных. У хрящевых рыб эритроциты крупнее, чем у костистых. При нормальных условиях эритроциты находятся в кровообращении около 120 дней. Оболочка эритроцитов по структуре не отличается от оболочек других клеток и является трехслойной. Наружный слой состоит из белка гликофорина, который пропускает вещества из плазмы крови внутрь клетки. На внутренней стороне оболочки находится спектрин — другой значимый белок. Его основная роль заключается в сохранении формы эритроцита и способности менять ее на 3-4 мкм при прохождении через капилляры, с последующим восстановлением исходного очертания. Структура спектрина близка к структурам актомиозина, обуславливающего сокращение мышц, и тромбостенилина, ответственного за ретракцию создаваемого тромбоцитом сгустка. К спектрину присоединяется и молекула АТФ, которая расходуется в большом количестве при работе натриевого насоса, потребляющего более 50% вырабатываемой в эритроците энергии. Внутри этой тончайшей, в две молекулы, трехслойной оболочки находятся гранулы гемоглобина [21, 26].
Первая основная функция эритроцитов заключается в поглощении кислорода в жабрах и перенос его в капилляры тканей и в поглощении углекислоты в капиллярах тканей и доставка ее в жабры. Эта функция выполняется гемоглобином. Проникновение газов из эритроцитов в ткани и из тканей в эритроциты обеспечивается тем, что эритроциты в следствии малого диаметра капилляров проталкиваются через них поодиночке и тем, что в капиллярах ток крови резко замедлен. На первой фазе они несут неполную нагрузку гемоглобина; созревание завершается за один-три дня, в течение которых клетки безотказно выполняют функцию переноса кислорода. Во второй фазе зрелый эритроцит переносит кислород в одном направлении, а углекислый газ - в обратном, полностью выполняя свою функцию. На третьей фазе, при снижении эффективности их функции, они подбираются макрофагами, открывая путь молодым клеткам, вступающим в функциональный цикл [13, 21].
Вторая очень важная функция эритроцитов заключается в том, что они играют главнейшую роль в сохранении активной реакции крови. Эта функция также выполняется гемоглобином
Третья функция эритроцитов - поддержание ионного состава крови.
Четвертая функция эритроцитов - их участие в водном и солевом обмене.
Кроме того, эритроциты способны адсорбировать токсины, гормоны и продукты расщепления белков и, вследствие содержания в них ферментов участвовать в ферментативных процессах расщепления белков, жиров и углеводов [13].
Лейкоциты. Лейкоциты - это белые кровяные тельца. Количество лейкоцитов у рыб колеблется от десятков до сотен тысяч в 1 мкл. Количество их колеблется в больших пределах и зависимости от возраста, пола, стадии половой зрелости, упитанности, заболеваний, сезона года, температуры среды. Количество лейкоцитов может резко меняться в пределах одного вида, даже у одной рыбы в разные периоды жизни [3].
Лейкоциты делятся на гранулоциты, содержащие в цитоплазме особую специфическую зернистость - нейтрофилы, эозинофилы, базофил, и агранулоциты, цитоплазма которых не содержит зернистости, гомогенная - моноциты, лимфоциты [39].
Преобладающими клетками белой крови рыб являются лимфоциты, которые составляют до 95 % всех лейкоцитов. Большее количество лейкоцитов в сосудистой крови рыб, а также довольно быстрые смены состава их свидетельствуют о большей защищенности водных организмов, в сравнении с наземными позвоночными животными, от различных патогенных микроорганизмов, которых на единицу объема воды приходится значительно больше, чем на ту же единицу объема воздуха [3, 21].
Лейкоциты живут от 2-4 до 12-15 дней. Их главная функция - защита (фагоцитарная) организма от заразных микробов и отравлений [13].
Нейтрофил. Диаметр этих клеток у рыб от 5,5 до 7,5; у высших позвоночных 9,5-14,3 мкм. Цитоплазма слабо базофильная, содержит мелкие гранулы, которые красятся (по Паппенгейму) в серо-голубой цвет, довольно часто образует выступы [21].
Ядро в виде вытянутого в большей или меньшей степени валика зависит от возраста клетки. Валик иногда S - образно изогнут или разделен на три и более сегмента, соединенные тонкими перемычками. Созревание нейтрофила сопровождается постепенным уплотнением ядра, при этом хроматин укрупняется и концентрируется у оболочки. Наконец, образуются сегменты, хорошо проявляется специфическая нейтрофильная зернистость [21].
Нейтрофилы могут содержать в своей цитоплазме различные включения в виде зернышек гликогена, мельчайших жировых капелек и др. Это показывает, что нейтрофилы имеют определенное отношение к внутреннему обмену (то же можно сказать и про другие виды зернистых лейкоцитов) [21].
Функциональная активность циркулирующих нейтрофилов постоянно меняется. Обладая максимально выраженной двигательной активностью, они периодически выходят за пределы кровотока, куда больше не возвращаются и переходят в ткань. Здесь они фагоцитируют микробов, переваривают их, а также продукты распада клеток. Основной функцией нейтрофилов является, таким образом, защита организма от инфекции и одновременно - от токсических воздействий. Нейтрофилы вырабатывают ферменты бактерицидного действия. В то же время они не способны вырабатывать антитела, но, адсорбируя их на своей оболочке, доставляют к очагам инфекции. Функция этих гранулоцитов не ограничивается фагоцитозом и переносом антител. В процессе жизнедеятельности нейтрофилы выделяют ряд веществ, обладающих широким спектром действия. Одни вещества повышают бактерицидную активность клеток, улучшают регенерацию тканей, усиливают двигательную активность. Зрелые сегментоядерные нейтрофилы являются специализированными клетками. Они служат катализаторами многих энзиматических реакций. Характерно, что нейтрофил все функции начинает выполнять относительно зрелым, на стадии палочкоядерной формы. А завершается формирование всех внутриклеточных структур, обеспечивающих жизнедеятельность клетки, лишь на этапе зрелого сегментоядерного нейтрофила. На его оболочке увеличивается количество активных групп, несущих отрицательный заряд. На поверхности клетки формируется рецепторная система, обеспечивающая хемотаксис [21].
Сегментоядерные нейтрофилы - клетки, форма ядер которых разнообразна из-за того, что число сегментов неодинаково в разных клетках. Отдельные сегменты соединяются тонкой перемычкой или лежат особо.
Юные нейтрофилы почти не отвечают на хемотаксические стимулы, они с трудом меняют свою форму, но обладают способностью к пролиферации. Как установлено, в кроветворных органах многочисленные депонированные зрелые нейтрофилы, несмотря на почти полную морфологическую завершенность, своего функционального качества не достигают. Видимо, их «дозревание» происходит при выходе в циркулирующий ток крови, где концентрируются наиболее зрелые формы. Все это указывает на то, что в крови продолжается дифференцировка нейтрофилов и что они постепенно стареют. Самыми старыми являются клетки с наиболее дольчатыми ядрами [21].
Нейтрофилы, как и другие гранулоциты, - это специализированные клетки, утратившие способность к делению.
При патологических состояниях организма нейтрофилы выделяют в кровь вещества, обладающие бактерицидными и антитоксическими свойствами, могут оказывать стимулирующее действие на процессы регенерации в различных органах и тканях, осуществляют фагоцитоз иммунных комплексов антиген-антитело [21].
Нейтрофилы, являясь наиболее реактивными клетками крови, высокочувствительны к разнообразным изменениям внутренней среды, которые сопутствуют нарушениям гомеостаза во многих системах организма.
Все перечисленные формы гранулоцитов развиваются у рыб еще в эмбриональный период. На стадии появления у зародыша пигментации в глазах идет активный процесс пролиферации этих клеток, что подтверждается частым присутствием на мазках различных ядерных фигур митоза. К выклеву их количество значительно возрастает. Они отличаются не только морфологически, но и функционально.
Эозинофил. Эозинофилы - специализированные формы, в основном, правильно округлые клетки разного размера. У осетровых диаметр наиболее крупных клеток колеблется от 10 до 13, более мелких – от 7,5 до 9 мкм [21].
У многих видов костистых рыб диаметр эозинофила от 8 до 10 мкм, хотя у карпа он меньше - от 5,5 до 6,5 мкм. У высших позвоночных размер эозинофилов значительно больше - от 9,0 до 22,0 мкм [21].
Цитоплазма их слабо базофильная, с голубоватым оттенком. Компактное ядро расположено эксцентрично. У рыб оно иногда двухсегментное или многолопастное, напоминающее лист клена. Ядра эозинофилов отличаются разнообразием, отражающим возрастное состояние клеток. Усложнение формы ядра указывает на «взросление» клетки, далее - старость или болезнь [21].
Крупная зернистость эозинофилов обладает ярко выраженной ацидофилией. Среди рыб гранулы этих клеток имеют наибольшую величину у осетровых и окрашены у них в ярко-оранжевый или желтый цвет. У костистых рыб гранулы окрашиваются азур-эозином в красновато-розовый цвет. В процессе поэза, благодаря появлению в цитоплазме специфической зернистости, первой морфологически различимой клеткой является промиелоцит. Однако эозинофилопоэз имеет предшественниц, которые, видимо, проходят стадии более ранних бластных форм -миелобпастов. До сих пор нет полной ясности, на каком уровне клетка приобретает способность дифференцироваться в эозинофильном направлении [21].
По основным функциям гранулы эозинофилов могут рассматриваться как лизосомы. Активность ферментов по мере созревания эозинофилов возрастает: увеличивается количество энзимов, пероксидазы, гликогена, липидов и других внутриклеточных веществ. Сама клетка приобретает способность к амебоидному перемещению и фагоцитозу (эозинофильные промиелоциты не фагоцитируют), объектом которого являются не только бактерии, но и иммунные комплексы и продукты распада тканей. Фагоцитоз не является основной функцией эозинофила. Предполагают, что эти гранулоциты могут адсорбировать многие токсические продукты белковой природы и разрушать их. Они не обладают способностью синтезировать антитела, но адсорбируют антигены и переносят их в кроветворные органы. В какой-то мере эозинофилы имеют отношение и к процессу свертывания крови, синтезируя профибринолизин [21].
У рыб, по мере созревания особей, количество эозинофилов в крови увеличивается. Но основные функциональные свойства этих клеток реализуются, как и для большинства лейкоцитов, не только в токе крови, но и вне его - в периферических тканях. При этом хемотаксис гранулоцитов вызывается соединениями, выделяемыми лимфоцитами [21].
Количество эозинофилов - клеток экстремального реагирования - в течение суток меняется и резко реагирует на изменение абиотических факторов среды. Так, отклонения температурного и солевого режимов воды от оптимальных условий приводят у рыб к увеличению количества этих клеток. Наращивается их содержание и при поражении рыбы взрывной волной.
Доля эозинофилов среди клеток белой крови возрастает под влиянием тяжелых металлов. В процессе проявления аллергии - базовой защитной реакции - на первых ее стадиях идет наращивание этих гранулоцитов. В то же время, при хронических стрессах и тяжелых случаях токсикозов у рыб наблюдается эозинофилопения [21, 27].
Базофилы. Также являются специализированными, не способными к размножению формами. Этот вид клеток - реже всего встречающаяся популяция гранулоцитов в периферической крови и кроветворных органах, что чрезвычайно затрудняет их исследование. Принадлежность к базофилам выявляется по наличию специфических для них гранул, обладающих свойством метахроматической окраски. Зернистость характеризуется неравномерностью по величине и распределению в цитоплазме [21, 27].
Клетка базофила округлая. Ядро у рыб округлое, расположено эксцентрично, но у различных животных форма ядра иная. Из-за многочисленности гранул, которые заполняют цитоплазму, ядро плохо просматривается. Гранулы имеют вид крупных базофильных зерен, азур-эозином окрашиваются в темно-синий с красным оттенком цвет. За счет их некоторого выхода из клетки ее контуры кажутся несколько «растрепанными» [21].
Базофилы, как и эозинофилы, имеют некоторый суточный ритм: наибольшая их концентрация в крови отмечается ночью, наименьшая - утром. Полупериод нахождения этих клеток в крови составляет менее пяти часов. Вообще же, длительность жизни базофилов в периферическом русле не определена, как, впрочем, и дальнейшая их судьба [21].
Базофилы отличаются крайне медленной подвижностью и способностью к фагоцитозу (это свойство не является для них ведущим). Они захватывают частицы разрушенных эритроцитов, образуя при этом фагосому. Сенсибилизированные базофилы в фагосому выделяют содержимое гранул. Базофилы могут влиять на процесс свертывания крови, активизируют его за счет содержащихся в них веществ или вызывают гипокоагуляцию крови. При дегрануляции базофилов освобождаются факторы агглютинации тромбоцитов.
За счет гепарина, содержащегося в этих гранулоцитах, базофилы могут оказывать противоположный эффект на свертывающую систему. Эти клетки исследуются при изучении жирового обмена [21].
У рыб те или иные изменения химического состава воды приводят к грануляции зерен в базофилах. Так, у карпа при недостаточном поступлении кальция из внешней среды и длительном воздействии неблагоприятного фактора обнаружены клетки с дисфункцией базофильных гранул, что свидетельствует об участии базофилов в фагоцитозе [21].
Моноциты. Это клетки белой крови, которым посвящена обширная и довольно противоречивая литература. Взгляды на их происхождение, жизненный цикл, взаимосвязь и взаимоотношения с другими клетками многократно менялись. Название было предложено Паппенгеймом и Феррадо [21].
Моноциты - незернистые лейкоциты - обнаружены у всех исследованных рыб. Этот один из самых крупных элементов периферической крови (15-20 мкм) морфологически хорошо отделяется от других клеточных структур. Цитоплазма, лишенная гранул, слабобазофильная. По Паппенгейму она окрашивается в серо-голубой, серосине-лиловый цвет светлых оттенков. Ядро большое, бобовидной формы или овальное, расположенное эксцентрически. У незрелых форм клетка округлая, ядро стойкой нежной структурой хроматиновой «сети». Зрелые моноциты могут иметь неправильную форму. Чем клетка старше, тем грубее структура ядра. Цитоплазма старых клеток имеет вакуоли, которые придают ей вид лены (пенистая). Моноциты - активные фагоциты крови - поглощают не столько бактерии, сколько продукты распада клеток и тканей. Увеличение количества этих клеток в крови свидетельствует о повышении защитных сил организма. Во внеклеточную среду они постоянно секретируют лизоцим, накапливающийся в них по мере созревания моноцита. Лизосомам приписывается решающая роль в осуществлении внутриклеточной гибели инфекционных агентов и их переваривании [21].
Вырабатывая антитела, моноциты принимают участие не только в регуляции иммуногенеза, но и в регуляции гранулопоэза.
Существует также мнение о способности моноцитов инактивировать токсины. Они содержат специальные ферменты для дезинтоксикации некоторых веществ.
Моноциты, мигрирующие в ткани, дают начало макрофагам соединительной ткани (гистиоцитам), ряду органоспецифических макрофагов - клеткам Купфера печени, альвеолярным макрофагам легкого, макрофагам костного мозга, селезенки, тимуса, лимфатических узлов, полостей тела, центральной нервной системы (микроглии), остеокластам. При определенных условиях (в очагах воспаления) моноциты также могут трансформироваться в макрофаги [21].
Для рыб цитохимическим путем установлено, что макрофаги являются производными моноцитов. Попадая из кроветворного органа в кровь, часть моноцитов сохраняет способность к пролиферации. В результате происходит дифференцировка моноцитов в сторону макрофага [21].
Однако предполагают, что и специализированных макрофагов в тканях, способных к делению, недостаточно для поддержания их популяции. Осуществляется это путем постоянного притока моноцитов из крови и их преобразования в макрофаги.
Низкий процент моноцитов в лейкограмме не всегда является признаком благополучия. Они могут концентрироваться в очагах воспаления, трансформируясь здесь в макрофаги, что часто наблюдается при длительном воздействии неблагоприятных факторов среды [21].
Лимфоциты. Это сравнительно небольшие клетки округлой и несколько неправильной формы - у рыб от 5 до 12 мкм большую часть которых занимает ядро.
У молодых форм тонкая хроматиновая структура его окрашена в бледный фиолетово-розовый цвет; цитоплазма синяя, перинуклеарная зона хорошо выражена. У зрелых клеток ядро округлое, иногда наблюдается небольшая инвагинация, хроматин уплотнен, но не однороден, имеет глыбчатую структуру. В цитоплазме часто отмечаются выступы и впячивания. Нередко она образует узкий ободок вокруг ядра, который иногда вообще как бы отсутствует. У низших позвоночных такая клетка получила название голоядерной. Это состояние характерно для малых лимфоцитов. Кроме них, встречаются еще большие и средние лимфоциты, а также бластные клетки, которые формируются в результате трансформации малых. (Согласно унитарной теории, созданной крупным русским ученым А.А. Максимовым, малому лимфоциту вообще придается значение родоначальной клетки, которая является единственной для всех ростков крови). Исключено обратное превращение бластной клетки в малый лимфоцит [21].
У средних и больших лимфоцитов ободок цитоплазмы несколько шире, чем у малых, а в ядре хроматин менее плотный, с более выраженными ядрышками, хорошо заметна перинуклеарная зона. Лимфобласт характеризуется четкой базофилией. Цитоплазма более обильная, структура ядерного хроматина рыхлая.
У рыб малые лимфоциты - единственный тип белых клеток, регулярно и в большом количестве встречающихся в крови. Именно они придают крови лимфоидный характер. Эта многочисленная группа неоднородна морфологически и функционально. Бывают случаи, когда в узком ободке их цитоплазмы, лишенной, как правило, зернистости, просматриваются азурофильные гранулы, которые принимаются за липолитические ферменты [21].
При патологических случаях встречаются лимфоциты двух- и трех ядерные. Отмечается их сферуляция - процесс, носящий обратимый характер
Особое внимание уделяется изучению функциональной активности лимфоцитов. Это связано стой существенной ролью, которая принадлежит этим клеткам в реализации иммунологических реакций организма. Специализированные лимфоциты (Т- и В-лимфоциты, различающиеся по месту своего «рождения»), выполняющие эту функцию, морфологически неразличимы. В крови циркулируют лимфоциты, находящиеся во всех стадиях дифференцировки и происходящие от различных лимфоцитопроизводящих органов. Однако деятельность их всех без исключения направлена на «патрулирование» организма посредством иммунологического надзора.
Интересно, что потомки лимфоцитов обладают свойством иммунной памяти. Хотя в реакциях клеточного иммунитета участвуюв основном лимфоциты, такую же роль играют макрофаги (моноциты) и не исключено участие гранулоцитов [21].
Постоянно мигрируют между кровью и лимфой малые лимфоциты -иммунологически зрелые, длительно живущие клетки. Неоднородность малых лимфоцитов проявляется в том, что некоторые из них являются начальными клетками с активными потенциями, в то время как другие, морфологически сходные с первыми, наоборот, не способны эволюционировать и реагировать на различные стимулы, исходящие из «микроокружения» [21].
В крови значительная часть лимфоцитов относится к долгоживущим клеткам - продолжительность их жизни от нескольких месяцев до пяти лет. К короткоживущим относятся клетки с продолжительностью жизни от нескольких часов до пяти дней [21].
Тромбоциты. У рыб эти клетки отличаются большим непостоянством форм, размеров и количества. Они могут располагаться одиночно и скоплениями. Форма этих клеток может быть как минимум четырех видов - шиловидная, веретенообразная, овальная и округлая [3, 13].
Ядра у них темно-фиолетовые, иногда почти черные, круглые, слегка удлиненные, окружены заметным слоем грязно-розовой или серо-фиолетовой цитоплазмы. У тромбоцитов ядра очень уплотнены, и в зрелых клетках почти не просматривается их структура. Иногда они бывают двудольными или вообще бесформенными. Последние, как правило, являются дегенеративными формами; нередки случаи выпячивания ядра [21].
Размер тромбоцитов чаще всего близок к размеру ядра эритроцитов того же вида рыбы, но не исключено, что они бывают и крупнее. Средняя величина тромбоцитов 0,5-0,75 мкм определяется, как правило, образом жизни рыб (у малоактивных видов они несколько крупнее) [21].
У рыб значительная часть тромбоцитов депонируется в селезенке [21].
Среди исследователей крови существует единая точка зрения относительно функциональной значимости тромбоцитов. Эти клетки участвуют в процессе свертывания крови рыбы.
У рыб время свертывания - довольно не стабильный показатель, который зависит не только от способа взятия крови, но и факторов внешней среды, физиологического состояния рыбы.
Стресс-факторы повышают скорость свертывания крови у рыб, что свидетельствует о значительном влиянии центральной нервной системы на этот процесс.
В литературе описаны и межвидовые различия свертывания крови у рыб. Однако к этим данным стоит относиться с определенным скептицизмом, помня о том, что отловленная рыба - это рыба, подвергнутая резкому стрессу. Поэтому межвидовые различия, описанные в специальной литературе, вполне могут оказаться результатом различной устойчивости рыб к стрессам.
Таким образом, организм рыб надежно защищен от больших кровопотерь. Зависимость времени свертывания крови рыб от состояния нервной системы является дополнительным защитным фактором, поскольку крупные кровопотери возможны, скорее всего, в стрессовых ситуациях (нападение хищника, драки) [3, 13].
Объектами исследования были линь (Tinca tinca L.) и окунь (Perca fluviatilis L.), а также их кровь, взятая у живых рыб. Сбор материала для определения гематологических показателей рыб проводился в 2007 - 2008 гг. в аквариальной кафедры «Аквакультуры» ФГОУ ВПО «КГТУ» и на оз. Виштынецком. Производители линя были отловлены в р. Неманин ставными сетями и 06.06.07 перевезены в аквариальную кафедры «Аквакультуры» ФГОУ ВПО «КГТУ», где осуществлялось их выращивание в экспериментальной УЗВ. Аквариальная предназначена для выращивания рыб и ведения научной деятельности. Она включает в себя два помещения: вентиляторная и основное помещение. В вентиляторной находится лабораторное оборудование: весы, ФЭК, различная лабораторная посуда, набор пипеток, реактивов, бинокуляр, стойка с аппаратами Вейса. Здесь осуществляется также хранение кормов. В основном помещении располагаются два стационарных бассейна, один из которых отстойник, два бассейна шведского типа, три пластиковых бассейна (объемом 300 л), спаренные аквариумы, аквариум для разведения живых кормов. Для подачи воздуха в выростные емкости используется компрессор. Также имеется набор переносных компрессоров. Для очистки воды используются биофильтры. Схема УЗВ представлена на рисунке 1.

1 - рыбоводные емкости; 2-биореактор; 3-U-образные уровневые трубки; 4-эрлифт; 5-биофильтр
Рисунок 1 – Схема УЗВ в аквариальной кафедры «Аквакультуры» ФГОУ ВПО «КГТУ»
Содержание производителей осуществлялось раздельно по полу в бассейнах. Биофильтр содержал четыре модуля биологической очистки, вода в которые подавалась при помощи помп. В качестве механических фильтров использовались снабженные губками помпы. Емкости для содержания рыбы были частично закрыты крышками, чтобы обеспечить необходимую для рыбы затененность и предотвратить выпрыгивание рыбы.
Регулярно проводилась очистка биофильтров и губок механических фильтров, чистка и частичная замена воды в выростных емкостях.
Кормили производителей кормом Aller Aqua два-три раза в день. Ежедневно измеряли температуру воздуха в рабочем помещении, а также температуру воды в выростных емкостях.
Лини на протяжении большей части эксперимента содержались при температуре 24-26ºС, что соответствует оптимальной температуре для роста, созревания и нереста этого вида. В период с 10.10.07 по 13.03.08 с целью имитации зимовки содержание производителей и ремонта линя осуществлялось при пониженных температурах (минимальная температура за этот период – 9,5ºС у ремонтного и 10ºС у маточного поголовья линя). На рисунке 2 изображен совмещенный график колебаний температуры воды и концентрации кислорода в УЗВ в период выращивания и содержания производителей линя.
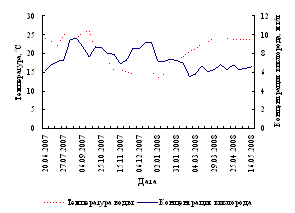
Рисунок 2 – Динамика температуры воды и концентрации кислорода в бассейнах с производителями
Концентрация кислорода в экспериментальной УЗВ с производителями линя не опускалась ниже 5,56 мг/л, что соответствует благоприятным для линя значениям.
В УЗВ с двухгодовалыми особями линя, концентрация кислорода за период проведения эксперимента не опускалась ниже 6,27 мг/л, что соответствует благоприятным для рыб условиям.
В озере Виштынецкое сбор материала проводился 19-20 мая 2008 г. Окунь для исследований был выловлен ставными сетями на двух станциях, соответственно в 38 и 11 квадратах (рисунок 3), координаты которых указаны в таблице 2.
Таблица 2 – Координаты станций расположения ставных сетей в оз. Виштынецком
|
Номер станции |
Начало сети | Конец сети | ||
| широта | долгота | широта | долгота | |
| 1 | 54:25:43,4 | 22:43:09,1 | 54:25:30,3 | 22:43:22,4 |
| 2 | 54:26:55,8 | 22:42:23,2 | 54:26:46,5 | 22:42:13,3 |
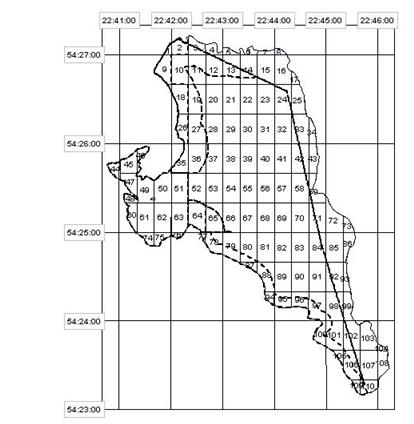
Рис. 3 Расположение станций в оз. Виштынецкое
Во время отлова окуней температура воды в озере была 12°C, а содержание кислорода на ст. 1 – 11,32, на ст. 2 – 10,33 мг/л.
Всего была проанализирована кровь 5 экз. двухгодовалых линей и 9 экз. производителей линя в возрасте 4 года, 7 экз. окуня с первой станции в Виштынецком озере и 8 экз. – со второй станции.
Для сбора крови рыбу заворачивали в чистую марлю и с помощью скальпеля убирали слизь и чешую в месте взятия крови. Затем это место протирали ватным тампоном, смоченным 96% спиртом, и тщательно просушивали ватой. Иглой шприца делали прокол кожи по медиальной линии позади анального плавника и под углом 45° вводили иглу до позвоночника, где проходит ствол хвостовой артерии, иглой прорезали артерию и в шприц начинала поступать кровь
В качестве антикоагулянта применяли гепарин, которым предварительно ополаскивали шприцы, затем их высушивали [55].
Кровь для исследований брали в следующей последовательности:
1) перенесли кровь на часовое стекло;
2) приготовили мазок;
3) перенесли кровь в пробирки с консервирующим раствором;
4) перенесли кровь в трансформирующий раствор;
5) подсчитывали эритроциты в камере Горяева;
6) определяли гемоглобин на спектрофотометре;
7) фиксировали и окрашивали мазки крови;
8) определяли гемоглобин на спектрофотометре;
9) подсчитывали косвенным методом количество лейкоцитов;
10) определяли лейкоцитарную формулу [57].
Мазки приготавливали следующим образом: держа предметное стекло за узкие края переносили на него каплю крови. Другой рукой приставляли шлифовальное стекло узким краем к стеклу с кровью справа от капли под углом 45° и продвигали его влево до соприкосновения с кровью. Выжидали пока кровь расплывется по всему ребру шлифовального стекла и затем легким быстрым движением вели его слева направо до тех пор, пока не будет исчерпана вся капля. После приготовлений мазки сушили на воздухе до исчезновения влажного блеска [57].
Фиксировали и окрашивали мазки способом окраски по Паппенгейму. Предметные стекла ставили в киевский аппарат для массовой окраски мазков и заливали красителем-фиксатором Мая-Грюнвальда. Через 3 мин его заменяли рабочим красителем Романовского. Продолжали окрашивание в течение 15 мин, после чего краситель сливали, а мазки промывали водопроводной водой. Потом стекла ставили под углом для высушивания [57].
Определяли следующие показатели крови: концентрацию гемоглобина, эритроцитов, лейкоцитов, общего белка в сыворотке крови, лейкоцитарную формулу, цитометрические характеристики эритроцитов.
Подсчет эритроцитов и лейкоцитов проводился с помощью камеры Горяева. Эритроциты считали в 5 больших квадратах камеры, а лейкоциты будут подсчитаны косвенным методом. Определяемую величину получали по формуле (1).
Х = ![]() , (1)
, (1)
где Х- число клеток в 1 мкл крови; а – количество подсчитанных клеток; y – степень разведения крови; n – количество малых квадратов.
для эритроцитов:
Хэ = ![]()
![]() = а*12500;
= а*12500;
для лейкоцитов:
Хл = ![]()
![]() = а*2500 [53].
= а*2500 [53].
Для определения гемоглобина использовали гемиглобинцианидный метод на ФЭК с использованием ацетонциангидрина. Расчет содержания гемоглобина будет проводиться по формуле (2):
Hb, г/л = ![]() , (2)
, (2)
где Еоп – экстинция опытной пробы; Ест – экстинция стандартного раствора; С – концентрация гемиглобинцианида в стандартном растворе (59,75 мг%); К – коэффициент разведения крови; 0,01 – коэффициент для пресчета концентрации гемоглобина из мг в г*л -1 [53].
Концентрацию белка крови рыб определяют с помощью коэффициента преломления сыворотки на рефрактометре. Коэффициент преломления довольно точно свидетельствует о количественном содержании в сыворотке белка, которое определяется по таблице [53].
Концентрацию общего белка в сыворотке крови (в г*л -1) определяют по графику, используя найденный коэффициент преломления [53].
Подсчет лейкоцитарной формулы крови на окрашенных препаратах проводили с использованием светового микроскопа с применением иммерсии (увеличение 90х15, 100х15). На мазках подсчитывали 200 лейкоцитов по общепринятой методике. При идентификации лейкоцитов использовали классификацию клеток крови рыб Н.Т. Ивановой (1983). Подсчет лейкоцитарной формулы проводился по следующим группам лейкоцитов: нейтрофилы, среди которых выделяли: миелоциты нейтрофильные, метамиелоциты нейтрофильные, палочкоядерные нейтрофилы, сегментоядерные нейтрофилы; псевдоэозинофилы, эозинофилы, псевдобазофилы, моноциты; малые и большие лимфоциты.
Окрашенные мазки изучали с помощью системы анализа изображений «ВидеоТест - Морфо», которая представляет собой автоматизированное рабочее место, предназначенное для проведения морфологического, стереологического и морфометрического анализа изображений со статистической обработкой полученных результатов. Мазок устанавливается под микроскоп, соединенный с TV-камерой. Телевизионный сигнал с TV-камеры передавался на плато ввода изображений и для визуализации на монитор видеоконтрольного устройства или видеоокно монитора компьютера. В плате ввода TV-сигнал оцифровывался, и изображение в цифровой форме передалось в ОЗУ компьютера для обработки и анализа. Программа позволила получить измерения различных параметров эритроцитов, провести статистическую обработку результатов, получить графики зависимости параметров [53].
Статистическую обработку полученных результатов выполняли по общепринятым методикам [1, 40, 47] в программе «Microsoft Exel 2003». Для расчета ряда показателей использовались стандартные статистические показатели, такие как: среднее значение - М, ошибка средней - m, среднеквадратическое отклонение - σ и коэффициент вариации - CV. Для подтверждения достоверности различий использовали критерий Стьюдента – St.
3 Характеристика крови линя, выращенного в искусственных условиях УЗВ
3.1 Характеристика крови двухгодовалого линя.
Для оценки физиологического состояния выращенной рыбы использовали концентрационные показатели крови, а также лейкоцитарную формулу, которые характеризуют белковый обмен, дыхательную и защитную функции организма.
Средняя масса исследованных двухгодовалых линей составляла 13 г, средняя длина – 75,4 мм. Результаты исследования морфофизиологических характеристик линя представлена в таблице 3.
Таблица 3 – Морфофизиологическая характеристика двухлетков линя
| Показатель | М±m | σ | CV, % |
| Mасса, г | 13,00±2,17 | 9,24 | 12,2 |
| Длина, мм | 75,40±4,13 | 4,85 | 37,3 |
| P порки, г | 9,80±1,75 | 3,91 | 39,9 |
| Индекс почки, % | 8,60±0,76 | 1,70 | 19,8 |
| Индекс печени,% | 15,50±1,48 | 3,31 | 21,4 |
| Индекс селезенки, % | 4,00±0,77 | 1,72 | 42,8 |
Масса и длина двухлетков линя, выращенных в условиях УЗВ, не отличались от таковых показателей у линей такого же возраста из естественных условий [6].
Лейкоцитарная формула линя представлена в таблице 4 и на рисунке 4
Таблица 4 - Лейкоцитарная формула линя, %
| Лейкоциты | М±m | σ | CV, % |
| Мн | 2,63±1,71 | 2,95 | 112,6 |
| Ммн | 0,13±0,14 | 0,25 | 200,0 |
| Пн | 0,50±0,41 | 0,71 | 141,4 |
| Сн | 0,13±0,14 | 0,25 | 200,0 |
| ОЧН | 3,38±1,48 | 2,56 | 75,9 |
| ПЭ | 12,00±6,82 | 11,80 | 98,4 |
| Мо | 1,75±1,17 | 2,02 | 115,47 |
| Блф | 7,00±1,20 | 2,08 | 29,7 |
| Млф | 75,88±8,26 | 14,30 | 18,85 |
| ОЧЛф | 82,88±7,14 | 12,37 | 15,91 |
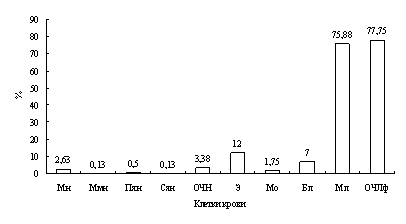
Рисунок 4 - Лейкоцитарная формула двухгодовалых линей, выращенных в УЗВ
Общее количество нейтрофилов в крови линя составило 3,38%. Среди них преобладали юные нейтрофилы – миелоциты, что свидетельствует об активации нейтрофилопоэза. Обращает на себя внимание высокий процент псевдоэозинофилов (12,0±6,82). Что, вероятно, связано со специфическими условиями в УЗВ.
3.2 Характеристика крови производителей линя, выращенных в условиях УЗВ
Морфофизиологические показатели, исследованных производителей линей представлены в таблице 5 и на рисунке 5.
Таблица 5 – Морфофизиологические показатели производителей линя
| Показатель | Самцы | Самки | ||
| M ± m | CV, % | M ± m | CV, % | |
| Длина, мм | 260,00±10,66 | 8,2 | 283,50±8,17 | 5,0 |
| Масса, г | 588,00±53,77 | 18,3 | 651,20±41,91 | 11,2 |
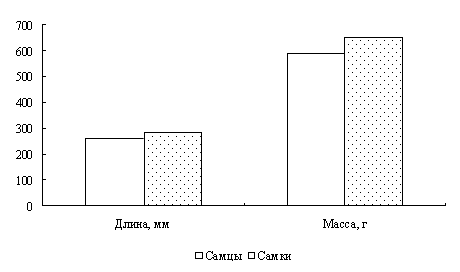
Рисунок 5 – Длина и масса производителей линя, выращенных в УЗВ
Применение критерия Стьюдента показало, что между самками и самцами по длине и массе нет достоверных различий.
Гематологическая характеристика производителей линя, выращенных в условиях УЗВ, представлена в таблице 6.
Таблица 6 – Гематологическая характеристика производителей линя, выращенных в УЗВ
| Параметры | Самцы | Самки | ||
| M ± m | CV, % | M ± m | CV, % | |
|
Hb, г*л-1 ОБС, г*л-1 Эр, Т*л-1 СГЭ, пг Л, Г*л-1 Эр/Л |
47,19±3,28 36,2±7,911 1,470±0,100 32,18±1,66 67,00±19,63 11,66±3,45 |
13,9 43,7 13,7 10,0 58,6 59,2 |
34,66±13,45 61,25±7,141 1,28±0,07 36,18±1,72 101,88±11,081 8,32±3,24 |
67,2 20,2 9,0 8,2 23,1 67,5 |
| Лейкоцитарная формула, % | ||||
|
Мн Ммн Пн Сн ОЧН Э Мо Блф Млф ОЧЛф |
2,50±0,62 2,38±1,67 1,38±0,37 0,13±0,41 7,38±1,88 6,25±1,68 1,25±0,47 10,75±1,92 74,38±2,49 85,13±2,78 |
56,6 75,7 34,8 66,7 61,8 48,2 69,3 25,6 5,3 45,2 |
3,00±0,82 3,88±0,36 0,25±0,17 0,50±0,33 7,63±1,23 4,88±1,04 2,25±1,67 11,88±1,77 73,38±1,61 85,25±0,83 |
47,1 16,2 115,5 115,5 28,0 36,9 128,9 25,8 3,8 1,7 |
различия достоверны при (при р<0,05)
Лейкоцитарный состав крови производителей линя, выращенных в УЗВ, представлен основными группами клеток: агранулоцитами – лимфоцитами (большими и малыми) и моноцитами, и гранулоцитами – нейтрофильными миелоцитами и метамиелоцитами, палочко- и сегментоядерными нейтрофилами, эозинофилами. Общее число нейтрофилов в крови самок и самцов линя составило 7,63±1,23 и 7,38±1,88% соответственно; общее число лимфоцитов - 85,13±2,78 и 85,25±0,83%. Достоверных различий в лейкоцитарной формуле между самками и самцами линя нами не обнаружено, что подтверждает единообразие клеточного состава белой крови внутри вида среди одновозрастных рыб и отражает отсутствие полового диморфизма по этому показателю у линя такого возраста и физиологического состояния. На рисунке 6 представлена лейкоцитарная формула производителей линя.
Применение критерия Стьюдента показало, что концентрация общего белка в сыворотке крови самок, выращенных в условиях УЗВ, достоверно выше в сравнении с самцами (61,25±7,14 против 36,2±7,91) (рисунок 7). Вероятно, это было связано с особенностями метаболизма у самок в период формирования ооцитов.

Рисунок 6 – Лейкоцитарная формула производителей линя, выращенных в УЗВ
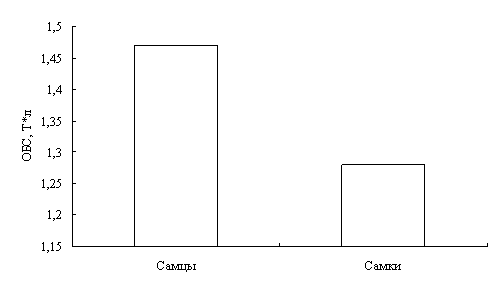
Рисунок 7 – Достоверные различия ОБС в крови производителей линя, выращенных в УЗВ
Цитометрические параметры эритроцитов производителей линя, выращенных в УЗВ. В периферической крови производителей линя, выращенных в условиях УЗВ, наблюдались здоровые, правильной формы эритроциты. Результаты анализа этих клеток представлены в таблице 7.
Эритроциты линя мелкие эллипсоидные клетки, средняя площадь которых составляет у самцов 94,06 мкм2, периметр 36,63 мкм, у самок площадь эритроцитов - 87, мкм2 периметр - 35,06 мкм. Применение критерия Стьюдента показало, что площадь, периметр, большая и малая оси эритроцитов самцов достоверно больше значений этих параметров эритроцитов самок (при р<0,001) (рисунки 8, 9).
Таблица 7 – Параметры эритроцитов производителей линя, выращенных в УЗВ
| Показатель | Самцы | Самки | ||
| M ± m | CV, % | M ± m | CV, % | |
|
S, мкм2 P, мкм Fk Fе Fо А, мкм В, мкм А/В |
94,060±0,7581 36,630±0,1861 0,8814±0,0039 0,9981±0,0000 0,6344±0,0069 13,900±0,1091 8,659±0,0551 1,624±0,019 |
11,2 7,0 6,2 0,1 15,0 10,9 8,9 16,8 |
87,300±0,8821 35,060±0,1921 0,8916±0,0408 0,9981±0,0000 0,6324±0,0064 13,360±0,1031 8,371±0,0591 1,612±0,017 |
11,2 6,4 4,6 0,1 11,2 8,5 7,8 12,0 |
1, 2, 3 – различия достоверны соответственно при р< 0,05, 0,01 и 0,001
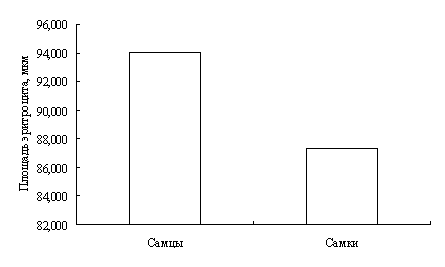
Рисунок 8 – Достоверные различия площади эритроцитов производителей линя из УЗВ
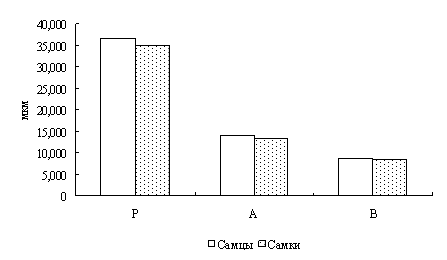
Рисунок 9 – Достоверные различия параметров эритроцитов производителей линя из УЗВ
Описанные выше цитометрические параметры производителей линя позволяют заключить, что эритроциты самцов крупнее эритроцитов самок линя, что является характерным и для других видов рыб. Например, по исследованиям Г.Г. Серпунина [52] для самцов карпа в сравнении с самками также характерна большая площадь (101,69±4,77 против 97,75±3,16), периметр (36,38±0,90 против 35,01±1,01), большая ось (13,45±0,32 против 13,01±0,21) и малая ось (9,62±0,25 против 9,59±0,18) эритроцитов.
Полученные результаты гематологических параметров производителей линя сравнили с гематологическими показателями производителей линя, выловленных в р. Немонин (естественных условий обитания), которые установила О.Е. Гончаренок (2008) (таблица 8).
Сравнение гематологических показателей самцов, выращенных в УЗВ с самцами, выловленными в р.Неманин, показало, что у первых в сравнении со вторыми концентрация гемоглобина (47,19±3,28 против 91,33±4,45 г*л-1) и СГЭ (32,18±1,66 против 74,66±9,22 пг) достоверно ниже (при р<0,001). Нами были обнаружены достоверные различия и по концентрации эритроцитов (1,470±0,100 против 1,294±0,190 г*л-1), которая была достоверно выше у самцов из УЗВ (при р<0,001). Выявленные различия указывают на преобладание незрелых форм эритроцитов в крови линя из УЗВ, т.е. на активацию эритропоэза, что говорит о менее благоприятных условиях для производителей, выращиваемых в УЗВ (рисунок 10, 11).
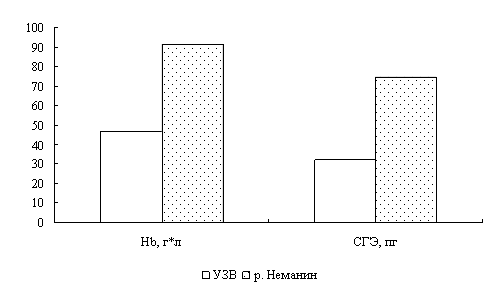
Рисунок 10 – Достоверные различия концентрации гемоглобина и СГЭ самцов линя из УЗВ и р.Неманин
Таблица 8 – Сравнительная гематологическая характеристика производителей линя из естественных условий (р. Неманин) и выращенных в УЗВ
| Параметры | Производители, выращенные в условиях УЗВ | Производители, выловленные в р.Неманин [18] | ||||||
| Самцы | Самки | Самцы | Самки | |||||
| M ± m | CV, % | M ± m | CV, % | M ± m | CV, % | M ± m | CV, % | |
|
Hb, г*л-1 |
47,19±3,283 |
13,9 | 34,66±13,45 | 67,2 |
91,33±4,453 |
9,7 | 65,75±3,74 | 16,1 |
|
ОБС, г*л-1 |
36,2±7,91 | 43,7 |
61,25±7,143 |
20,2 | 34,59±0,05 | 0,3 |
34,49±0,033 |
0,3 |
|
Эр, Т*л-1 |
1,470±0,1003 |
13,7 | 1,28±0,07 | 9,0 |
1,294±0,1903 |
29,4 | 1,259±0,119 | 26,7 |
| СГЭ, пг |
32,18±1,663 |
10,0 |
36,18±1,721 |
8,2 |
74,66±9,223 |
24,7 |
58,03±8,081 |
39,4 |
|
Л, Г*л-1 |
67,00±19,63 | 58,6 |
101,88±11,081 |
23,1 | 46,17±7,26 | 31,5 |
67,70±6,571 |
27,5 |
| Эр/Л | 11,66±3,45 | 59,2 | 8,32±3,24 | 67,5 | 28,45±1,64 | 11,5 | 19,43±1,05 | 15,3 |
| Лейкоцитарная формула, % | ||||||||
| Мн | 2,50±0,62 | 56,6 | 3,00±0,82 | 47,1 | 2,13±1,16 | 109,3 | 1,56±0,39 | 71,4 |
| Ммн | 2,38±1,67 | 75,7 |
3,88±0,362 |
16,2 | 2,50±0,87 | 69,3 |
2,00±0,382 |
53,5 |
| Пн | 1,38±0,37 | 34,8 | 0,25±0,17 | 115,5 | 2,13±1,01 | 94,9 | 1,25±0,48 | 109,0 |
| Сн | 0,13±0,41 | 66,7 | 0,50±0,33 | 115,5 | 2,38±0,47 | 39,9 | 0,81±0,21 | 73,1 |
| ОЧН | 7,38±1,88 | 61,8 | 7,63±1,23 | 28,0 | 9,24±2,70 | 59,1 | 5,63±0,97 | 48,7 |
| Э | 6,25±1,68 | 48,2 | 4,88±1,04 | 36,9 | 6,00±0,46 | 15,2 | 1,88±1,29 | 194,8 |
| Мо | 1,25±0,47 | 69,3 | 2,25±1,67 | 128,9 | 1,50±0,50 | 66,7 | 2,06±0,38 | 52,4 |
| Блф | 10,75±1,92 | 25,6 |
11,88±1,772 |
25,8 | 6,25±1,25 | 40,0 |
5,63±0,602 |
30,0 |
| Млф | 74,38±2,49 | 5,3 |
73,38±1,612 |
3,8 | 77,11±3,60 | 9,3 |
84,80±1,992 |
6,6 |
| ОЧЛф | 85,13±2,78 | 45,2 |
85,25±0,831 |
1,7 | 83,36±2,38 | 5,7 |
90,43±1,831 |
5,7 |
| Масса, г | 588,00±53,77 | 18,3 | 651,25±41,91 | 11,2 | 622,50±91,87 | 29,5 | 663,75±51,82 | 22,1 |
1, 2, 3 - различия достоверны соответственно при р<0,05; 0,01 и 0,001
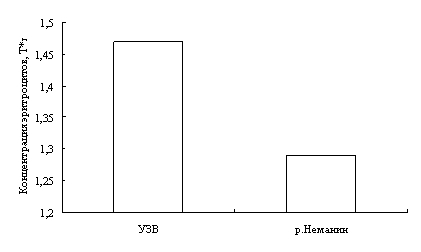
Рисунок 11 – Достоверные различия концентрации эритроцитов самцов линя из УЗВ и р.Неманин
Нами установлены достоверные различия между характеристиками крови самок, выращенных в УЗВ и самок из р. Неманин, которые проявились в общем содержании белка в сыворотке крови, концентрации лейкоцитов и СГЭ. У первых были достоверно выше концентрация общего белка в сыворотке крови (при р<0,05 и р<0,01) и концентрации лейкоцитов (при р<0,05) и достоверно ниже (при р<0,05) оказалось значение СГЭ (рисунки 12, 13).
Более высокая концентрация общего белка в сыворотке крови самок из УЗВ (61,25±7,14 против. 34,49±0,03 г*л-1) и лейкоцитов в крови (101,88±11,08 против 67,70±6,57Г*л-1) и более низкий СГЭ (36,18±1,72 против 58,03±8,08) в сравнении с самками из р. Неманин, по-видимому, связаны с более концентрированным кормом и более высокой температурой воды при выращивании в УЗВ (25°C против 22°C в р. Неманин).

Рисунок 12 – Достоверные различия концентрации общего белка в сыворотке крови и концентрации лейкоцитов в крови самок линя из УЗВ и из р. Неманин
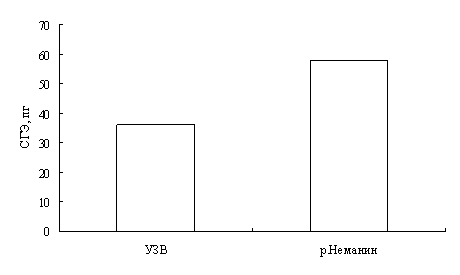
Рисунок 13 – Достоверные различия СГЭ в крови самок линя из УЗВ и из р. Неманин
В лейкоцитарной формуле самок линя из УЗВ доля нейтрофильных метамиелоцитов и больших лимфоцитов была выше (р<0,01), чем у самок из р. Неманин (соответственно 3,88±0,36 против 2,00±0,38% и 11,88±1,77 против 5,63±0,60), однако доля малых лимфоцитов (р<0,05) и ОЧЛф (р<0,01) оказалась достоверно ниже у первых самок (73,38±1,61 против 84,80±1,99 и 85,25±0,83 против 90,43±1,83% соответственно) (рисунок 14).
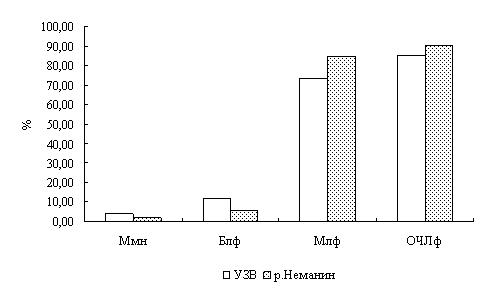
Рисунок 14 – Достоверные различия доли нейтрофильных метамиелоцитов, больших, малых лимфоцитов и ОЧЛф в крови самок линя из УЗВ и из р. Неманин
Более высокая доля нейтрофильных метамиелоцитов при понижении малых лимфоцитов и ОЧЛф за счет увеличения больших лимфоцитов связано, вероятно, с большей температурой воды в УЗВ, в сравнении с р.Неманин.
4. Гематологическая характеристика окуня оз. Виштынецкого
Исследования гематологических параметров окуня оз. Виштынецкое проводились в мае 2008 г.
Лейкоцитарный состав крови окуня оз. Виштынецкое представлен основными клетками – лимфоцитами, моноцитами, лимфоцитами (большими и малыми), нейтрофильными миелоцитами и метамиелоцитами, палочко- и сегментоядерными нейтрофилами, эозинофилами. В целом, белая кровь окуня носит ярко выраженный лимфоидный характер – лимфоциты составляют 70-100% от общего числа лейкоцитов в периферической крови. Лимфоциты представляют собой клетки с плотным круглым или бухтообразным ядром красно-фиолетового цвета, окруженным нешироким слоем базофильной цитоплазмы. Размеры лимфоцитов могут сильно варьировать. Большие лимфоциты окуня – крупные клетки, окрашенные в сине-фиолетовый цвет, имеющие хорошо заметный слой цитоплазмы. Малые лимфоциты – более мелкие клетки, окрашенные в темно-фиолетовый цвет с едва заметным ободком цитоплазмы с небольшими выростами. Моноциты окуня – довольно крупные клетки с ядром, расположенным эксцентрично овальной или бобовидной формы. Ядро окрашено в красно-фиолетовый цвет, широкие хроматиновые нити образуют специфическую складчатую структуру. Цитоплазма занимает большую часть клетки и имеет сероватый или дымчатый цвет. Гранулоцитопоэз у окуня осуществляется по следующей схеме: миелобласт – промиелоцит – миелоцит – метамиелоцит – палочкоядерный гранулоцит – сегментоядерный гранулоцит. Подавляющее большинство клеток зернистого ряда представлено нейтрофилами. Нейтрофилы - это крупные клетки округлой формы с бледно серо-голубой окраской и нежно-розовой зернистостью. Ядро молодых нейтрофилов округлое, по мере созревания оно приобретает более вытянутую форму. На стадии сегментоядерного нейтрофила ядро становится красно-фиолетовым резко сегментированным. Эозинофилы представляют собой клетки, имеющие плотное компактное красно-фиолетовое ядро. Цитоплазма практически не просматривается из-за наличия крупных гранул. [2, 53].
Гематологические характеристики окуня оз. Виштынецкого представлены в таблице 9, лейкоцитарная формула - на рисунке 15.
В лейкоцитарной формуле окуня оз. Виштынецкого, выловленного на двух станция, достоверных различий не выявлено. На рисунке 14 показано, что среди нейтрофилов преобладают юные формы (нейтрофильные миелоциты и метамиелоциты), однако доля этих клеток не превышает значения, приведенные для окуня Ивановой Н.Т. (1983). Основная функция этих клеток – защита организма от инфекции и от токсических воздействий. Характерно, что нейтрофил все функции начинает выполнять относительно зрелым, на стадии палочкоядерной формы. Общее число лимфоцитов (их основная функция – реализация иммунологических реакций) также не превышало значение их доли в крови окуней, исследованных Ивановой Н.Т. (1983). Из вышесказанного следует, что в организме окуней нет необходимости в активации защитных функций, что говорит о благополучном физиологическом состоянии окуня оз. Виштынецкого и, следовательно, о благоприятных экологических условиях в этом озере.
Таблица 9 – Гематологические показатели окуня оз. Виштынецкого
| Показатели | Ст. 1 | Ст. 2 | ||
| M ± m | CV, % | M ± m | CV, % | |
|
Hb, г*л-1 ОБС, г*л-1 Эр, Т*л-1 СГЭ, пг Л, Г*л-1 Масса, г |
49,8±2,85 29,38±4,62 1,710±0,1102 29,72±2,55 113,57±10,56 210,00±0,05 |
14,0 38,5 16,4 21,0 22,8 52,71 |
43,16±7,17 37,63±2,88 1,260±0,1602 42,05±12,55 146,56±31,00 70,00±0,02 |
44,0 20,3 34,0 79,0 56,0 67,85 |
| Лейкоцитарная формула, % | ||||
|
Мн Ммн Пн Сн ОЧН Э Мо Блф Млф ОЧЛф |
4,57±0,65 4,14±0,87 1,64±0,81 1,93±0,52 12,29±1,92 1,57±0,43 3,21±0,59 19,79±1,19 63,14±3,08 82,93±13,12 |
34,8 51,5 121,4 66,00 38,24 67,3 44,78 14,70 11,96 44,58 |
3,88±1,10 4,81±1,05 1,88±0,39 1,88±0,36 12,44±2,10 1,81±0,48 1,94±0,55 18,94±2,10 64,88±3,09 83,81±11,47 |
75,2 58,0 54,8 50,9 44,7 70,6 74,8 29,3 12,6 41,5 |
| Параметры эритроцитов | ||||
|
S, мкм2 P, мкм Fk Fе Fо А, мкм В, мкм А/В |
85,360±1,0412 34,340±0,2022 0,905±0,004 0,998±0,000 0,6569±0,00613 12,91±0,082 8,414±0,077 1,548±0,015 |
13,23 6,39 4,37 0,089 10,13 6,65 9,97 10,55 |
79,69±0,6302 32,950±0,1432 0,921±0,002 0,998±0,000 0,6797±0,0443 12,29±0,662 8,267±0,041 1,491±0,010 |
10,1 5,5 3,3 0,084 8,3 6,8 6,3 8,5 |
1, 2, 3 – различия достоверны соответственно при р< 0,05, 0,01 и 0,001
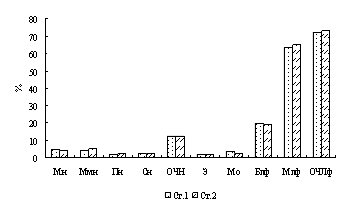
Рисунок 15 – Лейкоцитарная формула окуня на ст.1 и ст.2 оз. Виштынецкого
Применение критерия Стьюдента показало, что у окуней на станции 1 значения концентрации эритроцитов достоверно выше (р<0,01), чем у рыб на станции 2 (1,710±0,110 против 1,260±0,160 Т*л-1), что связано с большим возрастом окуней на станции 1 (здесь выловлены рыбы в возрасте 3-5 лет) в сравнении со станцией 2 (возраст рыб 2-4 года). Достоверные различия по этому параметру представлены на рисунке 16.

Рисунок 16 – Достоверные различия концентрации эритроцитов в крови
окуня оз.Виштынецкого
При сравнении цитометрических параметров эритроцитов у окуней оз. Виштынецкого с применением критерия Стьюдента получили следующие результаты. У окуня, выловленного на станции 1, достоверно выше (р<0,001) были значения площади, периметра и большой оси эритроцитов, в сравнении с окунем со станции 2. При этом у первых достоверно ниже (р<0,01) была округлость эритроцита, то есть эритроциты окуня на станции 1 были более крупными и более вытянутыми по форме в сравнении с эритроцитами окуня со станции 2 (рисунки 17 - 19).
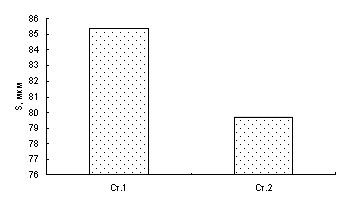
Рисунок 17 – Достоверные различия площади эритроцитов окуня оз. Виштынецкого
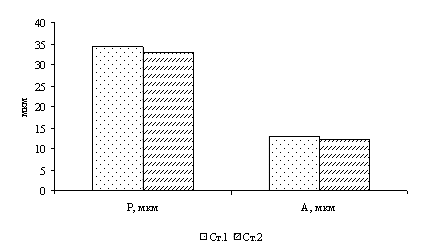
Рисунок 18 – Достоверные различия периметра и большой оси эритроцитов окуня
оз. Виштынецкого
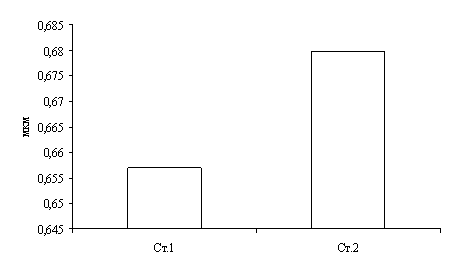
Рисунок 19 – Достоверные различия округлости эритроцитов окуня оз. Виштынецкого
Такие различия цитометрических параметров эритроцитов, по-видимому, связаны с тем, что на станции 1 окуни были представлены более старшими возрастными группами, в сравнении со станцией 2. Полученные нами результаты, позволяют сделать вывод о том, что с возрастом эритроциты рыб становятся крупнее и приобретают более вытянутую форму.
Возраст оказывает заметное влияние на гематологические показатели рыб [17, 19, 73]. По мнению В.М. Яхненко (1984), состав крови с возрастом, несмотря на биологические различия исследованных автором видов, изменяется однотипно и определяется, в первую очередь, физиологическими факторами [56].
С возрастом концентрация гемоглобина у рыб увеличивается [4, 19, 70]. По данным Л.Д. Житеневой (1999), у белуги, осетра, сельди малопозвонковой концентрация гемоглобина с возрастом неуклонно увеличивается. Аналогичное увеличение этого показателя происходит у форели [24], налима [33], угря [22].
У производителей персидского осетра и севрюги уровень в крови гемоглобина, эритроцитов гораздо выше (при р<0,01), чем у молоди [23]. Авторы также обнаружили существенные различия между молодью и взрослыми рыбами в лейкоцитарной формуле по лимфоцитам и нейтрофилам [56]. Доля нейтрофильных миелоцитов и больших лимфоцитов у исследуемого окуня оз. Виштынецкого с возрастом достоверно уменьшалась.
Более высокие концентрации гемоглобина, СГЭ отмечены у двухлеток в сравнении с сеголетками белого и пестрого толстолобиков и большеротого буффало [66]. Что касается концентрации лейкоцитов, то по данным автора. Этот показатель оказался больше у сеголеток, чем у двухлеток.
С возрастом у красноперки наблюдается увеличение всех форм нейтрофилов и лимфоцитов, что отражает подъем неспецифического иммунитета [37]
У карпа с увеличением возраста увеличиваются концентрация гемоглобина, ОБС, СГЭ. Концентрация лейкоцитов нарастает к двухлетнему возрасту, затем испытывает тенденцию к снижению. Динамика концентрации эритроцитов с возрастом имеет противоречивый характер [56].
Гематологические показатели крови окуня различного возраста, установленные нами, представлены в таблице 10.
При установлении возрастных различий гематологических показателей окуня оз. Виштынецкого получили схожие с вышеперечисленными литературными данными результаты по концентрации гемоглобина, которая у окуней двухлетнего возраста была достоверно выше (р<0,01) в сравнении с окунями в возрасте четырех лет (42,21±3,74 против 56,55±0,11). Нами установлено также уменьшение доли нейтрофильных миелоцитов (3,38±0,17 против 1,50±0,50 у рыб в возрасте двух и трех лет соответственно) и больших лимфоцитов (24,67±1,74 против 16,75±1,75 против 14,67±2,19 при сравнении рыб в возрасте двух, трех и четырех лет соответственно). Концентрация лейкоцитов в крови окуня к трем годам достоверно увеличивалась, а к четырем снова уменьшалась. В крови окуней на станции 1 оз. Виштынецкого концентрация эритроцитов достоверно уменьшалась (р<0,01) у четырехгодовалых рыб в сравнении с пятигодовалыми. На станции 2 этот показатель достоверно уменьшался (р<0,01) в крови окуней при сравнении двухгодовалых с трехгодовалыми и двухгодовалых с четырехгодовалыми рыбами. Достоверные различия гематологических показателей представлены на рисунках 20 - 23.
Таблица 10 – Сравнительная гематологическая характеристика окуня оз. Виштынецкого по возрастам
| Показатели | Станция 1 | Станция 2 | ||||||||||
| 3 годовики | 4 годовики | 5 годовики | 2 годовики | 3 годовики | 4 годовики | |||||||
| M ± m | CV, % | M ± m | CV, % | M ± m | CV, % | M ± m | CV, % | M ± m | CV, % | M ± m | CV, % | |
|
Hb, г*л-1 ОБС, г*л-1 Эр, Т*л-1 СГЭ, пг Л, Г*л-1 Эр/Л |
52,82±0,50 13,55±4,65 1,897±0,330 28,75±5,24 121,25±21,25 15,65±0,04 |
1,3 48,5 24,5 25,8 24,8 0,3 |
46,66±2,672 25,50±2,60 1,447±0,0702 32,42±3,45 113,75±18,75 13,18±2,80 |
8,1 14,4 7,0 15,1 23,3 30,1 |
43,99±4,002 - 1,834±0,0202 23,96±1,89 127,50±0,00 14,39±0,17 |
12,9 - 1,7 11,2 22,3 1,7 |
42,21±3,743 40,13±1,37 1,663±0,1302 25,56±2,25 96,67±15,903 17,73±1,63 |
15,3 5,9 13,1 15,3 28,5 15,9 |
48,99±0,50 42,05±9,85 1,150±0,082 22,92±2,53 261,25±3,752,3 14,40±0,25 |
1,6 33,1 10 23,2 2,0 8,0 |
56,55±0,113 32,17±2,99 0,923±0,2302 71,29±20,50 120,00±41,102 10,22±3,92 |
0,3 16,1 43,5 49,8 57,9 66,4 |
| Лейкоцитарная формула, % | ||||||||||||
|
Мн Ммн Пн Сн ОЧН Э Мо Блф Млф ОЧЛф |
3,75±0,25 5,00±2,50 0,75±0,25 1,25±0,75 10,75±1,75 1,75±1,25 2,25±0,75 19,75±2,75 65,50±1,50 85,25±1,25 |
9,4 70,7 47,1 84,9 23,02 101,0 47,14 19,7 3,24 2,07 |
6,00±1,50 3,75±0,25 1,25±0,25 2,25±0,25 13,25±1,75 1,50±0,00 3,25±0,25 21,25±2,25 60,75±3,75 82,00±1,50 |
35,4 9,4 28,3 15,7 18,7 0 10,9 15 8,7 2,6 |
4,00±1,50 4,00±2,50 0,75±0,25 1,50±0,15 10,25±6,25 2,25±0,25 3,25±1,75 17,50±2,00 66,75±10,25 84,25±8,25 |
53,0 88,4 63,2 95,0 86,2 15,7 76,2 16,2 21,7 13,8 |
3,38±0,172 2,83±0,60 1,33±0,44 1,67±0,17 9,67±1,20 1,17±0,60 2,00±0,76 24,67±1,742 62,50±3,12 87,17±1,42 |
7,5 36,7 57,3 17,3 21,5 89,2 66,1 12,2 8,65 2,83 |
1,50±0,502 4,75±2,25 1,50±0,80 2,00±1,50 9,75±4,25 2,75±0,75 2,25±1,75 16,75±1,752 68,50±8,50 85,25±6,75 |
47,1 67,0 90,3 106,1 61,65 38,6 110 14,8 17,6 11,2 |
5,50±2,57 6,83±1,74 2,67±0,44 2,00±0,50 17,00±3,46 1,83±0,93 1,67±0,88 14,67±2,192 64,83±6,09 79,50±5,011 |
80,8 44,1 28,6 43,3 35,3 87,7 91,6 25,8 16,3 11,1 |
1, 2, 3 – различия достоверны соответственно при р< 0,05, 0,01 и 0,001
Рисунок 20 – Достоверные различия концентрации эритроцитов окуня оз. Виштынецкого на ст. 1
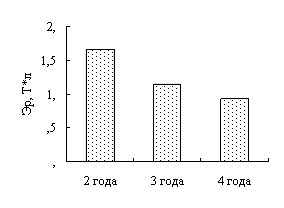
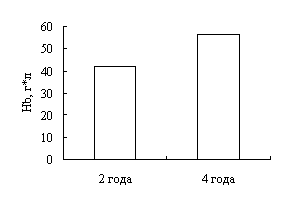
Рисунок 21 – Достоверные различия концентрации эритроцитов и гемоглобина у окуня оз. Виштынецкого на ст. 2
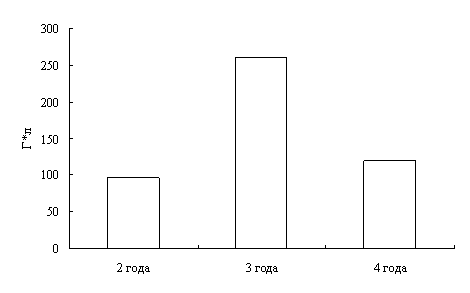
Рисунок 22 – Достоверные различия концентрации лейкоцитов у окуня оз. Виштынецкого на ст. 2
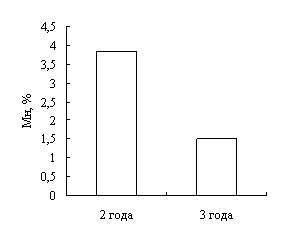
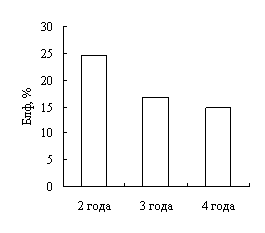
Рисунок 23 – Достоверные различия доли нейтрофильных миелоцитов и больших лимфоцитов у окуня оз. Виштынецкого на ст. 2
Сравнительная гематологическая характеристика окуня оз. Виштынецкого и Куршского залива представлена в таблице 11.
Таблица 11 – Сравнительная гематологическая характеристика окуня оз. Виштынецкого и Куршского залива
| Показатели | оз.Виштынецкое | Куршский залив [50] | ||
| M ± m | CV, % | M ± m | CV, % | |
|
Hb, г*л-1 ОБС, г*л-1 Эр, Т*л-1 СГЭ, пг Л, Г*л-1 Масса, г |
49,8±2,853 29,38±4,623 1,710±0,110 29,72±2,553 113,57±10,56 210±0,053 |
14,0 38,5 16,4 21,0 24,7 52,7 |
32,38±1,933 43,83±1,143 1,369±0,109 23,87±0,593 83,09±8,84 129,42±1,733 |
14,6 4,5 19,6 6,1 26,1 29,9 |
| Лейкоцитарная формула, % | ||||
|
Мн Ммн Пн Сн ОЧН Э Мо Блф Млф ОЧЛф |
4,57±0,653 4,14±0,871 1,64±0,81 1,93±0,521 12,29±1,923 1,57±0,432 3,21±0,592 19,79±1,193 63,14±3,083 82,93±13,12 |
34,8 51,5 121,4 66,0 38,2 67,3 44,8 14,7 12,0 44,6 |
1,42±0,243 1,17±0,171 0 0,080±0,0081 2,67±0,213 0,25±0,172 1,67±0,212 5,92±0,663 87,58±0,963 93,50±0,65 |
41,3 35,0 244,9 19,4 167,3 31,0 27,5 2,7 1,70 |
| Параметры эритроцитов | ||||
|
S, мкм2 P, мкм Fk Fе Fо А, мкм В, мкм А/В |
85,360±0,0412 34,340±0,202 0,905±0,004 0,998±0,000 0,6569±0,00612 12,91±0,082 8,414±0,077 1,55±0,022 |
13,2 6,4 4,4 0,1 10,1 6,6 10,0 10,6 |
69,74±4,382 31,08±0,95 0,901±0,007 0,996±0,000 0,711±0,0132 11,00±0,262 8,05±0,34 1,38±0,032 |
15,4 7,5 2,0 0,1 4,4 5,8 10,3 5,6 |
1, 2, 3 – различия достоверны соответственно при р< 0,05, 0,01 и 0,001
При сравнении гематологических параметров крови с помощью критерия Стьюдента, выяснили, что концентрация гемоглобина (49,8±2,85 против 32,38±1,93), СГЭ (29,72±2,55 против 23,87±0,59) были достоверно выше (при р<0,001) у окуней оз. Виштынецкого в сравнении с окунями из Куршского залива (рисунок 24). Достоверно ниже (при р<0,001) была концентрация общего белка в сыворотке крови окуней оз. Виштынецкое (29,38±4,62 против 43,83±1,14), в сравнении с окунем Куршского залива (рисунок 25). Более высокая концентрация Hb, СГЭ в крови окуня оз. Виштынецкое, вероятно, связана с большей массой тела в сравнении с массой окуней Куршского залива.
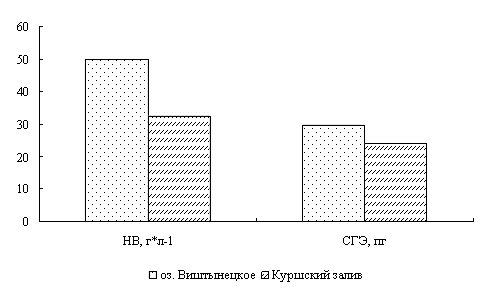
Рисунок 24 – Достоверные различия концентрации гемоглобина, СГЭ в крови окуня оз. Виштынецкого и Куршского залива
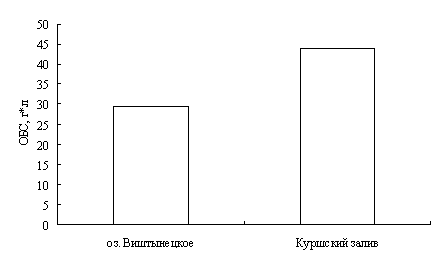
Рисунок 25 – Достоверные различия концентрации общего белка в сыворотке крови окуня оз. Виштынецкого и Куршского залива
Уменьшение концентрации общего белка в сыворотке крови при падении температуры объясняется снижением интенсивности обмена веществ и транспорта белка [56], что подтверждается проведенными исследованиями - более низкое содержание ОБС в крови окуней оз. Виштынецкого, температура воды в котором была 12 против 19ºC – в Куршском заливе.
Более высокая концентрация гемоглобина и СГЭ отражает несколько лучшее физиологическое состояние окуня оз. Виштынецкого в сравнении с окунем Куршского залива.
Применение критерия Стьюдента при изучении лейкоцитарной формулы окуня показало, что у окуней оз. Виштынецкого достоверно выше была доля нейтрофильных миелоцитов (при р<0,001) (4,57±0,65 против 1,42±0,24), метамиелоцитов (при р<0,05) (4,14±0,87 против 1,17±0,17), сегментоядерных нейтрофилов (при р<0,05) (1,93±0,52 против 0,080±0,008), эозинофилов (при р<0,01) (1,57±0,43 против 0,25±0,17), моноцитов (при р<0,01) (3,21±0,59 против 1,67±0,21) и больших лимфоцитов (при р<0,001) (19,79±1,19 против5,92±0,66) и ниже доля малых лимфоцитов (при р<0,001) (63,14±3,08 против 87,58±0,96) в сравнении с Куршским заливом. Данные различия представлены на рисунке 26.
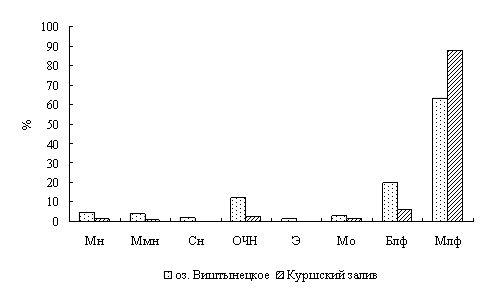
Рисунок 26 – Достоверные различия доли форменных элементов крови окуня из Курского залива и оз. Виштынецкого
Доля нейтрофильных миелоцитов и метамиелоцитов, сегментоядерных нейтрофилов и лимфоцитов в крови окуней оз. Виштынецкого не значительно отличалось от таковых параметров, исследованных Ивановой Н.Т (1983), а доля перечисленных лейкоцитов в крови окуней Куршского залива значительно ниже, приведенных автором значений, что предположительно, является отражением снижения иммунитета окуней Куршского залива. При сравнении цитометрических параметров эритроцитов окуня оз. Виштынецкого достоверно выше (при р<0,001) была площадь эритроцитов, периметр, фактор округлости, большая ось эритроцита в сравнении с эритроцитами окуня Куршского залива. А по показателю отношения большой оси к малой эритроциты окуня оз. Виштынецкое уступали таковым Куршского залива (рисунки 27, 28)
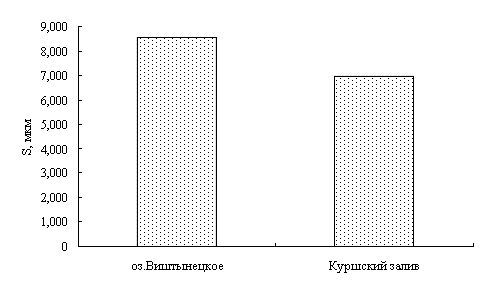
Рисунок 27 – Достоверные различия площади эритроцитов окуня из оз. Виштынецкого и Курского залива
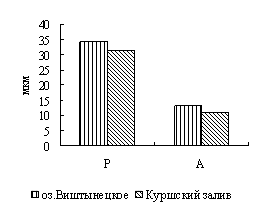
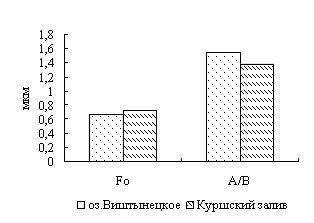
Рисунок 28 – Достоверные различия периметра, большой оси, округлости и индекса вытянутости эритроцитов окуня из оз. Виштынецкого и Курского залива
Вышеперечисленные достоверные различия между эритроцитами окуня оз. Виштынецкого и эритроцитами окуня Куршского залива свидетельствуют, что более крупные и более вытянутые эритроциты характерны для окуня оз. Виштынецкого.
1. Выявлен высокий процент псевдоэозинофилов в крови двухгодовалых линей, выращиваемых в условиях УЗВ, что, вероятно, связано со специфическими условиями выращивания в УЗВ.
2. Между созревающими самками и самцами линя не выявлено достоверных различий в лейкоцитарной формуле, что говорит о единообразии клеточного состава белой крови внутри вида среди одновозрастных рыб, выращенных в одинаковых условиях и отражает отсутствие полового диморфизма по этому показателю у линя в этот период онтогенеза.
3. В сыворотке крови самок линя в сравнении с самцами достоверно больше концентрация общего белка, что связано с особенностями белкового метаболизма у самок в период роста ооцитов.
4. Цитометрический анализ эритроцитов производителей линя показал, что эритроциты у самцов линя крупнее, чем у самок. Средняя площадь эритроцитов составляет у самцов и самок соответственно 94,060 ± 0,758 и 87,300±0,882 мкм2, периметр соответственно 36,630 ±0,186 и 35,060±0,202 мкм.
5. Более низкая концентрации гемоглобина, СГЭ и более высокая концентрация эритроцитов в крови самцов из УЗВ в сравнении с самцами р.Неманин говорит о преобладании незрелых эритроцитов в крови окуня из УЗВ, т.е. об активации эритропоэза, что отражает менее благоприятные условиях для самцов, выращиваемых в УЗВ.
6. Более высокая температура воды в рыбоводных емкостях УЗВ приводит к уменьшению СГЭ, доли малых лимфоцитов и общего числа лимфоцитов; способствует увеличению концентрации лейкоцитов, общего белка в сыворотке крови, доли нейтрофильных метамиелоцитов и больших лимфоцитов.
7. Уровень гематологических показателей крови линя из УЗВ и р.Неманин свидетельствует о несколько лучшем физиологическом состоянии вторых.
8. Впервые установлен гематологический статус окуня оз.Виштынецкого по концентрации гемоглобина, эритроцитов, лейкоцитов, общего белка в сыворотке крови, среднему содержание гемоглобина в эритроците, отношению эритроцитов к лейкоцитам, лейкоцитарной формуле крови, цитометрическим параметрам эритроцитов.
9. Лейкоцитарный состав крови окуня оз. Виштынецкое представлен основными клетками – моноцитами, лимфоцитами (большими и малыми), нейтрофильными миелоцитами и метамиелоцитами, палочко- и сегментоядерными нейтрофилами, эозинофилами.
10. Отсутствие достоверных различий в лейкоцитарной формуле окуня оз. Виштынецкого, выловленного на различных станциях, свидетельствует о сходстве физиологического состояния окуня в различных районах озера и благоприятных экологических условиях в водоеме.
11. У окуня оз. Виштынецкого с возрастом достоверно увеличивается концентрация гемоглобина, снижается концентрация эритроцитов, доля нейтрофильных метамиелоцитов и больших лимфоцитов, площадь, периметр, большая ось, округлость и вытянутость эритроцитов. Концентрация лейкоцитов в крови окуня к трем годам достоверно увеличивается, а к четырем снова уменьшается.
12. У окуня оз. Виштынецкого в сравнении с окунем Куршского залива достоверно больше концентрация гемоглобина, лейкоцитов, СГЭ, доля нейтрофильных миелоцитов, метамиелоцитов, сегментоядерных нейтрофилов, эозинофилов, моноцитов, больших лимфоцитов и меньше концентрация общего белка в сыворотке крови и доля малых лимфоцитов, что свидетельствует о лучшем физиологическом состоянии окуня оз. Виштынецкого. Это подтвердили и достоверные различия по цитометрическим показателям эритроцитов.
Список использованных источников
1. Аксютина З.М. Элементы математической оценки результатов наблюдений в биологических и рыбохозяйственных исследованиях: - М.: Пищ. пром-сть, 1968. – 287 с.
2. Аленичев С.В., Рыжков Л.П. цитоморфологический состав крови и динамика гематологических показателей окуня Онежского озера в условиях техногенного загрязнения // Вопросы ихтиологии 2000. – Т. 40. вып. 1.- С. 91-96.
3. Аминева В.А., Яржомбек А.А. Физиология рыб. – М.: Легк. и пищ. пром-сть. – 1984. – 200 с.
4. Антипова П.С. Изменение крови в связи с возрастом и некоторыми экологическими условиями. Автореф. дис…канд. биол. наук 03.00.10. – Ихтиология / Мосрыбвтуз. – М., 1947. – 22 с.
5. Баринова Г.М. Калининградская область. Климат. – Калининград: Янтарный сказ, 2002. – 45 с.
6. Берг Л.Н. – Промысловые рыбы СССР. Атлас. М.: Пищепромиздат, 1949. – 368 с.
7. Биохимия животных: Учеб. пособие / А.В. Чечеткин, И.Д. Головацкий, П.А. Калиман, В.И. Воронянский; под ред. А.В. Чечеткина. - М.: Высш. школа, 1982. - 511 с., ил.
8. Божко А.М., Смирнова И.С. Перспективы изменения метода морфофизиологических индикаторов при изучении рыбца в пределах ареала // Тез. 2 заседание по проблеме «Исследование продуктивности вида в пределах ареала». - Вильнюс: Мокслас, 1971. - С. 25-26.
9. Бойко М.Е. Изучение последствия тиреойдных гормонов и кортизола на рост, тиреойдный статус и показатели крови молоди осетра // Вопросы рыболовства. – т. 5, № 3 (19), 2004. – С. 500-508.
10. Вершигора А.Е. Основы иммунологии. – Киев: Высшая школа, 1980. – 502 с.
11. Вихман А.А. Системный анализ иммунологической реакции рыб в условиях аквакультуры. – М.: Экспедитор, 1996. – 176 с.
12. Волков Н.В. Экспериментальное исследование физиологии крови рыб при действии на них неблагоприятных факторов внешней среды – Петрозаводск, 1971. – 84 с.
13. Гальперин С.И. Физиология человека и животных М.: Высш. школа, 1977. – 653 с.
14. Гематологические показатели сеголетков стерляди при выращивании в бассейнах и садках на корме «Aller futura»в Калининградской области / Г.Г. Серпунин, Л.В Савина, Е.И. Хрусталев и др. // IV международная конференция аквакультуры осетровых рыб: достижения и перспективы развития, материалы / ВНИРО, БИОС. – Астрахань, 2006. – С. 271-273.
15. Географический атлас Калининградской области / Гл. ред. В.В. Орленок. – Калининградд: КГУ, ЦНИТ, 2002. – 276 с.
16. Гидрохимический режим Балтийского моря/ Е.И. Черновская, Н.М. Пастухова, А.Г. Буйневич и др. – Л., 1965. – 168 с.
17. Головина Н.А. Морфофункциональная характеристика крови рыб – объектов аквакультуры: автореф дис…доктора биол. наук 03.00.10. – Ихтиология / ВНИИПРХ. – М., 1996. – 53 с.
18. Гончаренок О.Е. Рыбоводно-биологические особенности искусственного воспроизводства линя (Tinka tinka L.) в условиях Калининградской области: дисс… канд. биол. наук. - Калининград, 2008. – 206 с.
19. Житенева Л.Д., Гориславская М.М. Гематологические показатели сельди Clupea pallasi pallasi Val. в зависимости от ее физиологического состояния // Вопросы ихтиологии. – 1986. – Т. 26. – Вып. 1. – 137-146
20. Житенева Л.Д., Макаров Э.В, Рудницкая О.А. Основы ихтиогематологии (в сравнительном аспекте) Ростов на Дону: изд-во Эверест, 2004. – 312 с.
21. Зайцева Н.Д. Общее количество гемоглобина в онтогенезе угря (Anguilla anguilla L.) и некоторые особенности его крови // Эколого-физиологические особенности крови рыб. – М.: Наука, 1968. – С. 89-93.
1. Зорризахра Д., Пурголям Р., Саеди А.А. Сравнительный анализ гематологических показателей заводской молоди осетровых, выдержанной в различных условиях // Осетровые на рубеже ХХI века: тез. докл. Международной конф., Астрахань 11-15 сент 2000 г. – Астрахань, 2000. – С. 147-148.
2. Зубина Н.Ф. Динамика накопления гемоглобина в онтогенезе радужной форели // Обмен веществ и биохимия рыб. – М., 1967. – С. 171-176.
3. Иванов А.А. Физиология рыб: Учеб. пособие. - М.: Мир, 1989. - 359 с.
4. Иванова Н.Т. Атлас клеток крови рыб. – М.: Легк. и пищ. пром-сть, 1983. – 184 с.
5. Иванова Н.Т. Некоторые аспекты к основам ихтиогематологии / Н.Т. Иванова. Ростов-на-Дону: РГПУ, 2002. - 54 с.
6. Индустриальное рыбоводство в замкнутых системах / под ред. В.И. Филатова – М., 1991. – 89 с.
7. Ихтиопаталогия / Н.А. Головина, Ю.А. Стрелков, В.Н. Воронин и др., под ред. Н.А. Головиной, О.Н. Бауера. - М.: Мир, 2003. - 448 с., ил.
8. Казначеев Е.Н. Рыбы Каспийского моря. – М.: Легк. и пищ. пром-сть, 1963. – 179 с.
9. Квасова И.П. Сезонная характеристика количества крови и гемоглобина в организме налима // Эколого-физиологические особенности крови рыб. – М.: Наука, 1968. – С. 81-84.
10. Киселев А.Ю. Установки с замкнутым циклом водоиспользования и технологии выращивания в них объектов аквакультуры // Сер. Аквакультура: обзорная информация / ВНИИПРХ. – 1997. – Вып. 1. – 80 с.
11. Козлов В.И, Абрамович Л.С. Товарное осетроводство. – М., 1986. – 117 с.
12. Козлов В.И. Справочник фермера-рыбовода. – М.: ВНИРО, 1998,. - 448 с.
13. Комарова Г.В. Гематологические показатели окуня и красноперки ильменя Горичный / Вестн. Астраханского гос. техн. ун-т. – 1994. – № 1. – С. 80-82.
14. Константинов А.С. Общая гидробиология. – М., 1986. – 472 с.
15. Лабораторные исследования в ветиринарии: биохимические и микологические: справочник / Антонов Б.И., Яковлева Т.Ф., Дерябина В.И. и др. – М.: Агропромиздат, 1991. – 287 с.
16. Лакин Г.Ф. Биометрия. - М.: Высш. .школа 1980. – 293 с.
17. Лапирова Т.Б., Мкряков В.Р. Влияние некоторых стресс-факторов на функциональное состояние гуморального звена неспецифического иммунитета молоди карпа // Вопросы рыболовства. – Т.6, № 4 (24), 2005. – С. 771-776.
18. Мамонтов Ю.П. О мерах по развитию аквакультуры в Российской Федерации // Рыбное хозяйство – 2006. – № 3. – С. 20-21
19. Мамонтов Ю.П., Бочерук А.К., Катичева Л.Ю.Программа развития товарного осетроводства в системе росрыбхоза на период до 2000 года // Информационный пакет, серия Аквакультура. Рыбное хозяйство. - Всероссийский научно-исследовательский и проектно-конструкторский институт экономики, информации и АСУ рыб. хоз-ва России. - 1995. - № 1. - 34 с.
20. Мовчан В.А. Изучение физиологии прудового карпа // Тр. совещ. По физиологии быб. – М.: АНСССР, 1958. – С 251-254.
21. Моисееев П.А., Азизова Н.А. КурановаИ.И. Ихтиология. М.: легк. и пищ. пром-сть, 1981. – 384 с.
22. Никольский Г.В. Экология рыб. – М.: Высш. школа, 1963. – 368 с.
23. Плохинский Н.А. Алгоритмы биометрии. - М.: МГУ, 1980. – 150 с.
24. Правдин И.Ф. Руководство по изучению рыб – М.:1966. – 375 с.
25. Правдин И.Ф. Руководство по изучению рыб / И.Ф. Правдин. – М., 1966. – 375 с.
26. Пучков Н.В. Физиология рыб М.: 1954. – 371 с.
27. Расс Т.С. Жизнь Животных в 7 Томах. – М.: Просвящение, 1977. - Т. 4 Рыбы. – С.?
28. Рыбы: Популярный энциклопедический справочник / под ред. П.И. Жукова. -Минск, 1989. – 311 с.
29. Савина Л.В. Использование гематологических показателей рыб для оценки новой кормовой добавки МИК БАК и экологического состояния естественных водоемов: дисс… канд. биол. наук. Калининград, 2004. – 189 с.
30. Сементина Е.В. Оценка физиологического состояния рыбы при выращивании в различных условиях: дисс…магистра. Калининград, 2007 – 69 с.
31. Серпунин Г.Г. Гематологические показатели адаптации рыб: дисс. … д-ра биол. наук. – Калининград, 2002. - 482 с.
32. Серпунин Г.Г. Методы гематологических исследований рыб: методические указания для самостоятельной работы студентов высших учебных заведений по направлению 110900.68 – Водные биоресурсы и аквакультура / Г.Г. Серпунин, Л.В. Савина. – Калининград: КГТУ, 2005. – 54 с.
33. Смирнова А.В. Рыбоводно-биологическая характеристика производителей и потомства линя р. Немонин. - дисс…магистра. Калининград, 2007 – 115 с.
34. Смирнова Е.Н. Морфо-экологический анализ развития рыб // Сб. научн. тр. / Института морфологии животных.- 1967.- С. 65-69.
35. Смирнова Л.И. Сезонные изменения лейкоцитарного состава крови леща и окуня // Гидробиологический журнал.,1966. - № 4. – С. 71-74.
36. Смит Л.С. Введение в физиологию рыб. – М., 1986. – 45 с.
37. Справочник по физиологии рыб / Яржомберг А.А, Лиманский В.В, Щербина Т.В и др – М: высш.школа,1986. – 192 с.
38. Стеффенс В. Индустриальные методы выращивания рыб / В. Стеффенс. – М., 1983.- 311 с.
39. Строганов Н.С. Физиологическая приспособляемость рыб к температуре воды. – М., 1956.- 152 с.
40. Технология комбинированного выращивания камбалы, форели и налима в установках с замкнутым циклом водоснабжения / Е.И. Хрусталев, А.Ю. Киселев, А.Н. Илясов и др. – М., 1995. – 13 с.
41. Тромбицкий И.Д. Картина крови прудовых рыб в норме и при паразитных заболеваниях: Автореф. дис… канд. биол. наук. – М., 1984. – 21 с.
42. Тылик К.В. Ихтиофауна водоемов Калининградской области / К.В Тылик. – Калининград, 2003. – 135 с.
43. Тылик К.В. Рыбы трансграничных водоемов России и Литвы. Калининград: ФГОУ ВПО КГТУ, 2007. – 128 с.
44. Федорченко В.И., Новоженин Н.П., В.Ф. Зайцев. Товарное рыбоводство. – М., 1991. – 175 с.
45. Шабалина А.А., Князева А.М. Изменение количества гемоглобина в крови радужной форели в зависимости от рациона, возраста, веса и стадии зрелости // Изв. / ГосНИОРХ. – Л., 1969. – Т.68. – С. 72-78.
46. Шварц С.С., Смирнов В.С. Метод морфофизиологических индикаторов в экологии наземных животных // Сб. науч. тр. / Ин-т экологии растений и животных. – УФАН СССР, 1967. – вып.58. – С. 459-466.
47. Шварц С.С., Смирнов В.С. Метод морфофизиологических индикаторов в экологии наземных животных // Сб. научн. тр. / Институт экологии растений и животных. - УФАН СССР, 1967. - вып. 58. - С. 459-466.
48. Яхненко В.М. Морфологическая характеристика крови рыб оз. Байкал / Новосибирск, 1984. – 121 с.
Перепечатка материалов без ссылки на наш сайт запрещена