Курсовая работа: Биосинтез мембранных белков и их встраивание в биомембрану
Курсовая работа: Биосинтез мембранных белков и их встраивание в биомембрану
Пензенский Государственный Педагогический Университет
им. В.Г. Белинского
Курсовая работа на тему:
Биосинтез мембранных белков и их встраивание в биомембрану
Выполнила: студентка группы Бх-41
Данилова Елена
Проверил: к.б.н., \
Соловьев В.Б.
Пенза,2009
Содержание
Введение
1. Методы исследования переноса белков через мембраны
2. Встраивание белков в мембрану
2.1 Сигнальная гипотеза
2.2 Мембранная триггерная гипотеза
3. Полипептидные сигналы, отвечающие за сортировку белков и встраивание их в мембраны
3.1 Сигнальная последовательность, определяющая встраивание в эндоплазматический ретикулум
3.2 Стоп-сигналы переноса
3.3 Использование синтетических сигнальных пептидов
3.4 Сигнальные пептидазы
4. Растворимые и мембраносвязанные белки, необходимые для переноса
5. Сборка мультисубъединичных комплексов и обновление мембранных белков
Выводы
Литература
Введение
Процесс образования мембран начинается с синтеза белковых и липидных компонентов, которые затем должны быть доставлены к месту назначения. В состав мембран входят различные белки, для биосинтеза которых необходимы точные механизмы. В принципе имеются две главные проблемы, касающиеся сборки мембранных белков.
1. Все закодированные в ядре белки синтезируются общим пулом рибосом. В связи с этим возникает вопрос: как отдельные мембранные белки доставляются к месту назначения? Чем отличаются белки плазматической мембраны от белков внутренней митохондриальной мембраны или от белков мембран эндоплазматического ретикулума? Эту сложную проблему сортировки можно решить только при наличии определенных сигнальных последовательностей в каждом полипептиде, а также соответствующего аппарата узнавания.
2. Каков истинный механизм встраивания мембранных белков в мембрану и как при этом достигается правильная их ориентация относительно мембранного бислоя? Требуют ли механизмы встраивания и ориентации также наличия определенных сигнальных элементов и систем узнавания и если да, то каковы они? Какие свойства обеспечивают при встраивании мембранных белков формирование правильной третичной, а также четвертичной структуры в случае мультисубъединичных ансамблей?
За последние десятилетия в поиске ответов на эти вопросы достигнуты большие успехи, причем они становятся все более значительными. Это в большой мере обусловлено тем, что для выяснения роли специфических сигнальных полипептидных последовательностей в этих процессах стала использоваться рекомбинантная ДНК. Хотя не на все вопросы удалось найти ответы, полученные результаты все больше убеждают в том, что совершенно разные на первый взгляд системы в действительности обладают фундаментальным сходством. Например, не так давно было показано, что механизм секреции белков имеет много общего с механизмом синтеза белков плазматической мембраны. Совсем недавно достигнут большой прогресс в понимании общих принципов переноса белков через мембраны митохондрий, эндоплазматического ретикулума и грамотрицательных бактерий. Эти экспериментальные системы изучались наиболее интенсивно. И хотя между соответствующими процессами есть значительные различия, они имеют ряд общих особенностей.
1. Существует идентифицируемая часть полипептидной последовательности, которая служит участком узнавания, или «сигналом», направляющим отдельный полипептид к мембране, в которую он встраивается. Эти сигнальные участки часто расположены на N-конце новосинтезированного полипептида и отщепляются специфическими сигнальными пептидазами после встраивания его в нужную мембрану или переноса через нее. Для обозначения N-концевого сигнала различными авторами использовались следующие термины: сигнальный пептид, сигнальная последовательность, транзитный пептид, лидирующий пептид пре-последовательность.
2. Процессы трансляции и встраивания белков в мембрану можно разделить в эксперименте. Для сборки мембранных белков в большинстве случаев необходима энергия, отличающаяся по величине от той, которая требуется для их трансляции на рибосоме.
3. Связавшийся с мембраной-мишенью полипептид должен, кроме того, находиться в конформации, в которой может осуществляться его перенос через мембрану или встраивание в нее. Во многих случаях перенос белков через мембраны происходит от N-конца к С-концу, при этом необходимо, чтобы белок был, по крайней мере, частично развернут или слабо свернут. Полипептид может транслоцироваться в вытянутой форме в ходе энергозависимого процесса.
Особый интерес представляет процесс сборки мембранных белков. На рис.1 схематично показаны три общих механизма проникновения пептидного предшественника в мембрану. Механизмы А и Б являются вариантами схемы линейного вытеснения, согласно которой сигнальная последовательность направляет полипептид к переносящему устройству, которое включает в себя заполненный водой канал. Сигнальная последовательность может проходить прямо сквозь канал (механизм А) или оставаться связанной с мембраной, образуя, как показано на рис.1, петлю (механизм Б). В отсутствии какого-либо сигнала остановки процесса переноса полипептид будет транспортироваться через мембрану целиком. Однако если внутри полипептида имеется второй сигнальный пептид, называемый стоп-сигналом переноса, то процесс останавливается, и стоп-сигнал переноса становится трансмембранным сегментом зрелого мембранного белка. Фиксируя белок в мембране, стоп-сигнал переноса действует как сигнал сортировки.
Схема В на рис.1 иллюстрирует возможную роль самопроизвольного включения в мембрану гидрофобных элементов полипептидного предшественника. Этот механизм может реализовываться только тогда, когда включение в мембрану происходит после трансляции полипептида.
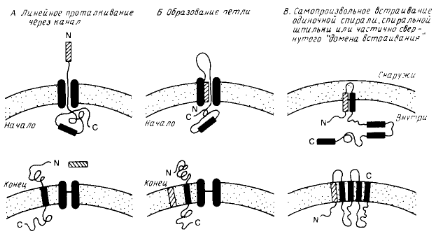
Рис.1. Три общие модели возможной сборки белков в мембране.
Две первые (А и Б) предполагают, что белок транспортируется в линейной форме через белковый канал. При наличии стоп-сигнала процесс останавливается, в противном случае через мембрану проходит весь белок. Модель В предполагает, что гидрофобные элементы полипептида самопроизвольно включаются в липидный бислой. Гидрофобный элемент может представлять собой одиночную спираль или более сложную структуру. Процесс может быть опосредован белками.
Проблема сборки белков очень важна. Этот процесс обычно не протекает самопроизвольно, лишь в результате взаимодействия между образующимися полипептидами и липидным бислоем. Напротив, он является энергозависимым и опосредуется белковыми структурами, которые пока не изучены в достаточной степени. Экспериментальные данные свидетельствуют о том, что перенос белков через мембрану (например, в полость эндоплазматического ретикулума) и сборка интегральных мембранных белков – это тесно связанные стороны одного и того же процесса. Логично ожидать, что проблемы транспортировки белков через мембраны и их укладки должны решаться одинаковым образом.
1. Методы исследования переноса белков через мембраны
Наиболее детально изучены бесклеточные системы, в которых гораздо легче количественно исследовать процессы переноса и протеолитического процессинга белков. Во всех этих системах используются мембранные везикулы или препараты органелл, у которых поверхность, обращенная в цитоплазму, «смотрит» наружу, поскольку перенос белков осуществляется из цитоплазмы. Этому условию удовлетворяют микросомы, полученные из эндоплазматического ретикулума секретирующих клеток, митохондрий и хлоропластов. Вывернутые везикулы можно получить из клеток Е. coli, они представляют собой удобный объект для изучения переноса белков в бесклеточной системе.
Полипептид-предшественник, находящийся во внешней среде, при соответствующих условиях будет переноситься внутрь пузырька или, по крайней мере, через мембрану пузырька или органеллы. За этим процессом обычно следят, добавляя протеазы во внешнюю среду. Степень защиты от протеолиза является мерой количества полипептида, транспортированного внутрь везикулы или органеллы. За ходом протеолитического процесса, осуществляемого сигнальной пептидазой, следят с помощью электрофореза в полиакриламидном геле в присутствии ДСН. Белки, встроившиеся в мембрану, можно идентифицировать с помощью щелочной экстракции, при этом предполагается, что белки, которые связаны с поверхностью мембран, при такой обработке удаляются. Однако так бывает не всегда, поэтому результаты, полученные с помощью щелочной экстракции, необходимо интерпретировать с осторожностью.
В таких бесклеточных системах можно изучать биохимические условия переноса белков и идентифицировать необходимые растворимые компоненты. Кроме того, при этом можно варьировать природу переносимого полипептидного «субстрата».
При изучении бесклеточных систем были получены весьма важные данные об условиях, необходимых для переноса белков.
1. Посттрансляционный и котрансляционный перенос. Принято считать, что во всех исследованных системах перенос в мембраны или через мембраны может осуществляться независимо от трансляции. Убедительные данные на этот счет были получены для процесса переноса белков в хлоропластах и митохондриях, а также для переноса через бактериальную мембрану. Долгое время считалось, что перенос белков в эндоплазматический ретикулум или через мембраны эндоплазматического ретикулума всегда осуществляется параллельно трансляции, однако было четко показано, что такая параллельность не обязательна. Также важным считается то, что энергия, необходимая для переноса, не исходит от рибосомного биосинтетического аппарата.
2. Энергетические требования к переносу. Как правило, перенос белков в мембраны или через них энергозависим. Необходимым условием переноса как для прокариотических, так и для эукариотических систем является гидролиз АТР (или другого нуклеозидтрифосфата). Это было показано для следующих процессов: а) переноса белков в строму хлоропластов; б) транспорта белков в митохондриальный матрикс, внутреннюю и наружную мембраны; в) переноса белков через эндоплазматический ретикулум дрожжей и посттрансляционного встраивания мембранных белков в эндоплазматический ретикулум млекопитающих; г) переноса белков через цитоплазматическую мембрану Е.coli.
Еще одним независимым условием переноса белков в матрикс митохондрий и во внутреннюю мембрану митохондрий является наличие на последней трансмембранного потенциала. Этот потенциал, очевидно, необходим на ранней стадии процесса, при связывании белка с митохондрией.
3. Способность предшественника к переносу. Имеются веские доводы в пользу того, что ключевую роль в успешном переносе белка играет его четвертичная структура. Скорее всего это связано с тем, что сигнальная последовательность(ти), узнаваемая аппаратом переноса, должна быть доступна для него. Следовательно, для осуществления переноса белок должен быть неплотно свернут или частично развернут. Кроме того, если белки переносятся через мембрану в вытянутой конформации, то аппарат переноса должен быть способен к их развертыванию во время самого процесса переноса. Если бы белки- предшественники обладали стабильной четвертичной структурой, то они с трудом развертывались бы и, следовательно, не были бы способны к переносу.
Транспорт белков осуществляется в развернутом виде. АТР необходим для разворачивания полипептида. Разворачивание происходит до переноса или параллельно ему. На то, что именно АТР необходим для этого процесса, говорит тот факт, что транспорт укороченных предшественников в отличие от транспорта полноразмерного белка может осуществляться в отсутствии АТР. Впервые эти данные были сделаны на основе изучения митохондриальной мембраны. Для предотвращения свертывания предшественника в нативную конформацию необходим какой-либо растворимый белковый кофактор. Так, был выделен в водорастворимой форме, сходный порином митохондрий, предшественник белка наружной мембраны Е.coli OmpA, который был не способен к эффективному переносу через плазматическую мембрану, если в цитозоле отсутствовал белок, называемый «триггер-фактором». Известно также, что для переноса белков через мембраны эндоплазматического ретикулума млекопитающих или в эндоплазматичекий ретикулум необходим растворимый кофактор, а именно – сигнал-распознающая частица (СРЧ). Возможно, роль этого фактора состоит в предотвращении сворачивания предшественника полипептида.
2. Встраивание белков в мембрану
2.1 Сигнальная гипотеза
Белки встраиваются в мембрану разными способами, но детали этого процесса во многих случаях еще не установлены. Для объяснения механизма встраивания предложены две модели: сигнальная гипотеза и мембранная триггерная гипотеза. В сигнальной гипотезе предполагается, что белок включается в мембрану параллельно его трансляции на мРНК в полирибосомах; это так называемое котрансляционное включение. Когда лидерная последовательность выходит из рибосомы, она выявляется некой сигнал-распознающей частицей (СРЧ), которая блокирует дальнейшую трансляцию на уровне примерно 70 аминокислот, 40 из которых остаются в большом рибосомном комплексе, а 30 экспонированы в среду. СРЧ содержит шесть белков, с ней ассоциирована 7S-РНК, близкородственная «Alu-семейству» последовательностей ДНК с большим числом повторов. Блокирование трансляции не снимается до тех пор, пока комплекс СРЧ-лидерная последовательность – рибосома не свяжется с так называемым «отстригающим» белком (рецептором для СРЧ) эндоплазматического ретикулума. В этот момент начинается котрансляционное встраивание в эндоплазматический ретикулум. В процессе элонгации оставшейся части белка он перемещается через липидный бислой, поскольку рибосома остается присоединенной к эндоплазматическому ретикулуму. Таким образом образуется шероховатый (усеянный рибосомами) эндоплазматический ретикулум. Рибосомы остаются прикрепленными к эндоплазматическому ретикулуму втечении всего времени синтеза мембранного белка и освобождаются и диссоциируют на соответствующие субъединицы только после его завершения. Когда ранее синтезированная часть белка выходит в просвет эндоплазматического ретикулума, отщепляется лидерная последовательность, и присоединяются углеводы.
Интегральные мембранные белки не пересекают мембрану целиком; по-видимому, этому препятствует гидрофильная якорная последовательность на С-конце. Секретируемые же белки проходят сквозь мембранный бислой полностью и высвобождаются в просвет эндоплазматического ретикулума. К моменту их поступления внутрь везикулы углеводные остатки уже оказываются связанными с ними. Впоследствии секретируемые белки обнаруживаются в просвете аппарата Гольджи, где происходит модификация их углеводных цепочек, а затем они перемещаются к специфическим внутриклеточным органеллам или клеточным мембранам либо секретируются. Некоторые белки пересекают одну мембрану, а затем заякориваются в другой, соседней мембране, например внутренней мембране митохондрий.
2.2 Мембранная триггерная гипотеза
В этой гипотезе особое значение придается роли лидерной последовательности в изменении третичной структуры самого белка. Согласно этой гипотезе, лидерная последовательность индуцирует такую упаковку обычно гидрофобного интегрального белка, что последний может оставаться солюбилизированным в водной среде цитоплазмы, где он синтезирован. Мембранный липидный бислой является как бы триггером по отношению к третичной структуре белка – последний переходит в такую конформацию, которая обеспечивает его предпочтительное включение в бислой. Таким образом, белок претерпевает некий переход и сам встраивается в мембрану таким способом, чтобы установить необходимую поперечную асимметрию. Сразу после встраивания белка или его интеграции лидерная последовательность отщепляется. Триггерная гипотеза не предполагает специфического взаимодействия между рибосомой и мембраной, но это еще не означает, что синтез белка не может происходить на мембранах. Возможно, в одной и той же клетке действуют оба механизма.
3. Полипептидные сигналы, отвечающие за сортировку белков и
встраивание их в мембраны
Об аппарате и механизме переноса почти ничего неизвестно, немного больше известно о сигнальных последовательностях, присутствующих в полипептидах и направляющих каждый белок в нужное место. Успехов в этой области удалось достичь благодаря использованию техники рекомбинантных ДНК. С ее помощью были сконструированы гибридные полипептиды, в которые была включена тестируемая аминокислотная последовательность, принадлежащая другому белку. Таким образом можно было изучать влияние предполагаемой сигнальной последовательности на локализацию «белка-пассажира». Преимущества такого подхода удается использовать только в том случае, если вся информация, определяющая локализацию конечного продукта, заключена в первичной последовательности сигнала и если «белок-пассажир» является нейтральным участником процесса и, что существенно, подчиняется сигналу. Это условие выполняется во многих случаях, но известны и такие примеры, когда эффективность переноса или даже конечная локализация зависят от «белка-пассажира». Если «белок-пассажир» находится в конформации, не способной к переносу, то может происходить блокирование переноса химерного белка. Кроме того, функция некоторых сигнальных последовательностей зависит от их локализации в полипептиде или от взаимодействия с другими участками полипептидной цепи.
3.1 Сигнальная последовательность, определяющая встраивание в
эндоплазматический ретикулум
У большинства белков, встроенных в мембрану эндоплазматического ретикулума или пересекающих ее, на N-конце имеется «короткоживущий» сигнальный пептид. Это сигнальная последовательность непосредственно взаимодействует по крайней мере с двумя рецепторами, один из которых растворим (сигнал-распознающая частица), а другой находится в мембране. Можно было бы ожидать, что аминокислотная последовательность этого сигнального пептида будет очень консервативной и примерно одинаковой у всех переносимых белков, но ожидания эти не оправдались. Эти сигнальные участки не отличаются постоянством ни в отношении длины, ни в отношении аминокислотной последовательности, а многочисленные опыты по мутагенезу показали, что они могут претерпевать значительные структурные изменения. Данные о том, что сигнальные пептиды содержат всю информацию, необходимую для транспорта белков через мембраны эндоплазматического ретикулума или внутрь их, были получены в опытах с химерными полипептидами. Присоединение N-концевой сигнальной последовательности к обычным цитоплазматическим белкам, например к глобину, приводило к тому, что они транспортировались в полость эндоплазматического ретикулума.
С точки зрения «сравнительной анатомии» N-концевых сигнальных последовательностей три разных в структурном отношении участка: 1) положительно заряженный N-концевой участок (n-участок); 2) центральное гидрофобное ядро из 7-15 остатков (h-участок); 3) С-концевой участок (с-участок), который является полярным и содержит сайт, узнаваемый сигнальной пептидазой, которая находится на стороне эндоплазматического рутикулума, обращенной в полость.
От небольших изменений в сигнальных последовательностях зависит, будет ли «белок-пассажир» секретироваться в полость эндоплазматического ретикулума или он останется прикрепленным к мембране, и какой будет ориентация N-конца мембранного белка.
3.2 Стоп-сигналы переноса
Для неотщепляемых сигнальных последовательностей, которые играют роль N-концевых якорей в образовавшемся мембранном белке, характерно наличие относительно длинных гидрофобных участков. Отсюда следует, что перенос может останавливаться просто при наличии протяженного гидрофобного участка, который способен образовать трансмембранную α-спираль. В пользу тассского предположения свидетельствуют некоторые экспериментальные данные. Например, с помощью рекомбинантной ДНК в среднюю часть белка Е.coli, в норме секретирующегося через плазматическую мембрану, встраивали гидрофобные сегменты. Если их длина была не менее 16 аминокислотных остатков, то транспорт белка блокировался, и он оставался присоединенным к плазматической мембране. Можно возразить, что в данном случае речь идет о бактериальной системе, но все-таки механизмы переноса в про- и эукариотических системах сходны. Далее были сконструированы варианты G-белка вируса везикулярного стоматита с измененными мембранными доменами. Длина гидрофобного сегмента могла составлять не 20, а 8 остатков, при этом полипептид оставался трансмембранным, хотя транспорт в плазматическую мембрану блокировался. Таким образом, природа стоп-сигнала переноса точно не известна. Необходимо выяснить два вопроса: 1) участвуют ли в остановке переноса специфические белки аппарата переноса; 2) определяется ли остановка переноса гидрофобностью стоп-сигнала или какими-то более тонкими факторами? Было показано, что участки стоп-сигнальной последовательности, ответственные за блокирование переноса через эндоплазматический ретикулум, могут никак не влиять на транспорт через мембрану хлоропласта. Это означает, что упомянутые два процесса могут существенно различаться.
Определение старт- и стоп-сигналов подразумевает линейную схему переноса, начинающегося с N-конца; об этом свидетельствует поведение простых систем. Однако оказалось, что последовательности, которые блокируют перенос в одном случае, могут инициировать его в другом. Следовательно, важна не только природа самих стоп- или старт-последовательностей, но и их окружение в полипептиде.
3.3 Использование синтетических сигнальных пептидов
Синтезированы пептиды, соответствующие сигнальной последовательности дикого типа, а также мутантные сигнальные пептиды белка LamB наружной мембраны и исследовано их взаимодействие с модельными фосфолипидными мембранами и везикулами Е.coli. Показано, что пептид, соответствующий сигнальной последовательности дикого типа, эффективно ингибирует in vitro перенос предшественников как периплазматичекого белка, так и белка наружной мембраны, а пептид, соответствующий мутантной сигнальной последовательности, дефектной по экспорту, не ингибирует перенос в бесклеточной системе. Это означает, что сигнальные пептиды узнают какой-то общий рецептор в цитозольной или мембранной фракции. Кроме того, эффективность связывания этих пептидов с модельными мембранами (монослоем и бислоем) коррелирует с их способностью служить сигналом переноса. Корреляция между гидрофобностью сигнальной последовательности и способностью инициировать транслокацию обнаруживается и при использовании предшественника мальтозосвязывающего белка.
Эти данные согласуются с моделью, согласно которой первичная сигнальная последовательность определяет локализацию полипептидного предшественника в мембране путем неспецифических взаимодействий с липидным бислоем, после чего осуществляется более специфическое связывание с белковым рецептором. Сходная модель была предложена для амфифильных пептидных гормонов. Но сигнальный пептид в животных клетках до его связывания с мембраной взаимодействует с каким-то растворимым рецептором. Какое значение для сигнального пептида имеет его способность связываться с липидами – остается неясным.
3.4 Сигнальные пептидазы
Для удаления временных N-концевых сигнальных пептидов необходимы специфические белки. Наиболее полно охарактеризованы сигнальные протеазы из Е.coli. Большинство экспортируемых белков Е.coli содержат сигнальный пептид, который отщепляется на периплазматической поверхности внутренней мембраны с помощью лидер-пептидазы; ее структура представлена на рис.2.
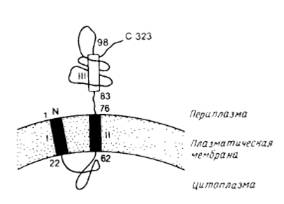
Рис.2. Предполагаемая топология лидер-пептидазы из Е.coli.
Аминокислотные остатки пронумерованы. Прямоугольниками обозначены гидрофобные сегменты. Первый гидрофобный участок не был обнаружен экспериментально, вывод о его существовании был сделан исходя из его гидрофобности. Наличие и ориентация второго гидрофобного участка установлены экспериментально и, по-видимому, он функционирует как внутренняя сигнальная последовательность. Третий гидрофобный сегмент имеет слабо выраженный гидрофобный характер и является частью периплазматического домена.
Для переноса белков через внутреннюю мембрану эта пептидаза не нужна, но она необходима для высвобождения экспортируемого белка из цитоплазматической мембраны. In vitro очищенный фермент мог функционировать, будучи включенным в липосомы. Специфичность расщепления весьма высока, но не определяется исключительно аминокислотной последовательностью вблизи сайта расщепления. Сигнальная пептидаза, функционирующая в эндоплазматическом ретикулуме, имеет ту же специфичность, что и соответствующий фермент Е.coli, что неудивительно, если учесть сходство сигнальных последовательностей. Была очищена сигнальная пептидаза из микросом эукариот. Показано, что она ассоциирована с другими полипептидами, возможно имеющими отношение к механизму переноса.
У Е.coli имеется вторая сигнальная пептидаза, участвующая в процессинге пролипопротеинов. Эти полипептидные компоненты оболочки Е.coli замечательны тем, что при созревании их N-конец модифицируется с помощью глицерида. Пролипопротеиновая сигнальная пептидаза также находится в цитоплазматической мембране. После отщепления сигнальный пептид остается в цитоплазматической мембране и разрушается с помощью мембраносвязанного фермента протеазы ΙV.
В митохондриях и хлоропластах должно присутствовать несколько сигнальных пептидаз, поскольку процессинг происходит более чем в одном компартменте. Растворимую пептидазу из митохондриального матрикса удалось частично очистить, но охарактеризована она не полностью.
4. Растворимые и мембраносвязанные белки, необходимые для
переноса
Идентифицировано несколько цитозольных и мембраносвязанных белковых компонентов, необходимых для переноса. Наиболее детально охарактеризованы белковые факторы, участвующие во встраивании белков в эндоплазматический ретикулум млекопитающих (рис.3).
1. Сигнал-распознающая частица (СРЧ). Это растворимый рибонуклеопротеиновый комплекс, состоящий из шести разных белков и молекулы 7S-РНК. СРЧ необходима для инициации переноса. Она связывается с сигнальной последовательностью образующегося полипептида во время его синтеза на рибосоме. Для препролактина, например, константа диссоциации составляет 1нМ. С помощью метода фотохимического сшивания был идентифицирован один из полипептидов (54 кДа), непосредственно взаимодействующий с сигнальной последовательностью предшественника. По некоторым данным, полученным для бесклеточных систем, связывание СРЧ ингибирует трансляцию или вызывает ее задержку. Впрочем, не исключено, что этот феномен является артефактом; во всяком случае, как было показано на модельных опытах, его не обязательно привлекать для объяснения кинетики переноса белков in vivo. Одна из вероятных функции СРЧ состоит в предотвращении неправильного свертывания образующегося полипептида, которое может блокировать перенос (например, из-за экранирования сигнальных последовательностей). Задержка трансляции должна уменьшать вероятность такого ошибочного свертывания и, следовательно, увеличивать эффективность переноса белков.
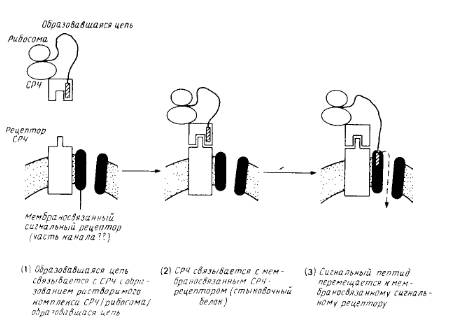
Рис.3. Схематическое изображение ранних стадий котрансляционного переноса полипептида через эндоплазматический ретикулум млекопитающих.
Сигнал-распознающая частица и СРЧ-рецептор (стыковой белок) хорошо охарактеризованы. Мембраносвязывающий сигнальный рецептор изображен как компонент канала через мембрану, но существование таких каналов и роль сигнального рецептора не бесспорны. После образования комплекса между сигнальным пептидом и мембраносвязанным рецептором на стадии 3 СРЧ и стыковочный белок могут диссоциировать и принимать участие в новом цикле, оставляя мембраносвязанную рибосому и образовавшуюся цепь присоединенными к аппарату переноса.
Некоторые небольшие белки (<8,5 кДа) транспортируются в эндоплазматический ретикулум независимо от СРЧ. В их число входят препропептид GLa лягушки, препромеллитин (оба они являются предшественниками секретируемых белков) и пробелок оболочки фага М13. Во всех этих примерах конформация предшественника такова, что белки должны оставаться способными к переносу даже в отсутствии СРЧ и рибосом.
2. Рецептор СРЧ, или стыковочный белок. Комплекс СРЧ/рибосома/образующаяся полипептидная цепь транспортируется в шероховатый эндоплазматический ретикулум, преодолевая энергию сильного взаимодействия между СРЧ, называемым также стыковочным белком. Рецептор СРЧ содержит субъединицу с молекулярной массой 73 кДа, присоединенную N-концом к мембране. Вероятно, рибосома также связывается со специфическими рецепторами, присутствующими в мембране.
3. Рецептор сигнальной последовательности. Сигнальная последовательность на образующейся полипептидной цепи перемещается от СРЧ ко второму рецептору, находящемуся в мембране и называемому рецептором сигнальной последовательности. Об этом свидетельствуют результаты опытов по фотохимическому сшиванию, в которых используется метка, связанная с сигнальной последовательностью препролактина. Предполагаемый мембраносвязанный рецептор представляет собой гликопротеин с молекулярной массой 35 кДа. Возможно, он образует часть канала, через который осуществляется перенос. С помощью такого же подхода с использованием поперечной сшивки и синтетического сигнального пептида был обнаружен еще один кандидат на роль рецептора сигнальной последовательности (45 кДа). Связь между этими двумя белками неизвестна и функции их до конца не установлены. Как только образовавшаяся полипептидная цепь связывается с мембраносвязанным рецепторм, СРЧ и ее рецептор могут освободиться от рибосомы и принять участие в новом цикле. О предполагаемом канале, участвующем в переносе, ничего неизвестно; очистка его является довольно сложной задачей.
5. Сборка мультисубъединичных комплексов и обновление
мембранных белков
После встраивания мембранного полипептида в мембрану он еще должен приобрести правильную конформацию, обеспечивающую его биологическую активность, а если речь идет о мультисубъединичных комплексах, то связаться с другими белками. В частности, у эукариот при этом должны произойти различные ковалентные модификации, например гликозилирование, ацилирование, сульфирование или образование дисульфидных связей. Даже когда такие модификации не являются необходимыми, процесс конформационного созревания может быть медленным и отстоять по времени от встраивания в мембрану.
Например, у Е.coli четко наблюдается сборка стабильных тримеров обоих белков, LamB и OmpF, после включения соответствующих мономеров в наружную мембрану, при этом созревание LamB занимает около 5 мин. В эукариотических клетках гликопротеин гемагглютинина вируса гриппа, прежде чем попасть из эндоплазматического ретикулума в комплекс Гольджи, должен сформировать правильную четвертичную структуру, соответствующую зрелой форме. Несвернутые молекулы гемагглютинина остаются в эндоплазматическом ретикулуме. Образование тримеров занимает примерно 7-10 мин. Сходная олигомеризация наблюдается также для G-белка вируса везикулярного стоматита.
Сборка многих субъединичных комплексов, содержащих разные субъединицы, тоже, по-видимому, происходит в эндоплазматическом ретикулуме. Примером служит никотиновый ацетилхолиновый рецептор, который содержит две α-субъединицы и по одной β-, γ- и δ-субъединице (рис.4).
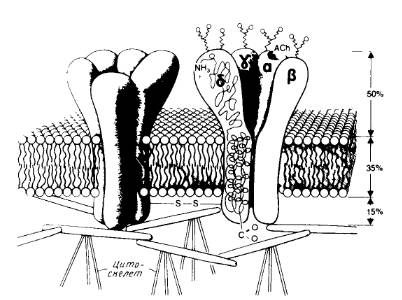
Рис.4. Модель канала никотинового ацетилхолинового рецептора.
Показаны общий вид канала и его расположение в мембране, отмечены участки гликозилирования с наружной стороны и места связывания ацетилхолина на α-субъединицах.
С помощью антител можно различить отдельные формы α-субъединицы: 1) начальный продукт, встраивающийся в эндоплазматический ретикулум; эта форма не может связывать антагонист α-бунгаротоксин; 2) форма, способная связываться с α-бунгаротоксином и образующаяся через несколько минут после завершения трансляции в эндоплазматическом ретикулуме; 3) зрелый рецептор, содержащий все субъединицы (α2βγδ), который обнаруживается через 15мин после завершения трансляции в эндоплазматическом ретикулуме; 4) готовый рецептор на клеточной поверхности, появляющийся спустя примерно 2ч после трансляции. Созревание включает образование дисульфидных связей, олигосахаридный процессинг и ацилирование при участии жирных кислот. Вероятно, определенную роль в сборке, происходящей в комплексе Гольджи, играет фосфорилирование субъединиц.
Решающим фактором процесса сборки является, вероятно, стабильность таких стехиометрических комплексов, как ацетилхолиновый рецептор. По-видимому, в некоторых системах отдельные субъединицы синтезируются в значительном избытке и не образуют стабильных комплексов, а подвергаются протеолитическому расщеплению.
Изучался также процесс созревания и сборки структуры, образующей Na-канал. Необходимым условием созревания является образование дисульфидной связи между α- и β2-субъединицами, однако, это событие происходит спустя примерно 1ч после трансляции и транспорта субъединиц в аппарат Гольджи, а рецептор появляется на клеточной поверхности через 4ч после трансляции. В этом случае свободные α- субъединицы не подвергаются быстрой деградации, а сохраняются в межклеточном пуле и, возможно, используются в дальнейшем в качестве предшественников для формирования канала в растущих нейронах.
Созревшие мембранные белки подвергаются непрерывному обновлению. Период полуобновления Na-канала составляет около 30ч, что типично для поверхностных белков. Обновление большой субъединицы Na/К-АТРазы в растущих клетках в культуре происходит за время 20-40ч. По-видимому, деградация по крайней мере некоторых белков происходит в лизосомах.
Примеры обновления мембранных белков
Стабильность белков в клетке определяется множеством различных факторов. Особенно интересным примером деградации мембранных белков является гидроксиметилглутарил-СоА-редуктаза. Этот фермент находится в гладком эндоплазматическом ретикулуме и регулирует эндогенный синтез холестерола. Деградация его происходит довольно быстро (~2-4ч) и ускоряется при взаимодействии с холестеролом. Для ускорения процесса необходимо наличие мембраносвязанного домена фермента. При определенных условиях в культуре ооцитов китайского хомячка наблюдается сверхпродукция (более 500раз) этого фермента. В результате образуются мембранные трубочки, занимающие 15% клеточного объема и содержащие другие мембранные белки, а также липиды. Добавление холестерола приводит к быстрой деградации избытка мембран, что говорит о координации синтеза и деградации мембранных компонентов.
Другим интересным примером селективного метаболизма мембранных белков является гербицидсвязывающий белок (называемый также белком Dl или QВ) с молекулярной массой 32 кДа из тилакоидов хлоропластов. Этот белок синтезируется как предшественник, созревая внутри отдельных ламелл тилакоида, не собранных в граны, и является частью фотосистемы ΙΙ в ламеллах, входящих в граны. На свету скорость деградации этого полипептида в мембране намного выше, чем других белков. Причина этого явления неизвестна; возможно, оно связано с тем, что в фотосистеме ΙΙ на свету происходят какие-то повреждения.
Выводы
Клетки эукариот содержат много мембранных органелл и множество различных внутриклеточных мембран, каждая из которых обладает уникальным белковым составом. Любой мембранный белок, информация о синтезе которого заключена в ядре, должен безошибочно доставляться от места синтеза на рибосоме, находящейся в цитоплазме, к месту назначения. Для этого используется сложная система сигнальных последовательностей, содержащихся в любой зрелой форме полипептида или предшественника, а также рецепторы внутри клетки, способные эти сигналы распознать. Некоторые мембранные белки включаются в липидный бислой самопроизвольно, но в большинстве случаев правильная сборка белка внутри клеточной мембраны является энергозависимым процессом, который осуществляется с помощью специализированного аппарата. По-видимому, белки не могут включиться в клеточную мембрану до тех пор, пока они не приобретут частично развернутую конформацию. Разворачивание белков или поддержание их в развернутой конформации, необходимой для переноса, возможно, осуществляются при участии АТР и специфических белков в цитоплазме.
Литература
1. Геннис Р. Биомембраны: Молекулярная структура и функции: Пер. с англ. – М.: Мир, 1997.
2. Мари Р., Греннер Д., Мейес П., Родуэлл В. Биохимия человека: В 2-х томах. Т.2. Пер. с англ. – М.: Мир, 1993.
3. Мецлер Д. Биохимия. Химические реакции в живой клетке: Пер. с англ. – М.: Мир, 1980.
4. Страйер Л. Биохимия: Пер. с англ. – М.: Мир, 1984. – Т.1.
Перепечатка материалов без ссылки на наш сайт запрещена