Курсовая работа: Ферментоподобные полимеры
Курсовая работа: Ферментоподобные полимеры
ФЕРМЕНТОПОДОБНЫЕ ПОЛИМЕРЫ
ВВЕДЕНИЕ
Новая область науки — инженерная энзимология — получила интенсивное развитие. Эта область разделилась на несколько направлений, поскольку выявились многообразные возможности, которые могут дать биоорганические катализаторы, ферменты, для проведения химических превращений вне обычной сферы их деятельности, в химических реакторах. Основу для развития инженерной энзимологии как равноправной области науки создали фундаментальные исследования в области энзимологии и достижения в области выделения ферментов, а также в значительной степени учение о скоростях химических реакций. Выявление общности причин, обусловливающих уникальные свойства биокатализаторов: их специфичность и высокую каталитическую активность, а также взаимодействий, поддерживающих структуру молекул ферментов, явились предметом глубоких исследований, конечной целью которых была формулировка целого ряда научных и прикладных задач. Некоторые задачи решены в настоящее время, для других известны принципиальные пути решения, ряд задач пока только поставлены.[1]
В течение последних 30 лет огромный прогресс был сделан в области молекулярной биологии и полимерной химии. Изобретение привело к широко масштабной продукции с низкой стоимостью рекомбинантных протеинов (и структуральных, и ферментных), а позже сделало возможным производить синтетические гомополимеры и диблок сополимеры с определенным числом звеньев. Диапазон применений полимерной химии может дойти до приготовления материалов, подобных протеинам, и в частности, синтез сополимеров, которые могут показывать специфическую каталитическую активность. До настоящего времени попытки приготовить синтетические полимеры, подобные ферментам, были только частично успешными: была обнаружена каталитическая активность, но измеренные специфичность и селективность были малы. Это, главным образом, является следствием неспособности полностью контролировать архитектуру полимера. Во-первых, производимые материалы содержат полимеры с очень широким распределением по числу мономерных звеньев, что не позволяет поддерживать молекулярный вес постоянным для всех молекул. Во-вторых, эти материалы являются не гомогенными по составу, каждая молекулой полимера несет различное число сомономерных звеньев. В-третьих, даже для двух полимерных молекул с одним и тем же числом каждого из мономерных звеньев, эти звенья находятся в разной последовательности вдоль полимерной цепи. Самые недавние попытки в области синтетических полимерных двойников ферментов предлагают нацелиться на контроль над структурой полимера и добиться повышения селективности и активности.
В последнее время целью инженерной энзимологии является приготовление каталитически активных виниловых полимеров определенной длины и определенного состава мономеров и специфической их последовательности. Состав полимеров будет таким, что будут присутствовать все функциональные группы, необходимые для каталитической активности. Кроме того, последовательность мономеров будет такой, что обнаруженная оптимальная конформация полимерного раствора будет согласовываться с подходящей геометрией для максимальной активности. Если выполнить эти необходимые условия, то будет возможно приготовить синтетические полимерные ферменты, которые могут превзойти природные биологические катализаторы. Синтетические катализаторы смогут более эффективно катализировать ферментные реакции, или катализировать реакции, для которых не имеется ферментов. Кроме того, полностью углеродный скелет приводит к очень высокой физико-химической стабильности этих полимеров, которые будут иметь более долгую жизнь, чем ферменты.
Имеет большое значение, что можно будет легко расширить результаты исследования в противоположном направлении, и получать синтетические полимерные двойники, которые будут менее стабильны, чем ферменты. Например, можно использовать мономеры на основе лактонов, для производства биодеградируемых полимеров. Эти полилактоны с ферментной активностью можно затем использовать для восстановления протеаз в промышленных детергентах. Протеазы способствуют очистке ткани через их гидролитическое действие. При детергентном руководстве протеазы разрушаются медленно, загрязняя реки и океаны. Полилактонные синтетические ферменты будут разрушаться быстро. [2]
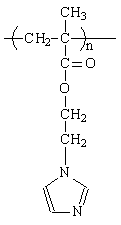
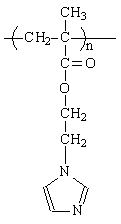
Есть предпосылки, что полимеры с имидазолом, могут являться «enzyme-liked» и представляют собой модель фермента РНКаза, который катализирует гидролиз РНК и ее производных. Катализирует активная группа гистидина - имидазол.[3] РНК - сложная система, требующая синтеза, поэтому первоначально планируется провести исследования каталитических свойств имидазола и полимеров, содержащих имидазол в модельных реакциях.
Перепечатка материалов без ссылки на наш сайт запрещена