Курсовая работа: Применение катализа для защиты окружающей среды
Курсовая работа: Применение катализа для защиты окружающей среды
Применение катализа для защиты окружающей среды
ВВЕДЕНИЕ
Ускорение химических реакций под действием малых количеств веществ (катализаторов), которые сами в ходе реакции не изменяются. Каталитические процессы играют огромную роль в нашей жизни. Биологические катализаторы, называемые ферментами, участвуют в регуляции биохимических процессов. Без катализаторов не могли бы протекать многие промышленные процессы.
Важнейшее свойство катализаторов – селективность, т.е. способность увеличивать скорость лишь определенных химических реакций из многих возможных. Это позволяет осуществлять реакции, протекающие в обычных условиях слишком медленно, чтобы им можно было найти практическое применение, и обеспечивает образование нужных продуктов.
Применение катализаторов для уменьшения загрязнения воздуха началось в конце 1940-х годов. В 1952 А. Хаген-Смит установил, что углеводороды и оксиды азота, входящие в состав выхлопных газов, реагируют на свету с образованием оксидантов (в частности, озона), которые оказывают раздражающее действие на глаза и дают другие нежелательные эффекты. Специально для автомобильных нейтрализаторов созданы катализаторы, в которых активные компоненты нанесены на керамическую подложку с сотовой структурой, через ячейки которой проходят выхлопные газы.
Глава 1. Катализ
Ускорение химических реакций под действием малых количеств веществ (катализаторов), которые сами в ходе реакции не изменяются. Каталитические процессы играют огромную роль в нашей жизни. Биологические катализаторы, называемые ферментами, участвуют в регуляции биохимических процессов. Без катализаторов не могли бы протекать многие промышленные процессы.
Важнейшее свойство катализаторов – селективность, т.е. способность увеличивать скорость лишь определенных химических реакций из многих возможных. Это позволяет осуществлять реакции, протекающие в обычных условиях слишком медленно, чтобы им можно было найти практическое применение, и обеспечивает образование нужных продуктов.
Применение катализаторов способствовало бурному развитию химической промышленности. Они широко используются при переработке нефти, получении различных продуктов, создании новых материалов (например, пластмасс), нередко более дешевых, чем применявшиеся прежде. Примерно 90% объема современного химического производства основано на каталитических процессах. Особую роль играют каталитические процессы в охране окружающей среды.
В 1835 шведский химик Й. Берцелиус установил, что в присутствии определенных веществ скорость некоторых химических реакций существенно возрастает. Для таких веществ он ввел термин «катализатор» (от греч. katalysis – расслабление). Как считал Берцелиус, катализаторы обладают особой способностью ослаблять связи между атомами в молекулах, участвующих в реакции, облегчая таким образом их взаимодействие. Большой вклад в развитие представлений о работе катализаторов внес немецкий физикохимик В. Оствальд, который в 1880 дал определение катализатора как вещества, которое изменяет скорость реакции.
Согласно современным представлениям, катализатор образует комплекс с реагирующими молекулами, стабилизируемый химическими связями. После перегруппировки этот комплекс диссоциирует с высвобождением продуктов и катализатора. Для мономолекулярной реакции превращения молекулы X в Y весь этот процесс можно представить в виде
X + Кат. X-Кат. Y-Кат. Y + Кат.
Высвободившийся катализатор вновь связывается с X, и весь цикл многократно повторяется, обеспечивая образование больших количеств продукта – вещества Y.
Многие вещества при обычных условиях не вступают в химическую реакцию друг с другом. Так, водород и оксид углерода при комнатной температуре не взаимодействуют между собой, поскольку связь между атомами в молекуле H2 достаточно прочная и не разрывается при атаке молекулой CO. Катализатор сближает молекулы H2 и CO, образуя с ними связи. После перегруппировки комплекс катализатор – реагенты диссоциирует с образованием продукта, содержащего атомы C, H и O.
Нередко при взаимодействии одних и тех же веществ образуются разные продукты. Катализатор может направить процесс по пути, наиболее благоприятному для образования определенного продукта. Рассмотрим реакцию между CO и H2. В присутствии медьсодержащего катализатора практически единственным продуктом реакции является метанол:
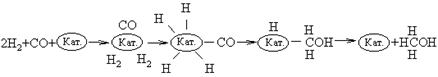
Вначале молекулы СО и Н2 адсорбируются на поверхности катализатора. Затем молекулы СО образуют с катализатором химические связи (происходит хемосорбция), оставаясь в недиссоциированной форме. Молекулы водорода также хемосорбируются на поверхности катализатора, но при этом диссоциируют. В результате перегруппировки образуется переходный комплекс Н-Кат.-CH2OH. После присоединения атома H комплекс распадается с высвобождением CH3OH и катализатора.
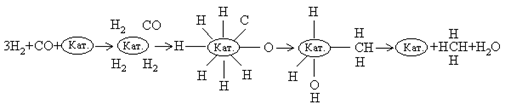
В присутствии никелевого катализатора как СО, так и Н2 хемосорбируются на поверхности в диссоциированной форме, и образуется комплекс Кат.- СН3. Конечными продуктами реакции являются СН4 и Н2О:
Большинство каталитических реакций проводят при определенных давлении и температуре, пропуская реакционную смесь, находящуюся в газообразном или жидком состоянии, через реактор, заполненный частицами катализатора. Для описания условий проведения реакции и характеристики продуктов используются следующие понятия. Объемная скорость – объем газа или жидкости, проходящий через единицу объема катализатора в единицу времени. Каталитическая активность – количество реагентов, превращенных катализатором в продукты в единицу времени. Конверсия – доля вещества, превращенного в данной реакции. Селективность – отношение количества определенного продукта к суммарному количеству продуктов (обычно выражается в процентах). Выход – отношение количества данного продукта к количеству исходного материала (обычно выражается в процентах). Производительность – количество продуктов реакции, образующихся в единице объема в единицу времени.
Катализаторы классифицируют исходя из природы реакции, которую они ускоряют, их химического состава или физических свойств. Каталитическими свойствами обладают в той или иной степени практически все химические элементы и вещества – сами по себе или, чаще, в различных сочетаниях. По своим физическим свойствам катализаторы делятся на гомогенные и гетерогенные. Гетерогенные катализаторы – это твердые вещества, гомогенные диспергированы в той же газовой или жидкой среде, что и реагирующие вещества.
Многие гетерогенные катализаторы содержат металлы. Некоторые металлы, особенно относящиеся к VIII группе периодической системы элементов, обладают каталитической активностью сами по себе; типичный пример – платина. Но большинство металлов проявляют каталитические свойства, находясь в составе соединений; пример – глинозем (оксид алюминия Al2O3).
Необычным свойством многих гетерогенных катализаторов является большая площадь их поверхности. Они пронизаны многочисленными порами, суммарная площадь которых иногда достигает 500 м2 на 1 г катализатора. Во многих случаях оксиды с большой площадью поверхности служат подложкой, на которой в виде небольших кластеров осаждаются частички металлического катализатора. Это обеспечивает эффективное взаимодействие реагентов в газовой или жидкой фазе с каталитически активным металлом. Особый класс гетерогенных катализаторов составляют цеолиты – кристаллические минералы группы алюмосиликатов (соединений кремния и алюминия). Хотя многие гетерогенные катализаторы обладают большой площадью поверхности, обычно они имеют лишь небольшое число активных центров, на долю которых приходится малая часть суммарной поверхности. Катализаторы могут утрачивать свою активность в присутствии небольших количеств химических соединений, называемых каталитическими ядами. Эти вещества связываются с активными центрами, блокируя их. Определение структуры активных центров является предметом интенсивных исследований.
Гомогенные катализаторы имеют различную химическую природу – кислоты (Н2SO4 или Н3РО4), основания (NaOH), органические амины, металлы, чаще всего переходные (Fe или Rh), в форме солей, металлоорганических соединений или карбонилов. К катализаторам относятся также ферменты – белковые молекулы, регулирующие биохимические реакции. Активный центр некоторых ферментов содержит атом металла (Zn, Cu, Fe или Mo). Металлсодержащие ферменты катализируют реакции с участием малых молекул (О2, CO2 или N2). Ферменты обладают очень высокой активностью и селективностью, но работают только при определенных условиях, таких, в которых протекают реакции в живых организмах. В промышленности часто используют т.н. иммобилизованные ферменты.
Катализаторы и охрана окружающей среды. Применение катализаторов для уменьшения загрязнения воздуха началось в конце 1940-х годов. В 1952 А. Хаген-Смит установил, что углеводороды и оксиды азота, входящие в состав выхлопных газов, реагируют на свету с образованием оксидантов (в частности, озона), которые оказывают раздражающее действие на глаза и дают другие нежелательные эффекты. Примерно в это же время Ю. Хоудри разработал способ каталитической очистки выхлопных газов путем окисления CO и углеводородов до CO2 и Н2О. В 1970 была сформулирована Декларация о чистом воздухе (уточненная в 1977, расширенная в 1990), согласно которой все новые автомобили, начиная с моделей 1975, должны снабжаться каталитическими нейтрализаторами выхлопных газов. Были установлены нормы для состава выхлопных газов. Поскольку соединения свинца, добавляемые в бензин, отравляют катализаторы, принята программа поэтапного отказа от них. Обращалось внимание и на необходимость снижения содержания оксидов азота.
Специально для автомобильных нейтрализаторов созданы катализаторы, в которых активные компоненты нанесены на керамическую подложку с сотовой структурой, через ячейки которой проходят выхлопные газы. Подложку покрывают тонким слоем оксида металла, например Al2O3, на который наносят катализатор – платину, палладий или родий. Содержание оксидов азота, образующихся при сжигании природных топлив на теплоэлектростанциях, можно уменьшить добавлением в дымовые газы малых количеств аммиака и пропусканием их через титанованадиевый катализатор.
Ферменты. Ферменты – это природные катализаторы, регулирующие биохимические процессы в живой клетке. Они участвуют в процессах энергообмена, расщеплении питательных веществ, реакциях биосинтеза. Без них не могут протекать многие сложные органические реакции. Ферменты функционируют при обычных температуре и давлении, обладают очень высокой селективностью и способны увеличивать скорость реакций на восемь порядков. Несмотря на эти преимущества, лишь ок. 20 из 15 000 известных ферментов применяются в широких масштабах.
Человек тысячелетиями использовал ферменты при выпечке хлеба, получении алкогольных напитков, сыра и уксуса. Сейчас ферменты применяются и в промышленности: при переработке сахара, получении синтетических антибиотиков, аминокислот и белков. Протеолитические ферменты, ускоряющие процессы гидролиза, добавляют в детергенты.
С помощью бактерий Clostridium acetobutylicum Х. Вейцман осуществил ферментативное превращение крахмала в ацетон и бутиловый спирт. Этот способ получения ацетона широко использовался в Англии во время Первой мировой войны, а во время Второй мировой войны с его помощью в СССР изготавливали бутадиеновый каучук.
Исключительно большую роль сыграло применение ферментов, продуцируемых микроорганизмами, для синтеза пенициллина, а также стрептомицина и витамина B12.
Этиловый спирт, получаемый ферментативным путем, широко используют в качестве автомобильного топлива. В Бразилии более трети из примерно 10 млн. автомобилей работают на 96%-ном этиловом спирте, получаемом из сахарного тростника, а остальные – на смеси бензина и этилового спирта (20%). Хорошо отработана технология производства топлива, представляющего собой смесь бензина и спирта, в США. В 1987 из зерен кукурузы было получено ок. 4 млрд. л спирта, из них примерно 3,2 млрд. л было использовано в качестве топлива. Разнообразное применение находят и т.н. иммобилизованные ферменты. Эти ферменты связаны с твердым носителем, например силикагелем, над которым пропускают реагенты. Преимущество этого метода состоит в том, что он обеспечивает эффективное контактирование субстратов с ферментом, разделение продуктов и сохранение фермента. Один из примеров промышленного использования иммобилизованных ферментов – изомеризация D-глюкозы во фруктозу.
Глава 2. Технологические аспекты применения катализаторов
Современные технологии невозможно представить без применения катализаторов. Каталитические реакции могут протекать при температурах до 650С и давлениях 100 атм и более. Это заставляет по-новому решать проблемы, связанные с контактированием между газообразными и твердыми веществами и с переносом частиц катализатора. Чтобы процесс был эффективным, при его моделировании необходимо учитывать кинетические, термодинамические и гидродинамические аспекты. Здесь широко используются компьютерное моделирование, а также новые приборы и методы контроля за технологическими процессами.
В 1960 был достигнут значительный прогресс в производстве аммиака. Применение более активного катализатора позволило понизить температуру получения водорода при разложении водяного пара, благодаря чему удалось понизить давление и, следовательно, уменьшить производственные затраты, например за счет применения более дешевых центробежных компрессоров. В результате стоимость аммиака упала более чем вдвое, произошло колоссальное увеличение его производства, а в связи с этим – увеличение производства пищевых продуктов, поскольку аммиак – ценное удобрение.
Каталитический метод. Этим методом превращают токсичные компоненты промышленных выбросов в вещества безвредные или менее вредные для окружающей среды путем введения в систему дополнительных веществ, называемых катализаторами. Каталитические методы основаны на взаимодействии удаляемых веществ с одним из компонентов, присутствующих в очищаемом газе, или со специально добавляемым в смесь веществом на твердых катализаторах. Действие катализаторов проявляется в промежуточном (поверхностном) химическом взаимодействии катализатора с реагирующими соединениями, в результате которого образуются промежуточные вещества и регенерированный катализатор.
Методы подбора катализаторов отличаются большим разнообразием, но все они базируются в основном на эмпирических или полуэмпирических способах. Об активности катализаторов судят по количеству продукта, получаемого с единицы объема катализатора, или по скорости каталитических процессов, при которых обеспечивается требуемая степень превращения.
Скорость каталитических процессов выражают общепринятым для всех химических реакций уравнением
ωk=kωCа1Cb2 ...,
где С1 С2 и т. д.- концентрации веществ, участвующих в реакции; kω - константа скорости реакции; a, b - порядок реакции по соответствующему компоненту.
Зависимость константы скорости реакции от температуры описывается законом Аррениуса: kω=ze-E/RT, где Т - абсолютная температура; R - газовая постоянная; Е - энергия активации; z - предэкспоненциальный множитель. Величины Е и z - постоянные, характерные для данной химической реакции и катализатора.
В большинстве случаев катализаторами могут быть металлы или их соединения (платина и металлы платинового ряда, оксиды меди и марганца и т. д.). Для осуществления каталитического процесса необходимы незначительные количества катализатора, расположенного таким образом, чтобы обеспечить максимальную поверхность контакта с газовым потоком. Катализаторы обычно выполняются в виде шаров, колец или проволоки, свитой в спираль. Катализатор может состоять из смеси неблагородных металлов с добавкой платины и палладия (сотые доли % к массе катализатора), нанесенных в виде активной пленки на нихромовую проволоку, свитую в спираль.
Объем катализаторной массы определяется исходя из максимальной скорости обезвреживания газа, которая в свою очередь зависит от природы и концентрации вредных веществ в отходящем газе, температуры и давления каталитического процесса и активности катализатора. Допустимая скорость обезвреживания находится в пределах 2000-60000 объемов газа на. объем каталитической массы в час. На катализаторах, разработанных в Дзержинском филиале НИИОГАЗа, при скорости обезвреживания 30000-60000 объемов обезвреживаемого газа на объем катализаторной массы в час и температуре 350-420°С практически полностью окисляются примеси этилена, пропилена, бутана, пропана, ацетальдегида, спиртов (метилового, этилового, пропилового, аллилового и др.), ацетона, этилацстона, бензола, толуола, ксилола, оксида углерода и др.
Существенное влияние на скорость и эффективность каталитического процесса оказывает температура газа. Для каждой реакции, протекающей в потоке газа, характерна так называемая минимальная температура начала реакции, ниже которой катализатор не проявляет активности. Температура начала реакции зависит от природы и концентрации улавливаемых вредностей, скорости потока и типа катализатора. С повышением температуры эффективность каталитического процесса увеличивается. Например, метан начинает окисляться на поверхности катализатора, состоящего из 60% диоксида марганца и 40% оксида меди, только при температуре 320°С, а 97%-ное реагирование наблюдается при t=450°С. Следует, однако, иметь в виду, что для каждого катализатора существует предельный температурный уровень. Повышение этого уровня приводит к снижению активности, а затем к разрушению катализатора.
Для поддержания необходимой температуры газа иногда к нему подмешивают (особенно в пусковой период) продукты сгорания от вспомогательной горелки, работающей на каком-либо высококалорийном топливе. На рис. 1 представлен каталитический реактор, предназначенный для окисления толуола, содержащегося в газовоздушных выбросах цехов окраски. Воздух, содержащий примеси толуола, подогревается в межтрубном пространстве теплообменника - рекуператора 1, откуда по переходным каналам он поступает в подогреватель 4. Продукты сгорания природного газа, сжигаемого в горелках 5, смешиваются с воздухом, повышая его температуру до 250-350°С, т. е. до уровня, обеспечивающего оптимальную скорость окисления толуола на поверхности катализатора. Процесс химического превращения происходит на поверхности катализатора 3, размещенного в контактном устройстве 2. В качестве катализатора применена природная марганцевая руда (пиромзит) в виде гранул размером 2-5 мм, промотированных азотнокислым палладием. В результате окисления толуола образуются нетоксичные продукты: оксид углерода и водяные пары (С7Н8+9О2->7СО2+4Н2О). Смесь воздуха и продуктов реакции при температуре 350-450°С направляется в рекуператор 1, где отдает тепло газовоздушному потоку, идущему на очистку, и затем через выходной патрубок выводится в атмосферу. Эффективность очистки такого реактора составляет 95-98% при расходе вспомогательного топлива (природного газа) 3,5-4,0 м3 на 1000 м3 очищаемого воздуха. Гидравлическое сопротивление реактора при номинальной нагрузке (800-900 м3/ч) не превышает 150-180 Па. Скорость процесса находится в пределах от 8000 до 10000 объемов на объем катализаторной массы в 1 ч.
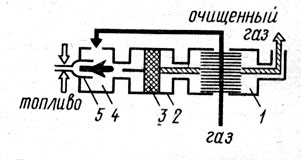
Рис. 1. Каталитический реактор
В последние годы каталитические методы очистки нашли применение для нейтрализации выхлопных газов автомобилей. Для комплексной очистки выхлопных газов - окисления продуктов неполного сгорания и восстановления оксида азота -применяют двухступенчатый каталитический нейтрализатор (рис. 2). Установка состоит из последовательно соединенных восстановительного 2 и окислительного 4 катализаторов. Отработавшие газы через патрубок 1 поступают к восстановительному катализатору 2, на котором происходит нейтрализация оксидов азота по следующим реакциям:
ТЩ+СО-Ю1.2Т2+СЩ2ж ТЩ+Н2-Ю1.2Т2+Н2О
В качестве восстановительного катализатора применяют монельметалл (медноникелевый сплав) или катализатор из благородных металлов (например, платина на глиноземе). При объемной скорости порядка 100000 ч-1эффективность очистки по NO достигает 90% и выше.
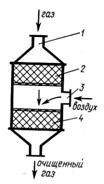
Рис. 2 Двухступенчатый каталитический нейтрализатор
После восстановительного катализатора к отработавшим газам для создания окислительной среды через патрубок 3 подводится вторичный воздух. На окислительном катализаторе происходит нейтрализация продуктов неполного сгорания - оксида углерода и углеводородов:
СО+1.2Щ2-ЮСЩ2ж СчРн+(ч+н.4)Щ2-ЮчСЩ2+1.2Р2Щб
Для окислительных процессов применяют катализатор из благородных металлов или оксидов переходных металлов (медь, никель, хром и др.). Содержание оксида углерода в выхлопных газах автомобиля с нейтрализатором снижается почти в 10 раз, а углеводородов - ~ в 8 раз. Широкому применению каталитических нейтрализаторов препятствуют использование этилированного бензина, который содержит определенное количество свинца. Свинец дезактивирует катализаторы в течение 100-200 ч.
Для расчета каталитического реактора необходимы следующие параметры: объемный расход очищаемого газа Qг, м3/с; состав и концентрация примесей Св, мг/м3; тип катализатора; скорость обезвреживания газа ωк, 1/ч, и рекомендуемая температура перед слоем катализатора ТК. Минимальный объем Vк, м3, катализаторной массы определяют исходя из максимальной скорости обезвреживания газа Vк = Qг/ωк. Толщина слоя катализатора h, м, необходимая для достижения заданной степени очистки η, определяется по формуле
р=Т0ωр.(Ыэфβ)б
где Т0 =дт 1.1-η – число единиц переноса;
ωp=ω0-Tp/T0 1/Пк - скорость газа при рабочих условиях, м/с;
ω0 - линейная скорость потока газа при нормальных условиях (T0=273К и Р=101,3 кПа), отнесенная к полной фильтрующей поверхности (на практике обычно применяют
ω0= 0,5-1 м/с);
Пк - пористость слоя катализатора;
Sэф=Sудkф - эффективная удельная поверхность катализатора, м2/м3; 5удельная наружная поверхность катализатора, м2/м3;
Sуд - коэффициент формы зерна, учитывающий неравнодоступность всей поверхности зерна катализатора обдувающему потоку;
β - коэффициент массопередачи, отнесенный к единице поверхности катализатора, м/с.
Коэффициент массопередачи определяют в зависимости от режима течения газа:
Nuд=0,515Re0,35 Sc0,33 при Re=0,01 ÷ 20;
Nuд=0,725Re0,47 Sc 0,33 при Re=2 ÷ 30;
Nuд=0,395Re0,64 Sc0,33 при Re=30 ÷ 8000,
где Nuд=β dэ/D - диффузионный критерий Нуссельта;
Re=ω рdэ/ν - критерий Рейнольдса;
Sc = ν/D -критерий Шмидта (диффузионный критерий Прандтля);
ν - коэффициент кинематической вязкости газа при рабочих условиях, м2/с;
dэ - эквивалентный диаметр зерна катализатора, м;
D=D0(T/T0)1,8 - коэффициент диффузии улавливаемого газового компонента в воздухе, м2/с;
D0 - коэффициент диффузии при Т0=273 К и р0=101,3 кПа.
В задачу аэродинамического расчета входит определение гидравлического сопротивления слоя катализатора, которое находят по формуле
Δр/h=150(1-Пк)2/П3к μωρ/d2э+1,75 1-Пк/П3к рг ω2ρ/dэ
где μ - коэффициент динамической вязкости газа при рабочих условиях, Н•с/м2.
Термический метод. Достаточно большое развитие в отечественной практике нейтрализации вредных примесей, содержащихся в вентиляционных и других выбросах, имеет высокотемпературное дожигание (термическая нейтрализация). Для осуществления дожигании(реакций окисления) необходимо поддержание высоких температур очищаемого газа и наличие достаточного количества кислорода. Выбор схемы дожигания зависит от температуры и количества выбросов, а также от содержания в них вредных примесей, кислорода и других компонентов. Если выбросные газы имеют высокую температуру, процесс дожигания происходит в камере с подмешиванием свежего воздуха. Так, например, происходит дожигание оксида углерода в газах, удаляемых системой вентиляции от электродуговых плавильных печей, дожигание продуктов неполного сгорания (СО и СХНУ) автомобильного двигателя непосредственно на выходе из цилиндров в условиях добавки избыточного воздуха.
Если температура выбросов недостаточна для протекания окислительных процессов, то в потоке отходящих газов сжигают природный или какой-либо другой высококалорийный газ. Одним из простейших устройств, используемых для огневого обезвреживания технологических и вентиляционных выбросов, является горелка, предназначенная для сжигания природного газа (рис. 3). Обезвреживаемые выбросы в этом случае подаются в канал 1, где они омывают горелку 2. Из коллектора 3 газ, служащий топливом, поступает в сопла, при истечении из которых инжектируется первичный воздух из окружающей среды. Горение смеси газа с первичным воздухом осуществляется в V-образной полости коллектора. Процесс догорания происходит на выходе из полости, где хвостовая часть факела контактирует с обезвреживаемыми выбросами при их истечении из кольцевой щели между корпусом горелки и коллектора.
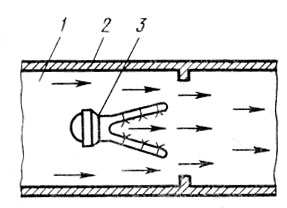
Рис. 3 Установка для огневого обезвреживания технологических и вентиляционных выбросов
Институтом газа АН УССР разработана и успешно прошла промышленные испытания установка очистки газовых выбросов лакокрасочного производства. Установка представляет собой циклонную топку (рис. 4), скомпонованную с газовой горелкой и камерой разбавления газов после их очистки. Воздух, загрязненный токсическими примесями органических веществ (толуол ксилол и др.), поступает в вихревую двух горелку 2 по каналу 6 и непосредственно во внутреннюю полость печи 4 по тангенциальным каналам 5. Природный газ подается в горелку 2 по трубе 3. Время пребывания в полости (не менее 0,5 с) и контакт их с раскаленными стенками камеры обеспечивают полноту их сгорания. Атмосферный воздух подается по центральной трубе 1 горелки 2 только при обезвреживании выбросов, содержащих менее 15% кислорода. Запуск установки, вывод на рабочий режим и его поддержание осуществляются с помощью блока автоматического управления и регулирования установки.
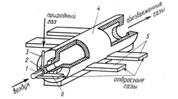
Рис. 4 Установка очистки газообразных выбросов лакокрасочного производства
Системы огневого обезвреживания обеспечивают эффективность очистки 90-99%, если время пребывания вредностей в высокотемпературной зоне не менее 0,5 с и температура обезвреживаемых газов, содержащих углеводороды, не менее 500-650°С, а содержащих оксид углерода - 660-750° С.
катализатор обезвреживание токсичный сточный
Глава 3. Применение катализа для защиты окружающей среды
Универсальность каталитических методов позволяет решать самые сложные проблемы обезвреживания и утилизации антропогенных выбросов промышленных предприятий. Это касается как обезвреживания газовых выбросов, так и очистки сточных вод.
Как разнообразна деятельность человека, так и широк спектр токсичных газов, выбрасываемых при этом в атмосферу, (табл. 1).
Прежде всего, это оксиды азота, которые выбрасываются в атмосферу тепловыми электростанциями, автотранспортом, предприятиями химической промышленности. Аммиак появляется в атмосфере при производстве минеральных удобрений и работе холодильной техники, сероводород — за счет газодобычи и нефтепереработки. Весьма разнообразны источники выбросов органических веществ — нефтехимия, мебельная и лакокрасочная промышленность, машиностроение и многое другое.
Особое внимание сейчас уделяется озонразрушающим газам — диоксиду углерода, закиси азота, метану и фторуглеводородам. Выбросы этих газов ограничены в соответствии с Киотским протоколом. В табл. 2 приведены источники выбросов этих газов и их относительная опасность. В настоящее время стоимость 1 т С02 при международной торговле выбросами составляет около 10 евро, стоимость 1 т N0 превышает 3 тыс. евро. Счетом этого очистка газовых выбросов от метана и закиси азота становится экономически перспективной.
Каталитическая очистка токсичных соединений основана на протекании ряда химических реакций.
Наибольшее промышленное распространение для очистки газов от оксидов азота в присутствии в отходящих газах кислорода имеет процесс их селективного восстановления аммиаком (см. рис. 1, реакция 1).
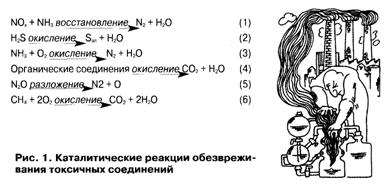
Проблема очистки газов от сероводорода решается путем применения катализатора, позволяющего селективно окислять H2S до элементарной серы (см. 2) — товарного продукта. Очистку газов от аммиака проводят с помощью катализаторов, на которых образуется только молекулярный азот и не появляются оксиды азота (см. 3). Наиболее разнообразными являются органические загрязнители. Их очистка основана на глубоком окислении загрязнителей до углекислого газа и паров воды (см. 4). Очистка газов от N20 осуществляется путем разложения закиси азота на азот и кислород (см. 5) на цеолитных катализаторах. Наконец, для удаления метана предлагается окислять его до С02 и Н20 (см. 6). Учитывая соотношение цен на выбросы метана и углекислого газа (см. табл. 2), это экономически вполне оправданно.
Для очистки газов от органических веществ и оксидов азота широко применяют реверс-процесс [1], который основан на периодических изменениях направлений фильтрации очищаемых газов в слое твердого катализатора. Теплоемкость твердого катализатора в тысячу раз больше теплоемкости газа. Поэтому тепловая волна в слое катализатора движется медленно, а газ движется быстро. Тепло, выделяемое при реакции обезвреживания, сохраняется в слое твердого катализатора. После изменения направления фильтрации газа накопленное тепло служит для разогрева очищаемого газа. Переключение осуществляют через каждые 15-30 мин. Температура на входе в слой катализатора равна температуре очищаемого газа. На выходе температура равна входной плюс величина разогрева за счет реакции. В центре каталитического слоя температура составляет 300-700°С в зависимости от концентрации обезвреживаемых веществ и режима переключения. Таким способом можно обеспечить очистку газов от самых разных веществ. Основное преимущество реверс-процесса — это снижение энергозатрат в 3-5 раз по сравнению с традиционными каталитическими методами. В настоящее время для очистки газов от органических загрязнителей (фенол, метанол, формальдегид, стирол, бутанол, ацетон, синильная кислота, нитрил акриловой кислоты, бензол и др.) на основе реверс-процесса создано и эксплуатируется в России и США более 60 установок производительностью от 0,5 до 30 тыс. м3/ ч. В качестве базовых для этих установок используют российские катализаторы: медно-хромовый ИКТ-12-8 и марганцевый ИКТ-12-40.
Реверс-процесс в России был применен для очистки газов от оксидов азота [1]. Очистка основана на селективном восстановлении оксидов азота аммиаком. Процесс эффективен при переменных концентрациях оксидов азота. Аммиак адсорбируется на катализаторе и служит для восстановления оксидов азота. Степень очистки газов от оксидов азота превышает 99 %. Остаточное содержание оксидов азота в газах меньше 30 мг/м3. Такая установка производительностью 10 — 12 тыс. м3/ч эксплуатируется на ФГУП "Бийский олеумный завод" для очистки отходящих газов производства промышленных взрывчатых веществ после абсорбционных колонн.
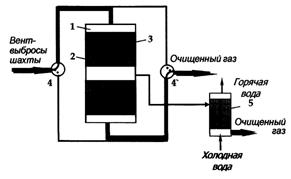
Для очистки газов от сероводорода предложен каталитический способ, основанный на селективном окислении H2S до серы (Пат. 2276097 РФ) [2]. В зависимости от концентрации сероводорода процесс осуществляют либо в адиабатических реакторах (при низких концентрациях 0,01— 5 об. % H2S), либо в реакторах с кипящим слоем катализатора (при высоких концентрациях (5-95 об.% H2S)). Обычно низкие концентрации сероводорода характерны для хвостовых газов процесса Клауса, а высокие концентрации присущи попутным нефтяным газам. В качестве примера на рис. 3 показаны две установки, одна из которых построена на ОАО "Омский НПЗ" для очистки хвостовых газов процесса Клауса (рис. 3, а), а другая — на нефтегазовых промыслах в Татарстане для очистки попутного газа (рис. 3, б). Одним из озон разрушающих газов является метан. Из всех выбросов метана в атмосферу на долю угольных шахт приходится 10%. При добыче угля часть метана извлекается путем дегазации пластов. Эти выбросы содержат метан с концентрацией от 30 до 70%. Такой газ может быть использован в стандартном теплоэнергетическом оборудовании. Однако объем его в выбросах угольных шахт составляет всего 15%. Гораздо сложнее использовать вентиляционные выбросы угольных шахт, которые содержат около 1% метана. Только угольные шахты Кузбасса в России выбрасывают в атмосферу ежегодно около 2 млрд. м3 метана. С целью реализации требований Киотского протокола можно предложить следующие каталитические процессы. Например, для переработки таких вентиляционных газов угольных шахт можно использовать реверс-процесс (рис. 4) [3]. В настоящее время основная проблема заключается в создании первой демонстрационной установки на одной из шахт России.
Еще одним из озонразрушающих газов является закись азота. Содержание N20 в отходящих газах производства адипиновой кислоты достигает 12%. Чаще всего такие газовые выбросы обезвреживают с использованием высокотемпературных термических методов. Основной недостаток таких методов — большой расход топлива. Для осуществления реакции разложения N20 на азот и кислород разработан кобальтцеолитный катализатор. Это позволяет осуществлять процесс обезвреживания без дополнительного расходования топлива только за счет выделяющегося тепла при разложении N20. Экономия топлива (природного газа) составит на одном из заводов Украины после пуска такой каталитической установки около 5 млн м3 в год. Каталитический метод обеспечит остаточное содержание N20 в очищенных газах менее 100 мг/м3 [4].
Для очистки сточных вод от различных токсичных соединений разрабатывается метод, основанный на окислении загрязнителей в жидкой фазе на твердом катализаторе. Процесс проводят при давлении 20 — 30 атм. при температуре 200 — 250С. Вода при таких условиях остается жидкой. Например, такой метод позволяет очищать сточную воду от аммиака с эффективностью до 99%. Продуктами окисления являются только азот и вода. В качестве катализатора служит синтетический пористый углеродный материал. Особенно такой метод эффективен для очистки сточных вод, содержащих много различных загрязнителей. Метод проверен также для очистки сточных вод от соединений, содержащих в своем составе азот или хлор [5].
Для очистки низкоконцентрированных сточных вод от органических загрязнителей разработан адсорбционно-каталитический метод (Пат. 2176618 РФ). Сначала сточные воды пропускают через слой катализатора-адсорбента при нормальной температуре и давлении. Очистка воды происходит за счет сорбции примесей на поверхности твердого материала. Через несколько десятков часов адсорбент требует регенерации. Регенерацию проводят за счет повышения в реакторе температуры и давления. Адсорбированные примеси окисляются в течение примерно 1 ч. После охлаждения адсорбент-катализатор готов для повторного использования.
Данный метод особенно эффективен для очистки небольших по объемам сточных вод — до нескольких м3/ч.
В настоящее время первоочередной задачей для промышленного освоения описанной выше технологии очистки сточных вод является создание пилотной установки локальной очистки промстоков производительностью до 1 м3/ч. Подобная установка потребует загрузки катализатора в объеме 0,5 — 0,6 м3 и обеспечит очистку от широкого круга органических загрязнителей с эффективностью 99 — 99,5 %.
Перспективным направлением развития каталитических технологий является разработка адсорбционно-каталитических процессов.
Сложную задачу обезвреживания газовых выбросов представляет очистка газов, образуемых при авариях (например, от аммиака). Аммиак используют в городах в крупных промышленных холодильных установках. Мы предлагаем совместную разработку установки для очистки газов от аммиака. Первоначально газовые выбросы пропускают через слой адсорбента, где улавливают весь аварийный выброс. После этого небольшим потоком газа проводят десорбцию аммиака и пропускают через каталитический реактор, где проводят очистку. Разделение стадий адсорбции и катализа позволяет создать экономичную и недорогую установку очистки аварийных газовых выбросов.
Подводя итоги рассмотрения современного состояния каталитических технологий защиты окружающей среды, можно констатировать следующее.
1. Для очистки газовых выбросов промышленных производств от органических загрязнителей, NOx, N20, аммиака, оксида углерода и H2S разработаны, опробованы в промышленных условиях современные каталитические методы, которые обеспечиваются изготовлением и комплектной поставкой установок производительностью 0,5 — 30 тыс. м3/ч. Гарантированная степень очистки газовых выбросов на основе каталитических методов составляет 98 — 99,5 %.
2. Действующие установки каталитической очистки газов гарантированно могут быть обеспечены высокоэффективными российскими катализаторами, в том числе не содержащими драгоценные металлы, а российские разработчики и производители катализаторов могут осуществлять разработку регламентов по оптимальным режимам их применения и вести сопровождение эксплуатации катализаторов газоочистки.
3. Созданный в последние годы научно-технический задел позволяет разработать новое поколение промышленных установок обезвреживания сточных вод на основе методов жидкофазного окисления и аппараты для защиты атмосферы от аварийных газовых выбросов, в том числе от аммиака, фенола и других загрязнителей.
Литература
1. Гейтс Б.К. Химия каталитических процессов. М., 1981
2. Боресков Г.К. Катализ. Вопросы теории и практики. Новосибирск, 1987.
3. Ганкин В.Ю., Ганкин Ю.В. Новая общая теория катализа. Л., 1991
4. Токабе К. Катализаторы и каталитические процессы. М., 1993.
5. Матрос Ю.Ш., Носков А.С., Чумаченко В.А. Каталитическое обезвреживание отходящих газов промышленных производств. Новосибирск: Наука, 1991.
6. Исмагилов З.Р., Хайрулин СР., Керженцев М.А. н др. Реактор с кипящим слоем катализатора для процесса прямого окисления сероводорода в элементарную серу. Создание опытно-промышленной установки на Бавлинской УСО // Катализ в промышленности. 2004, специальный выпуск.
7. Кленов О.П., Гогин ЛЛ., Носков А.С. Каталитический метод производства теплоэнергии из низкоконцентрированных газов. Теплоэнергетика. 2000. № 1.
8. Овчинникова Б.В., Чумаченко В.А., Пирютко Л.В. и др. Двухстадийная каталитическая очистка нитрозных газов в производстве адипиновой кислоты // Катализ в промышленности. 2008 (в печати).
9. Dobrynkin N.M., Batygina M.V., Noskov A.S. Solid Catalysts for Wet Oxidation of Nitrogen-Containing Organic Compounds // Catalysis Today. 1998. V. 45. №. 1 - 4.
Перепечатка материалов без ссылки на наш сайт запрещена