Курсовая работа: Строение и энергетические уровни двухатомных молекул
Курсовая работа: Строение и энергетические уровни двухатомных молекул
Министерство образования Республики Беларусь
БЕЛОРУСКИЙ ГОСУДАРСТВЕННЫЙ ПЕДАГОГИЧЕСКИЙ ИНСТИТУТ имени МАКСИМА ТАНКА
КУРСОВАЯ РАБОТА
На тему:
Строение и энергетические уровни двухатомных молекул
Выполнил:
студент физического факультета,
303 группы,
Ващилко Сергей Валерьевич
Руководитель:
Маскевич
Минск 2008
Содержание
Введение
1. Спектры и структура атома водорода
1.1 Атом водорода
1.2 Тонкая структура атома водорода.
2. Структура и спектры молекул
2.1 Вращательные спектры
2.2 Колебательно-вращательные спектры
2.3 Электронные спектры
2.4 Инфракрасные спектры и спектры комбинационного рассеяния
3. Электронные состояния двухатомных молекул
4. Электронные конфигурации для молекул
5. Электрические и оптические свойства молекул
6. Молекулы с одинаковыми ядрами
Заключение
Литература
Введение
Молекула (новолат. molecula, уменьшительное от лат. moles — масса), наименьшая частица вещества, обладающая его химическими свойствами. Молекула состоит из атомов, точнее — из атомных ядер, окружающих их внутренних электронов и внешних валентных электронов. Внутренние электроны атомов обычно не участвуют в образовании химических связей.
Атомы объединяются в молекулы в большинстве случаев химическими связями. Как правило, такая связь создаётся одной, двумя или тремя парами электронов, которыми владеют сообща два атома. Молекула может содержать положительно и отрицательно заряженные атомы, т. е. ионы; в этом случае реализуются электростатические взаимодействия. Помимо указанных, в молекуле существуют и более слабые взаимодействия между атомами. Между валентно не связанными атомами действуют силы отталкивания.
Каждый атом и молекула имеют уникальное строение, которому соответствует свой уникальный спектр.
Структура спектра атома, молекулы или образованной ими макросистемы определяется их энергетическими уровнями. Согласно законам квантовой механики, каждый энергетический уровень соответствует определенному квантовому состоянию. Электроны и ядра в таком состоянии совершают характерные периодические движения, для которых энергия, орбитальный момент количества движения и другие физические величины строго определены и квантованы, т.е. принимают лишь разрешенные дискретные значения, соответствующие целым и полуцелым значениям квантовых чисел. Если известны силы, связывающие электроны и ядра в единую систему, то по законам квантовой механики можно рассчитать ее уровни энергии и квантовые числа, а также предсказать интенсивности и частоты спектральных линий.
В атоме наиболее сильное взаимодействие между ядром и электронами обусловлено электростатическими, или кулоновскими силами. Каждый электрон притягивается к ядру и отталкивается всеми остальными электронами. Это взаимодействие определяет структуру энергетических уровней электронов. Внешние (валентные) электроны, переходя с уровня на уровень, испускают или поглощают излучение в ближней инфракрасной, видимой и ультрафиолетовой областях. Энергии переходов между уровнями внутренних оболочек соответствуют вакуумной ультрафиолетовой и рентгеновской областям спектра. Более слабым является воздействие электрического поля на магнитные моменты электронов. Это приводит к расщеплению электронных уровней энергии и, соответственно, каждой спектральной линии на компоненты (тонкая структура). Кроме того, ядро, обладающее ядерным моментом, может взаимодействовать с электрическим полем орбитальных электронов, вызывая дополнительное сверхтонкое расщепление уровней энергии.
1. Спектры и структура атома водорода
1.1 Атом водорода
С точки зрения квантовой механики атом водорода и любой водородоподобный ион (например, He++ и др.) представляют собой простейшую систему, состоящую из одного электрона с массой m и зарядом e, который движется в кулоновском поле ядра, имеющего массу М и заряд +Ze (Z – порядковый номер элемента). Если учитывать только электростатическое взаимодействие, то потенциальная энергия атома равна Ze2/r, и гамильтониан будет иметь вид H = p2/2 Ze2/r, где = тМ/(m + M) m. В дифференциальной форме оператор p2 равен ћ 22, где ћ = h /2. Таким образом, уравнение Шрёдингера принимает вид
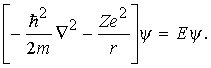
Решение этого уравнения определяет энергии стационарных состояний (Е < 0) водоподобного атома:
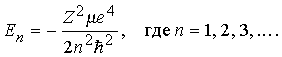
Так как m/M 1/2000 и близко к m, то
En = –RZ2/n2.
где R – постоянная Ридберга, равная R me4/2ћ2 13,6 эВ (или 109678 см1); в рентгеновской спектроскопии ридберг часто используется в качестве единицы энергии. Квантовые состояния атома определяются квантовыми числами n, l и ml . Главное квантовое число п принимает целые значения 1, 2, 3 ... . Азимутальное квантовое число l определяет величину момента количества движения электрона относительно ядра (орбитальный момент); при данном п оно может принимать значения l = 0, 1, 2, ..., п 1. Квадрат орбитального момента равен l(l + l) ћ2. Квантовое число ml определяет величину проекции орбитального момента на заданное направление, оно может принимать значения ml = 0, 1, 2, ..., l. Сама проекция орбитального момента равна ml ћ. Значения l = 0, 1, 2, 3, 4, ... принято обозначать буквами s, p, d, f, g, ... . Следовательно, уровень 2р водорода имеет квантовые числа п = 2 и l = 1.
Спектральные переходы могут происходить отнюдь не между всеми парами уровней энергии. Электрические дипольные переходы, сопровождающиеся наиболее сильными спектральными проявлениями, имеют место лишь при выполнении определенных условий (правил отбора). Переходы, которые удовлетворяют правилам отбора, называются разрешенными, вероятность остальных переходов значительно меньше, они трудны для наблюдения и считаются запрещенными.
В атоме водорода переходы между состояниями пlml и пlml возможны в том случае, если число l изменяется на единицу, а число ml остается постоянным или изменяется на единицу. Таким образом, правила отбора можно записать:
l = l – l = 1, ml = ml = 0, 1.
Для чисел п и п правил отбора не существует.
При квантовом переходе между двумя уровнями с энергиями En и En атом испускает или поглощает фотон, энергия которого равна Е = En En. Поскольку частота фотона = Е/h, частоты спектральных линий атома водорода (Z = 1) определяются формулой
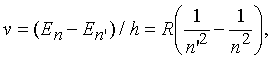
а соответствующая длина волны равна = с/. При значениях п = 2, п = 3, 4, 5, ... частоты линий в эмиссионном спектре водорода соответствуют серии Бальмера (видимый свет и ближняя ультрафиолетовая область) и хорошо согласуются с эмпирической формулой Бальмера n = 364,56 n2/(n2 4) нм. Из сравнения этих двух выражений можно определить значение R. Спектроскопические исследования атомарного водорода – прекрасный пример теории и эксперимента, внесших огромный вклад в фундаментальную науку.
1.2 Тонкая структура атома водорода
Рассмотренная
выше релятивистская квантово механическая теория уровней в основном
подтверждалась анализом атомных спектров, однако не объясняла расщепление и
тонкую структуру энергетических уровней атома водорода. Объяснить тонкую
структуру уровней атомарного водорода позволил учет двух специфических
релятивистских эффектов: спин-орбитального взаимодействия и зависимости массы
электрона от скорости. Концепция спина электрона, первоначально возникшая из
анализа экспериментальных данных, получила теоретическое обоснование в
разработанной П.Дираком релятивистской теории, из которой следовало, что
электрон обладает собственным моментом количества движения, или спином, ![]() и соответствующим
магнитным моментом
и соответствующим
магнитным моментом ![]() . Спиновое квантовое число s равно
1/2, а проекция спина на фиксированную ось принимает значения ms
= ±1/2. Электрон, двигаясь по орбите в радиальном электрическом поле
ядра, создает магнитное поле. Взаимодействие собственного магнитного момента
электрона с этим полем называется спин-орбитальным взаимодействием.
. Спиновое квантовое число s равно
1/2, а проекция спина на фиксированную ось принимает значения ms
= ±1/2. Электрон, двигаясь по орбите в радиальном электрическом поле
ядра, создает магнитное поле. Взаимодействие собственного магнитного момента
электрона с этим полем называется спин-орбитальным взаимодействием.
Дополнительный вклад в тонкую структуру дает релятивистская поправка к кинетической энергии, возникающая благодаря высокой орбитальной скорости электрона. Этот эффект был впервые обнаружен Н.Бором и А.Зоммерфельдом, которые показали, что релятивистское изменение массы электрона должно вызывать прецессию его орбиты.
Учет спин-орбитального взаимодействия и релятивистской поправки к массе электрона дает следующее выражение для энергии тонкого расщепления уровней:
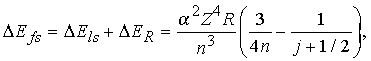
где
= e2/ћc 1/137. Полный угловой момент
электрона ![]() равен
равен
![]() + s.
Для данного значения l квантовое число j принимает положительные
значения j = l s (j = 1/2 для l =
0). Согласно спектроскопической номенклатуре состояние с квантовыми числами n,
l, s, j обозначается как n2s + llj.
Это значит, что 2p уровень водорода с n = 2 и j
= 3/2 запишется в виде 22p3/2. Величина 2s +
1 называется мультиплетностью; она показывает число состояний, связанных с
данным значением s. Заметим, что энергия расщепления уровня при данном n
зависит только от j, но не от l или s в отдельности. Таким
образом, согласно вышеприведенной формуле 22s1/2 и
22p1/2 уровни тонкой структуры вырождены по
энергии. Подобным образом вырождены и уровни 32p3/2
и 32d3/2. Эти результаты согласуются с выводами
теории Дирака, если пренебречь членами Z более высокого порядка.
Разрешенные переходы определяются правилами отбора по j: j
= 0, 1 (исключая j = 0 0).
+ s.
Для данного значения l квантовое число j принимает положительные
значения j = l s (j = 1/2 для l =
0). Согласно спектроскопической номенклатуре состояние с квантовыми числами n,
l, s, j обозначается как n2s + llj.
Это значит, что 2p уровень водорода с n = 2 и j
= 3/2 запишется в виде 22p3/2. Величина 2s +
1 называется мультиплетностью; она показывает число состояний, связанных с
данным значением s. Заметим, что энергия расщепления уровня при данном n
зависит только от j, но не от l или s в отдельности. Таким
образом, согласно вышеприведенной формуле 22s1/2 и
22p1/2 уровни тонкой структуры вырождены по
энергии. Подобным образом вырождены и уровни 32p3/2
и 32d3/2. Эти результаты согласуются с выводами
теории Дирака, если пренебречь членами Z более высокого порядка.
Разрешенные переходы определяются правилами отбора по j: j
= 0, 1 (исключая j = 0 0).
2. Структура и спектры молекул
Молекулярные спектры гораздо сложнее и разнообразнее атомных. Это обусловлено тем, что в молекулах имеются дополнительные степени свободы и наряду с движением электронов вокруг ядер атомов, образующих молекулу, происходят колебания самих ядер относительно равновесного положения, а также вращение молекулы как целого. Ядра в молекуле образуют линейную, плоскую или трехмерную конфигурацию. Плоская и трехмерная молекулы, состоящие из N атомов, обладают 3N–6 колебательными и тремя вращательными степенями свободы, а линейная – 3N–5 колебательными и двумя вращательными степенями свободы. Таким образом, молекула кроме электронной энергии имеет колебательную и вращательную внутренние энергии, а также новые системы уровней.
2.1 Вращательные спектры
Двухатомную молекулу можно упрощенно рассматривать как жесткий ротатор с моментом инерции I. Решение уравнения Шрёдингера для жесткого ротатора дает следующие разрешенные уровни энергии:
![]()
где J – квантовое число, характеризующее вращательный момент количества движения молекулы. Правило отбора для разрешенных переходов таково: DJ = ±1. Следовательно, чисто вращательный спектр состоит из ряда эквидистантных линий с частотами
![]()
Вращательные спектры многоатомных молекул имеют сходную структуру.
2.2 Колебательно-вращательные спектры
В
действительности молекулярные связи не являются жесткими. В простейшем
приближении движение ядер двухатомной молекулы можно рассматривать как
колебания частиц с приведенной массой m относительно положения
равновесия в потенциальной яме с гармоническим потенциалом. Если гармонический
потенциал имеет вид V(x) = kx2/2, где x
– отклонение межъядерного расстояния от равновесного, а k – коэффициент
упругости, то решение уравнение Шрёдингера дает следующие возможные уровни
энергии: Еv = hn (v+1/2). Здесь n – частота
колебаний, определяемая формулой ![]() , а v – колебательное
квантовое число, принимающее значения v = 1, 2, 3 ... .
Правило отбора для разрешенных (инфракрасных) переходов: Dv = ±1. Таким
образом, для колебательных переходов существует единственная частота n .
Но поскольку в молекуле одновременно происходят колебания и вращение, возникает
колебательно-вращательный спектр, в котором на колебательную частоту молекулы
налагается «гребенка» вращательных линий.
, а v – колебательное
квантовое число, принимающее значения v = 1, 2, 3 ... .
Правило отбора для разрешенных (инфракрасных) переходов: Dv = ±1. Таким
образом, для колебательных переходов существует единственная частота n .
Но поскольку в молекуле одновременно происходят колебания и вращение, возникает
колебательно-вращательный спектр, в котором на колебательную частоту молекулы
налагается «гребенка» вращательных линий.
2.3 Электронные спектры
У молекул имеется большое число возбужденных электронных уровней, переходы между которыми сопровождаются изменением колебательной и вращательной энергии. В результате этого структура электронных спектров молекул существенно усложняется, поскольку: 1) электронные переходы часто перекрываются; 2) не соблюдается правило отбора для колебательных переходов (отсутствует ограничение по Dv); 3) сохраняется правило отбора DJ = 0, ±1 для разрешенных вращательных переходов. Электронный спектр представляет собой серию колебательных полос, каждая из которых содержит десятки или сотни вращательных линий. Как правило, в молекулярных спектрах наблюдаются несколько электронных переходов в близкой инфракрасной, видимой и ультрафиолетовой областях. Например, в спектре молекулы йода (J2) имеется около 30 электронных переходов.
С появлением лазеров исследование электронных спектров молекул, вышло на новый уровень. Перестраиваемое в широких пределах интенсивное лазерное излучение используется в спектроскопии высокого разрешения для точного определения молекулярных констант и потенциальных поверхностей.
2.4 Инфракрасные спектры и спектры комбинационного рассеяния
Молекулярные спектры поглощения обусловлены электрическими дипольными переходами. Электрический диполь – это совокупность двух точечных электрических зарядов, равных по величине, противоположных по знаку и находящихся на некотором расстоянии друг от друга. Произведение положительного заряда на расстояние между зарядами называется электрическим дипольным моментом. Чем больше дипольный момент, тем сильнее система может поглощать и излучать электромагнитную энергию. У полярных молекул, таких, как HBr, имеющих большой дипольный момент и сильно поглощающих на соответствующих частотах, наблюдаются колебательно-вращательные спектры. С другой стороны, неполярные молекулы, такие, как Н2, О2 и N2, не имеют постоянного дипольного момента, и, следовательно, не могут при вращении излучать или поглощать электромагнитную энергию, поэтому у них отсутствуют вращательные спектры. К тому же колебания таких молекул столь симметричны, что не приводят к появлению дипольного момента. Этим обусловлено отсутствие у них инфракрасного колебательного спектра.
Важным спектроскопическим методом исследования структуры молекул является изучение рассеяния света. Рассеяние света – это процесс, в котором под действием падающего света в атоме или молекуле возбуждаются колебания дипольного момента, сопровождающиеся излучением полученной энергии. Переизлучение происходит в основном на частоте падающего света (упругое рассеяние), но может наблюдаться слабое неупругое рассеяние на смещенных (комбинационных) частотах. Упругое рассеяние называется рэлеевским, а неупругое – рамановским или комбинационным. Линии, соответствующие комбинационному рассеянию, смещены относительно линии падающего света на частоту молекулярных колебаний рассеивающего образца. Поскольку молекула может еще и вращаться, на частоту смещения налагаются вращательные частоты.
3. Электронные состояния двухатомных молекул
Изложить кратко и в то же время точно теорию электронной структуры молекул нелегко. Поэтому мы по-прежнему ограничимся формулировкой основных понятий, определений и правил. Следуя трактовке Гунда, электронные термы двухатомных молекул подобны термам „соединенного" атома, возникающим при совмещении обоих ядер молекулы в сильном электрическом поле, направленном вдоль линии, соединяющей ядра. Для соединенного атома в случае связи Рэссел-Саундерса сильное электрическое поле приведет к результирующему орбитальному моменту электронов, определяемому квантовым числом L. Этот момент ориентируется по отношению к полю так, что энергия определяется квантовым числом МL, которое принимает значения L, L—1, L —2, ... — L. Отсюда следует, что в пренебрежении взаимодействием с молекулярным вращением, как и в случае эффекта Штарка, термы с равными и имеющими противоположные знаки значениями МL имеют одну и ту же энергию. Поэтому МL фактически принимает лишь значения L, L—1,L —2, ....,0, причем термы с МL>0 состоят из двух совпадающих термов с одной и той же энергией. Для молекулы квантовое число МL заменяется квантовым числом Λ. Оно является самым важным при определении типа молекулярного состояния и аналогично атомному азимутальному квантовому числу L, но не тождественно ему. Подобно тому как атомные состояния с L = 0, 1, 2, 3 и т. д. обозначаются S, Р, D, F и т. д., молекулярные термы с Λ = 0, 1, 2, 3 и т. д. обозначаются соответствующими заглавными греческими буквами Σ, Π, Δ, Φ и т. д. Результирующий спин S соединенного атома расщепляется полем на компоненты с Ms = S, S — 1, S —2, . .. , —S.
Для молекулы это квантовое число Ms заменяется квантовым числом Σ. Мультиплетность снова, как и в случае атомов, равна 2S+1. Это есть число подуровней, на которые терм может быть расщеплен благодаря спину.
Подобно связи Рэссел-Саундерса для атома, в молекуле квантовое число Λ, являющееся результирующим электронным (орбитальным) моментом относительно оси ядер, и квантовое число компоненты спина S относительно той же оси комбинируют между собой (в этом случае путем простого сложения), образуя результирующее квантовое число. Оно обозначается Ω, аналогично атомному J, и принимает значение Ω=Λ+Σ . Продолжая формальную аналогию с термами атомного типа, отмечают мультиплетность, равную 2S+1, числом, расположенным сверху слева от греческой буквы, обозначающей величину Λ, тогда как значение Σ пишется снизу справа от той же буквы. Например, символ 3П2 обозначает молекулярное состояние, для которого мультиплетность равна трем (триплет, спин S=1), Λ=1 и Ω= 2, следовательно, Σ = +1).
Для атомных термов полная мультиплетность фактически реализуется только в том случае, когда L больше или равно S. Для молекул при Λ= 0 (т. е. для Σ-состояний) терм тоже будет одиночным, если пренебречь вращением. Но фактически имеет место малое расщепление, вызванное взаимодействием с вращением молекулы. Для других молекулярных термов мультиплетность реализуется полностью. Состояния с мультиплетностью, превышающей триплетную, встречаются редко, но даже в том случае, когда S превосходит Λ, полная мультиплетность все-таки обнаруживается.
4. Электронные конфигурации для молекул
В упрощенной модели „соединенного" атома, мы имеем возможность приписать каждому электрону четыре квантовых числа: n — главное квантовое число, принимающее целые значения 0,1,...; l — азимутальное квантовое число, определяющее орбитальный момент электрона и принимающее значения 0, 1, …, n-1; λ — квантовое число, определяющее проекцию орбитального момента на ось молекулы и принимающее значения 0,1,…, l; наконец, спин электрона, равный +1/2 и -1/2. В случае атома электрон обозначается численным значением n и буквами s, p, d, f и т. д., указывающими соответственно на значения l = 0, 1, 2, 3, ... Продолжая формальную аналогию с атомом, электроны в молекулах при значениях λ = 0 1, 2, 3,... обозначают соответственно малыми греческими буквами ρ, π, δ и т. д. К этим квантовым числам снова применим принцип Паули. В молекулах мы имеем заполненные λ-или l-субоболочки, для которых результирующие орбитальный и спиновой моменты равны нулю. Соотношения между электронными конфигурациями соединенного атома и соответствующей молекулы приводятся ниже. Количество электронов в субоболочке по-прежнему обозначается числом, которое пишут сверху после других символов.
| Соединенный атом |
1s2 |
2s2 |
2p6 |
3s2 |
3p6 |
3d10 |
| Молекула |
1sσ2 |
2sσ2 |
2pσ22pπ4 |
3sσ2 |
3pσ23pπ4 |
3dσ23dπ43dδ4 |
Модель „соединенного" атома подвержена, однако, с многими ограничениями. Мэлликен рассмотрел различные возможные способы обозначения электронных конфигураций в молекулах. Часто желательно рассматривать внутренние электроны атомов, образующих молекулу, как остающиеся при своих атомах, а не как находящиеся на молекулярных орбитах. Тогда оказывается затруднительным приписать определенные главные квантовые числа внешним электронам. Мэлликен рассмотрел связывающие и разрыхляющие свойства молекулярных орбит различных типов и ввел в употребление буквы z, у, x, обозначающие электроны в порядке убывания их связывающих свойств.
5. Электрические и оптические свойства молекул
Поведение вещества в электрическом поле определяется основными электрическими характеристиками молекулы — постоянным дипольным моментом и поляризуемостью. Дипольный момент означает несовпадение центров тяжести положительных и отрицательных зарядов в молекуле, т. е. электрическую асимметрию молекулы Соответственно молекулы, имеющие центр симметрии, например H2, лишены постоянного дипольного момента; напротив, в HCl электроны смещены к атому Cl и дипольный момент равен 1,03 D (1,03×10-18 ед. СГС). Поляризуемостью характеризуется способность электронной оболочки любой молекулы смещаться под действием электрического поля, в результате чего в молекуле создаётся индуцированный дипольный момент. Значения дипольного момента и поляризуемости находят экспериментально с помощью измерений диэлектрической проницаемости. В случае аддитивности свойств молекул дипольный момент может быть представлен суммой дипольных моментов связей (с учётом их направления), то же относится к поляризуемости молекулы.
Оптические свойства вещества характеризуют его поведение в переменном электрическом поле световой волны — тем самым они определяются поляризуемостью молекулярного вещества. С поляризуемостью непосредственно связаны преломление и рассеяние света, оптическая активность и другие явления, изучаемые молекулярной оптикой.
6. Молекулы с одинаковыми ядрами
Молекулы с одинаковыми ядрами, например такие, как Н2, 03, N3, обладают дополнительными свойствами симметрии, существующими благодаря равенству зарядов обоих ядер. Поэтому возникает необходимость провести дальнейшее подразделение электронных состояний по следующему признаку: электронная волновая функция остается неизменной или меняет знак при отражении в центре симметрии. В первом случае состояния снабжаются индексом g, во втором случае—индексом u.
Любой энергетический уровень двухатомной молекулы является симметричным (s) или антисимметричным (а) в зависимости от того, остается неизменной или меняет знак полная волновая функция при перестановке обоих ядер. Можно показать, что для любого электронного состояния молекулы с одинаковыми ядрами все положительные уровни (+) являются симметричными (s), а все отрицательные (-) антисимметричными (а) или наоборот. Таким образом, симметрия a или s вращательных уровней оказывается снова чередующейся в зависимости от того, четным или нечетным является вращательное квантовое число К. Было найдено также, что состояния с симметрией a и s имеют различные статистические веса, причем отношения этих весов является функцией спина ядра. Поэтому чередующиеся вращательные уровни, а следовательно, и чередующиеся линии в ветвях полос обнаруживают чередующиеся интенсивности. Так, например, в случае азота со спином ядра, равным единице (N14), линии чередуются с отношением интенсивностей 1:2, тогда как для водорода со спином ядра, равным 1/2, это отношение равно 1:3. При спине ядра, равном нулю, как в 02 и Не3, имеется один ряд уровней со статистическим весом, равным нулю. В этом случае чередующиеся линии в ветвях полностью отсутствуют.
Заключение
Электрические, оптические, магнитные и другие свойства молекулы в конечном счёте связаны с волновыми функциями и энергиями различных состояний молекул; через них выражаются и электрический дипольный момент, и магнитный момент, и поляризуемость, и магнитная восприимчивость. Прямую информацию о состояниях молекулы и вероятностях перехода между ними дают молекулярные спектры.
Частоты в спектрах, соответствующих вращательным переходам, зависят от моментов инерции молекулы, определение которых из спектроскопических данных позволяет получить наиболее точные значения межатомных расстояний.
Общее число линий или полос в колебательном спектре молекулы зависит от её симметрии. Частоты колебаний, наблюдаемые в спектрах, определяются, с одной стороны, массами атомов и их расположением, с другой — динамикой межатомных взаимодействий. Теория колебаний многоатомных молекул соответственно опирается на теорию химического строения и классическую механику связанных колебаний. Исследование колебательных спектров позволяет сделать ряд выводов о строении М., о межатомных и межмолекулярных взаимодействиях, изучать явления таутомерии, поворотной изомерии.
Электронные переходы в молекуле характеризуют структуру их электронных оболочек, состояние химических связей. Спектры молекул, обладающих большим числом сопряжённых связей, характеризуются длинноволновыми полосами поглощения, попадающими в видимую область. Изучение электронно-колебательных спектров молекулы необходимо для понимания естественной и магнитной оптической активности.
Литература
1. Зайдель А.Н., Островская Г.В., Островский Ю.И. Техника и практика спектроскопии. М., 1972
2. Гейдон А.И. Энергия диссоциации и спектры двухатомных молекул
3. Герцберг, Герхард. Спектры и строение двухатомных молекул – New York, 1915.
4. Летохов В.С., Чеботарев В.П. Принципы нелинейной лазерной спектроскопии. М., 1975
5. Собелман И.И. Введение в теорию атомных спектров – ФМГ, 1967.
6. Фрим С.Э. Оптические спектры атомов – ФМГ, 1963.
7. http://gatchina3000.ru/great-soviet-encyclopedia.
Перепечатка материалов без ссылки на наш сайт запрещена