Реферат: Разработка методов биотехнологического получения белков, аминокислот и нуклеозидов, меченных дейтерием и изотопом углерода 13С с высокими степенями изотопного обогащения
Реферат: Разработка методов биотехнологического получения белков, аминокислот и нуклеозидов, меченных дейтерием и изотопом углерода 13С с высокими степенями изотопного обогащения
На правах рукописи
МОСИН ОЛЕГ ВИКТОРОВИЧ
РАЗРАБОТКА МЕТОДОВ БИОТЕХНОЛОГИЧЕСКОГО
ПОЛУЧЕНИЯ БЕЛКОВ, АМИНОКИСЛОТ И
НУКЛЕОЗИДОВ, МЕЧЕННЫХ 2Н (D) И 13С, С
ВЫСОКИМИ СТЕПЕНЯМИ ИЗОТОПНОГО
ОБОГАЩЕНИЯ.
03.00.23-Биотехнология
Автореферат
диссертации на соискание учёной степени кандидата химических наук
Москва
Работа выполнена на кафедре биотехнологии Московской ордена Трудового Красного Знамени Государственной академии тонкой химической технологии им. М.В. Ломоносова.
Научные руководители:
доктор химических наук, профессор, член корреспондент РАМН, В. И. ШВЕЦ, кандидат биологических наук, старший научный сотрудник Д. А. СКЛАДНЕЕ.
Официальные оппоненты:
доктор химических наук, профессор Н. Ф. МЯСОЕДОВ.
кандидат химических наук, ведущий научный сотрудник Б. М. ПОЛАНУЕР.
Ведущая организация:
Государственный научно-исследовательский институт биосинтеза белковых веществ "ГОСНИИСИНТЕЗБЕЛОК".
Защита диссертации состоялась 24 мая 1996 г в 15.00 на
заседании Диссертационного совета Д 063. 41. 01 в Московской Государственной академии тонкой химической технологии им. М. В. Ломоносова по адресу: 1S7571, Москва, пр-т Вернадского, дом 86.
С диссертацией можно ознакомиться в библиотеке Московской Государственной академии тонкой химической технологии им. М. В. Ломоносова по адресу: 119831, Москва, ул. Малая Пироговская, дом 1.
Автореферат разослан . апреля 1996 г
Учёный секретарь Диссертационного Совета,
Кандидат
химических наук, старший научный сотрудник А. И. ЛЮТИК
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ.
Актуальность работы. В настоящее время во всем мире растет интерес к природным соединениям, меченным стабильными изотопами, в частности дейтерием 2Н (D) и углеродом |3С, которые незаменимы для разнопрофильных биохимических и диагностических целей, структурно-функциональных исследований, а также для изучения клеточного метаболизма разнообразных биологически активных соединений (БАС) с использованием стабильных изотопов. Тенденции к применению стабильных изотопов по сравнению с их радиоактивными аналогами обусловлены отсутствием радиационной опасности и возможностью определения локализации метки в молекуле методами высокого разрешения: спектроскопией ядерного магнитного резонанса (ЯМР), инфракрасной и лазерной спектроскопией, масс-спектрометрией. Развитие этих методов за последние годы позволило усовершенствовать проведение многочисленных биологических исследований de novo, а также изучать структуру и механизм действия клеточных БАС на молекулярном уровне. Зачастую для данных исследований необходимо, чтобы синтезируемые БАС имели как можно более высокие степени изотопного обогащения.
Именно поэтому разработка путей биосинтетического получения БАС с высокими степенями изотопного обогащения является очень актуальной задачей для современной биотехнологии и отечественной микробиологической промышленности. С развитием новых биотехнологических подходов появилась возможность получать разнообразные стабильно меченные соединения за счёт биологической конверсии дейтерированных субстратов дейтерометанола и тяжёлой воды CD3OD/D2O в генетически сконструированных штаммах бактерий. Однако подобные процессы редко применяются в биотехнологии из-за наличия ряда трудностей, связанных с клеточной адаптацией к тяжёлой воде (D2O). Явление адаптации к тяжёлой воде интересно не только с научной точки зрения, но оно также позволяет получать уникальный биологический материал, очень удобный для решения задач молекулярной организации клетки с помощью метода ЯМР-спектроскопии. Эти данные послужили основой для выбора объектов исследования в наших экспериментах. Ими являлись генетически маркированные штаммы-продуценты аминокислот, белков и нуклеозидов, относящиеся к различным таксономическим родам микроорганизмов: факультативные метилотрофные бактерии Brevibacterium meihylicurn, облигатные метилотрофные бактерии Methylobactllusflagettatum, галофильные бактерии Halobacterium halobium и бациллы Bacillus subtilis и Bacillus amyloliquefaciens.
Настоящая работа выполнена на кафедре биотехнологии МГАТХТ им. М.В. Ломоносова в рамках научно-технической программы "Наукоёмкие химические технологии ".
Целью данной работы была разработка методов биотехнологического получения аминокислот, белков и нуклеозидов, меченных дейтерием и изотопом углерода 13С с высокими степенями изотопного обогащения.
Поскольку биосинтетический потенциал исследуемых штаммов за счёт конверсии тяжёлой воды к началу проведения данной работы был изучен недостаточно, представляло интерес исследование принципиальной возможности их адаптации к росту на средах содержащих тяжёлую воду для синтеза меченных целевых продуктов. Для этого были применены специальные биотехнологические подходы по получению меченных БАС, что позволило подойти к реализации комплексного использования химических компонентов биомассы полученных штаммов-продуцентов и созданию новых безотходных микробиологических производств по получению изотопно-меченных БАС на их основе.
Научная новизна работы заключается в следующих аспектах:
1. Предложен метод получения штаммов-продуцентов БАС, устойчивых к максимальным концентрациям тяжёлой воды в ростовой среде.
2. Показана перспективность использования суммарных химических компонентов биомассы метилотрофных бактерий Brevibacterium methylicum, полученных в результате многоступенчатой адаптации к тяжёлой воде для биосинтеза дейтерий-меченных аминокислот, белков и нуклеозидов.
3. Разработаны методы получения изотопно-меченных БАС, основанные на
использовании высокоактивных
штаммов-продуцентов, адаптированных к росту и биосинтезу на средах с высокими концентрациями тяжёлой воды. Получены с
высокими
выходами индивидуальные дейтерий- и
углерод-меченные |3С - аминокислоты (степени изотопноговключения составляют до 97,5%),
[1,3',4',2,8-D5]-инозин (степень включения
дейтерия
62,5%) и дейтерий-меченный бактериородопсин с селективным и униформным характером
включения метки.
4. Разработаны
общие принципы масс-спектрометрического анализа степеней изотопного обогащения мультикомпонентных
смесей аминокислот при данном
способе введения метки за счёт применения прямой обработки
(дериватизации) культуральной жидкости и белковых
гидролизатов
дансилхлоридом/карбобензоксихлоридом
и диазометаном.
Практическая значимость: Полученные в работе результаты могут быть использованы для создания новых безотходных производств по синтезу изотопно-меченных БАС. В частности, основанных на использовании биологической конверсии дешёвых меченных низкомолекулярных субстратов в дорогостоящие клеточные БАС.
На способ получения униформно-меченного дейтерием L-Phe имеется положительное решение ВНИИГПЭ о выдаче авторского свидетельства № 055610 от 17.11.1995 г на заявку № 930558240 от 15.12.1993 г. На способ получения [1, 2',41,2,8-D5]-инозина оформлена заявка № 95118778 от 14.11.1995 г.
Положения, выносимые на защиту:
1. Подбор условий получения биомассы штамма факультативных метилотрофных бактерий Brevibacterium methylicum с униформным характером обогащения клеточных БАС дейтерием. Использование гидролизатов дейтеро-биомассы данного штамма для биосинтеза дейтсрий-меченного инозина и бактериородопсина.
2. Методы получения дейтерий- и 13С -аминокислот, [1',3',4'D,8-инозина и бактериородопсина за счёт биологической конверсии дейтерометанола/13С метанола СDзОD/13СНзОН и тяжёлой воды D2O.
3. Метод прямой химической модификации препаратов интактных культуральных жидкостей дансиллхлоридом/карбобензоксихлоридом и диазометаном. Применение данного метода для масс-спектрометрического анализа степеней изотопного обогащения молекул аминокислот в составе мультикомпонентных смесей при данном способе введения метки.
Апробация. Материалы диссертационной работы докладывались и обсуждались на 3-м международном конгрессе по аминокислотам, пептидам и их аналогам (Вена, август, 1993), на 4-й Всероссийской научной конференции "Проблемы теоретической и экспериментальной химии"(Екатеринбург, апрель, 1994), 6-й международной конференции по ретинальным белкам (Ляйден, июнь, 1994), 7-м международном симпозиуме по генетике промышленных штаммов микроорганизмов (Монреаль, июль, 1994), 8-м международном симпозиуме по микробному росту на Ci-соединениях (Сан-Диего, август, 1995), Евроазийском симпозиуме по современным направлениям в биотехнологии (Анкара, ноябрь, 1995).
Публикации. По материалам диссертационной работы опубликовано восемь печатных работ и шесть тезисов научных конференций.
Структура работы. Диссертация состоит из введения, обзора литературы, экспериментальной части, результатов, выводов. Работа изложена на 120 страницах машинописного текста, содержит 17 рисунков и 15 таблиц.
МАТЕРИАЛЫ И МЕТОДЫ
Бактериальные штаммы и питательные среды.
Исследования проводили с генетически маркированными штаммами-продуцентами аминокислот, белков и нуклеозидов:
Штамм №l. - Brevibacterium methylicum ВКПМ В 5652 (leu), штамм факультативных метилотрофных бактерий, продуцент L-фенилаланина.
Штамм №2. - Methylobacillus flagellatum КТ (ile), штамм облигатных метилотрофных бактерий, продуцент L-лейцина.
Штамм №3. - Bacillus subtilis (his, tyr, ade, иrа), штамм граммотрицательиых бактерий, продуцент инозина.
Штамм №4. - Bacillus amyloliquefacien ade, иrа), штамм грамм отрицательных бактерий, продуцент тимидина.
Штамм №5. - Halobacterium halobium ET 1001, пигментсодержащий штамм галофильных бактерий, способный синтезировать бактериородопсин.
В настоящей работе использовали следующие питательные среды.
1. Минимальная среда М9 (Miller J., 1976). Среду использовали для ферментации штаммов №1 и №2 и выделения отдельных колоний.
2. Комплексная ферментационная среда (ФМ-среда) (Казаринова Л.А, 1980). Среду использовали для ферментации штаммов №3 и №4.
3. Синтетическая среда TS (Gibson Т., 1962). Среду использовали для ферментации штамма №5.
Условия адаптации и культивирования бактерий на дейтерий-содержащих средах.
Адаптацию клеток к дейтерию проводили на твёрдых агаризованных средах (2 %-ный агар), с тяжелой водой. При этом использовали как простой рассев культур до отдельных колоний на средах, приготовленных из 99,9 ат.% тяжёлой воды, так и многостадийную адаптацию бактерий на средах, содержащих ступенчато увеличивающиеся концентрации тяжёлой воды.
Для биосинтеза меченных БАС использовали среды тех же составов, приготовленные на основе тяжёлой воды и дейтерометанола D2О/СDзОD с использованием безводных реагентов. Полученную таким образом биомассу В. mehylicum гидролизовали в DCI и использовали в качестве источника суммарных химических компонентов для культивирования штаммов №3 и №5 соответственно.
13С-аминокислоты были получены за счёт конверсии 13СНзОН в метилотрофных бактериях.
Для введения дейтерия в молекулу бактериородопсина использовали селективную синтетическую среду TS, в которой ароматические аминокислоты -L-Phe, L-Tyr и L-Тгр были замещены их дейтерированными аналогами - L-[2,3,4,5,6-Ds]-Phe, L-[3,5-D2]-Tyr и L-[2,4,5,6,7-D3]-Trp.
Методы выделения и анализа изотопно-меченых БАС.
Экстракцию липидов проводили смесью хлороформ-метанол (2:1) по методу Блайера и Дайера (Bligh E.G.. Dyer W.J, 1959).
Определение содержания глюкозы в культуральной жидкости проводили глюкозооксидазным методом (Beyrich Т., 1965).
Бактериородопсин выделяли из пурпурных мембран Н. halobium ET 1001 по методу Остерхельда и Стохениуса (Oesterhdt О., & Stohenius, 1976).
Гидролиз белка проводили с использованием 4 н. Ва(ОН): и 6 н. DC1 ( в D2О)(110°С,24ч).
Бензилоксикарбонильные производные аминокислот получали в ходе реакции Шоттена-Баумана (GreensteinJ., Winitz M., 1961).
Дансильные производные аминокислот получали по методу Греема и Хартли (GreemB., Hartly В, 1963).
Метиловые эфиры дансил-аминокислот получали по методу Физера (Fiser J., 1963).
Аналитическое и препаративное разделение бензилоксикарбонильных производных аминокислот проводили методом обращённо-фазовой ВЭЖХ, разработанным Егоровой Т. А. (Егорова Т.А., 1993).
Разделение метиловых эфиров дансил-аминокислот проводили на жидкостном хроматографе "Кпаиег" (ФРГ), снабженным УФ-детектором "2563" и интегратором "C-R ЗА" (Shirnadzu, Япония). Неподвижная фаза: Separon SGX С 18,1 мкм, 150 х 3,3 мм (Kova, Чехословакия). Использовали градиентное элюирование растворителями: (А) - ацетонитрил-трифторуксусная кислота (20:80 об/об) и (В) - ацетонитрил (от 20% В до 100% В в течение 30 мин, при 100% В в течение 5 мин, от 100% В до 20% В в течение 2 мин, при 20% В в течение 10 мин),
Ионнообменную хроматографию проводили па приборе "Biotronic LC 500!" (ФРГ), 230x3,2 мм, рабочее давление 50-60 атм, скорость подачи буфера 18,5 мл/ч, нингидрина 9,25 мл/ч, детекция при 570 нм и 440 нм.
Масс-спектры электронного удара получены на приборе "МВ-80А " (Hitachi, Япония) при энергии ионизирующих электронов 70 эВ. Масс-спектры FAB были получены на приборе " MBA " (Hitachi, Япония) при ионном токе 0,6-0,8 мА.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ.
1. ПОЛУЧЕНИЕ ШТАММОВ-ПРОДУЦЕНТОВ БАС, АДАПТИРОВАННЫХ К
РОСТУ И БИОСИНТЕЗУ НА СРЕДАХ С МАКСИМАЛЬНЫМИ
КОНЦЕНТРАЦИЯМИ ТЯЖЁЛОЙ ВОДЫ.
Адаптация облигатных метилотрофных бактерий М. flagellatum. В связи с важностью препаративного аспекта получения дейтерий-меченных соединений в рамках данной работы была изучена возможность адаптации различных штаммов-продуцентов БАС к росту на средах с максимальными концентрациями тяжелой воды (D2O). Для этого были проверены представители различных таксономических групп метилотрофных бактерий, имеющихся в коллекции ГосНИИ Генетики: L-лейцин-продуцирующий штамм облигатных метилотрофных бактерий М. flagellatum (ileu), реализующий 2-кего-3-дезокси-6-фосфогдюконат-альдолазный (КДФГ) вариант рибулё'зо-5- монофосфатного (РМФ) цикла ассимиляции углерода и L-фенилаланин-продуцирующий штамм факультативных метилотрофных бактерий В. methylicum (leu), ассимилирующий метанол по РМФ- циклу.
Для проведения адаптации был выбран ступенчатый режим увеличения концентрации тяжёлой воды в ростовых средах, так как мы предположили, что постепенное привыкание организма к тяжёлой воде будет оказывать благоприятный эффект на скорость роста культуры. При этом штамм М. flagellatum обнаружил повышенную чувствительность к тяжёлой воде: ингибирование роста бактерий наблюдалось при концентрациях D2О в среде 74,5 об.%. Роста бактерий на более высокой концентрации тяжёлой воды достичь не удалось. В связи с этим, в экспериментах по изучению уровней включения дейтерия в аминокислоты использовали препараты культуральной жидкости и биомассы М. flagellatum, полученные со среды, содержащей 74,5 об.% тяжёлой воды. Концентрация экзогенного дейтерометанола CD3OD составляла, как обычно, 1 об.%.
Адаптация факультативных метилотрофных бактерий В. methylicum. Попытки адаптировать штамм В. methylicum к росту при сохранении способности к биосинтезу L-фенилаланина на максимально дейтерированной среде привели к желаемому результату. К данному штамму метилотрофных бактерий был применён специально разработанный нами подход по адаптации, который заключался в серии из пяти адаптационных пассажей исходной культуры на агаризованных средах (с добавкой 2 об. % дейтерометанолом CD3OD) при ступенчатом увеличении концентраций экзогенной тяжёлой воды (от 0; 24,5; 49,0; 73,5 об% до 98 об% D2O) и последующей селекции устойчивых к тяжёлой воде клонов бактерий. При этом последовательно отбирали отдельные колонии, выросшие на средах, содержащих тяжёлую воду. Затем их пересевали на среды с большей степенью дейтерированпости, включая среду с 98 об.% тяжёлой водой (степень выживаемости бактерий на конечной полностью дейтерированной среде составляет не более 40%).
Полученный результат в опытах по адаптации В. methylicum к тяжёлой воде, позволил использовать гидролизаты его биомассы, а также саму биомассу, полученную в ходе многоступенчатой адаптации к D2O в качестве полноценных ростовых субстратов для выращивания бациллярных штаммов В. subtillis и В. amytoliquefaciens, а также штамма галофильных бактерий Н. halobium ET1001.
Адаптация бацилл В. subtittis и В. amyloliqucfaciens. В следующих опытах была исследована способность к росту на тяжёлой воде бациллярных штаммов В. subtillis (his, tyr, ade, иrа), и В. amyloliquefaciens (ade, иrа), продуцентов инозина и тимидина, соответственно. Мы предположили, что замедление роста бактерий на минимальных средах, содержащих тяжёлую воду могло быть обусловлено появлением ауксотрофности по отдельным ростовым факторам. Чтобы проверить это предположение, в дальнейшем мы использовали комплексные среды. Как и предполагалось, обе культуры удалось адаптировать к дейтерию путём рассева на твёрдые среды, приготовленные из 99,9 ат.% тяжёлой воды. Они сразу обнаружили нормальный рост на тяжёлой воде. У штаммов В. subtilis и В. amyloliquefaciens при росте на тяжёлой воде было отмечено сохранение высокого уровня продукции по инозину и тимидину (3,9 и 3,0 г/л соответственно).
Адаптация галофильных бактерий Н. halobium ET 1001. В случае с Н. halobium ET 1001 адаптацию проводили как на агаре, содержащим 99,9 ат.% тяжёлую воду путём рассева штамма до отдельных колоний, так и на жидкой среде с тяжёлой водой. В обычных для этой бактерии условиях культивирования (37°С, на свету) в клетках синтезировался фиолетовый пигмент по всем характеристикам не отличающийся от нативного бактериородопсина.
2. ИЗУЧЕНИЕ РОСТА И БИОСИНТЕЗА БАС ПОЛУЧЕННЫМИ ШТАММАМИ
Изучение ростовых характеристик М. jlagellatum на средах, содержащих CH3OH/CD3OD и D2O, а также 13СНзОН. Данные по росту штамма М. Jlagellatum на минимальных средах с добавкой 1 об.% метанола СНзОН и его меченных аналогов (СDзOD/13СНзОН) и содержащих ступенчато увеличивающиеся концентрации тяжёлой воды приведены в таблице I. Как видно из таблицы I, на средах, содержащих тяжёлую воду и изотопные аналоги метанола – дейтеро-метанол CD3OD и 13С-метанол 13CH3OH, выходы микробной биомассы составили 81% и 72% соответственно, а на средах с 74,5 об.% тяжёлой водой выход биомассы составил 29%, что в 3,4 раза ниже, чем в контрольных экспериментах, когда использовали обычную воду и метанол СНзОН (табл. 1, опыты 1,3,8). Как видно, способность к росту у М. flagellatum сохранялась лишь в среде, содержащей 74,5 об.% тяжёлой воды. Выше этой концентрации наблюдалось ингибирование скорости роста бактерий.
Таблица 1. Влияние изотопного состава среды на рост штамма M.flagelaum.
|
Номер Компоненты среды, об% Величина Выход Время опыта лаг-фазы биомассы генерации Н2О D2O СНзОН СDзОD часы % ч |
|||||||
| 1 | 99,0 | 0 | 1,0 | 0 | 0 | 100 | 1,1 |
| 2 | 99,0 | 0 | 0,5 | 0,5 | 0,2 | 91,0 | 0,8 |
| 3 | 99,0 | 0 | 0 | 1,0 | 0,8 | 81,0 | 1,0 |
| 4 | 49,5 | 49,5 | 1,0 | 0 | 2,4 | 76,0 | 1,4 |
| 5 | 49,5 | 49,5 | 0,5 | 0,5 | 5,7 | 75,0 | 1,2 |
| 6 | 49,5 | 49,5 | 0 | 1,0 | 6,7 | 70,0 | 1,3 |
| 7 | 24,5 | 74,5 | 1,0 | 0 | 5,6 | 29,0 | 1,4 |
| 8 | 99,0 | 0 | 1,0 'ЗСНзОН | 0 | 0,1 | 72,0 | 1,0 |
Как и следует из литературных данных (Складнее Д. А, 1990), введение стабильного изотопа углерода |3С не приводит к летальным последствиям для клетки, что мы и наблюдали в случае с М. flage/talum. В целом, полученные для М. flagellatum данные могут свидетельствовать о том, что адаптация к тяжёлой воде определяется как видовой специфичностью метилотрофных бактерий, так и особенностями их метаболизма. Кроме этого, из таблицы 1 следует, что данный подход можно эффективно использовать для введения в синтезируемые БАС двойной изотопной метки (дейтерий- и изотоп углерода 15C).
Изучение ростовых и биосинтетических характеристик Б. methylicum на средах, содержащих CH3OH/CD3OD и D2O. Данные по росту исходного и адаптированного к тяжёлой воде штамма В. methylicum и максимальному уровню накопления L-фенилаланина в культуральной жидкости на минимальных средах с добавкой 2 об.% метанола и его дейтерированного аналога СН3OН/CD3OD, содержащих ступенчато увеличивающиеся концентрации тяжёлой воды, представлены в таблице 2. Как видно из табл. 2, в отсутствии дейтерий-меченных субстратов продолжительность лаг-фазы не превышала 24 ч (см. табл. 2, опыт 1). С увеличением концентрации тяжёлой воды в среде продолжительность лаг-фазы увеличивалась до 64,4 ч на средах с 98 об.% тяжелой водой и 2 об.% CD3OD (табл. 2, опыт 10). Отмечено, что длительность времени клеточной генерации с увеличением степени изотопного насыщения среды дейтерием постепенно увеличивается, достигая 4,9 часов на максимально дейтерированной среде (табл. 2, опыт 10).
Таблица 2.
Влияние изотопного состава среды на рост штамма В. mehylicum и уровень накопления L-фенилаланина в культуральной жидкости*.
|
Номер Компоненты среды, об% лаг-фаза Выход Время Выход опыта биомассы генер. L-Phe, Н2 О D2O СH3ОН CD3OD ч % ч % |
||||||||
| 1 | 98 | 0 | 2 | 0 | 24,0 | 100 | 2,2 | 100 |
| 2 | 98 | 0 | 0 | 2 | 30,3 | 92,3 | 2,4 | 99,1 |
| 3 | 73,5 | 24,5 | 2 | 0 | 32,1 | 90,6 | 2,4 | 96,3 |
| 4 | 73,5 | 24,5 | 0 | 2 | 34,7 | 85,9 | 2,6 | 97,1 |
| 5 | 49,0 | 49,0 | 2 | 0 | 40,5 | 70,1 | 3,0 | 98,0 |
| 6 | 49,0 | 49,0 | 0 | 2 | 44,2 | 60,5 | 3,2 | 98,8 |
| 7 | 24,5 | 73,5 | 2 | 0 | 45,8 | 56,4 | 3,5 | 90,4 |
| 8 | 24,5 | 73,5 | 0 | 2 | 49,0 | 47,2 | 3,8 | 87,6 |
| 9 | 0 | 98,0 | 2 | 0 | 60,5 | 32,9 | 4,4 | 79,5 |
| 10 | 0 | 98,0 | 0 | 2 | 64,4 | 30,1 | 4,9 | 71,5 |
| 10' | 0 | 98,0 | 0 | 2 | 39,9 | 87,2 | 2,9 | 95,0 |
'Данные (1-10) приведены для В. methylicum, не адаптированного к средам с высоким содержанием дейтерия.
Данные 10' приведены для адаптированного В. methylicum.
Как видно из табл. 2, опыт 2, дейтерометанол CD3OD не вызывал существенного ингибирования роста и не оказывал влияния на выход микробной биомассы, в то время как на средах с 98 об.% тяжёлой водой микробный рост подавлялся. Так, на среде, содержащей 98 об.% тяжёлой воды и 2 об.% дейтерометанола СDзОD, выход микробной биомассы был снижен в 3,3 раза no-сравнению с контролем. Важно то, что выход микробной биомассы и уровень накопления L-фенилаланина в культуральной жидкости при росте адаптированного к тяжёлой воде штамма В. inethylicum в полностью дейтерированной среде изменяются по сравнению с контрольными условиями на 12,8% и 5% соответственно (табл. 2, опыт 10').
За счёт использования данного штамма В. methylicum удалось выделить порядка 1 г L-Phe из 1 л среды.
Исследование биосинтеза L-фенилаланина штаммом В. methylicum. Общей особенностью биосинтеза L-Phe в протонированных средах было значительное увеличение его продукции на ранней фазе экспоненциального роста В. inethylicum, когда выход микробной биомассы был незначителен (рис. I).
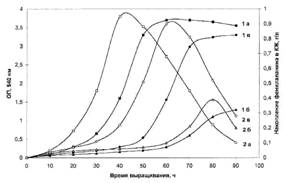
Рис. I. Динамики роста В. methylicum (la, 10'а, 10а) и накопления L-Phe в культуральной жидкости (16, 10'б, 106) на средах с различным изотопным составом: 1 а,б - исходный микроорганизм на протоннрованной среде М9; 10' а,б -адаптированный В. methylicum на полностью дейтерированной среде; 10 а,б - еадаптированный микроорганизм на полностью дейтерированной среде.
Во всех изотопных экспериментах наблюдалось ингибирование биосинтеза L-фенилаланина на поздней фазе экспоненциального роста и снижение его концентрации в ростовых средах. Согласно данным по микроскопическому исследованию растущей популяции микроорганизмов, наблюдаемый характер динамики секреции L-Phe не коррелировал с качественными изменениями ростовых характеристик культуры на различных стадиях роста, что служило подтверждением морфологической однородности микробной популяции. Скорее всего, накопленный в процессе роста фенилаланин ингибировал ферменты собственного пути биосинтеза. Кроме того, мы не исключаем возможность, что при ферментации без рН-статирования может происходить обратное превращение экзогенного фенилаланина в интермедиаторные соединения его биосинтеза, что отмечено в работах других авторов (Ворошилова Э. Б., Гусятипер М. М., 1989). Данные по исследованию культуральной жидкости методом тонкослойной хроматографии (ТСХ) показали, что кроме L-фенилаланина данный штамм В. methylicum синтезирует и накапливает в культуральной жидкости другие аминокислоты (аланин, валин, лейцин, изолейцин), четко детектируемые масс-спектрометрическим анализом (см. след, главу).
Изучение качественного и количественного состава внутриклеточных сахаров В. subtilis. В ходе выполнения работы был изучен качественный и количественный состав внутриклеточных Сахаров при росте В. subtilis на среде с 99,9 ат.% тяжёлой воды (см. табл. 3). Как видно из таблицы 3, в гидролизатах биомассы данного штамма фиксируются глюкоза, фруктоза, рамноза, арабиноза, сахароза и мальтоза.
Таблица 3.
Качественный и количественный состав внутриклеточных Сахаров В. subtilis при росте на 99,9 %тяжёлой воде.
|
Компонент Содержание в биомассе, % Рост на Н2О Рост на 99,9% D2O |
||
| Глюкоза | 20,01 | 21,40 |
| Фруктоза | 6,12 | 6,82 |
| Рамноза | 2,91 | 3,47 |
| арабиноза | 3,26 | 3,69 |
| мальтоза | 15,30 | 11,62 |
| сахароза | 8,62 | - |
Изучение аминокислотного состава биомассы метилотрофных бактерий В. tnethylicum. Аминокислотный состав суммарных белков биомассы В. methylicum, полученного в ходе многоступенчатой адаптации к тяжёлой воде показан в таблице 4. Результаты исследования показали небольшое снижение содержания в дейтерированном белке Ala, Leu и Нis по сравнению с белком, полученным на обычной воде (табл. 4).
Таблица 4.
Качественный и количественный состав аминокислот общих белков биомассы В. methylicum.
|
Аминокислота Содержание в белке, % Рост на Н2О Рост на 98% D2O |
||
| Gly | 8,03 | 9,69 |
| Ala | 12,95 | 13,98 |
| Val | 3,54 | 3,74 |
| Leu | 8,62 | 7,33 |
| His | 4,14 | 3,64 |
| Phe | 3,88 | 3,94 |
| Tyr | 1,56 | 1,82 |
| Asp | 7,88 | 9,59 |
| Glu | 11,68 | 10,38 |
| Lys | 4,37 | 3,98 |
| His | 3,43 | 3,72 |
| Thr | 4,81 | 5,51 |
| Met | 4,94 | 2,25 |
| Arg | 4,67 | 5,27 |
Изучение ростовых и биосинтетических характеристик В. subtilis на средах, содержащих тяжёлую воду и гидролизаты метилотрофных бактерий. Кривые, отражающие динамику роста, ассимиляции глюкозы и накопление инозина в культуральной жидкости штаммом В. subtilis в условиях протонированной среды и среды, с 99,9 ат.% тяжёлой воды представлены на рис. 2.
Как видно из рис. 2, при переносе клеток со стандартной на дейтерированную среду выход микробной биомассы, продолжительность лаг-фазы и длительность времени клеточной генерации в целом изменяются незначительно. При росте исходного штамма В. subtilis па среде, содержащей обычную воду уровень накопления инозина в культуральной жидкости достигал величины 17,3 г/л после пяти суток культивирования (рис. 2). Уровень накопления инозина на дейтерированной среде был снижен в 4,4 раза по-сравнению с исходным штаммом на протонированной среде (рис. 2). Низкие уровни секреции инозина на дейтерированной среде коррелируют со степенью конверсии глюкозы в этих условиях. Так, кривая конверсии глюкозы на полностью дейтерированной среде имела меньший угол наклона, чем на среде с обычной водой, что свидетельствует о том, что при росте на дейтерированной глюкоза расходуется менее эффективно (рис. 2).
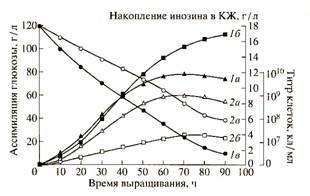
Рис.2. Динамики роста B.subtilis (1a, 2a), конверсии глюкозы (1б,2б) и накопления инозина в культуральной жидкости (1в,2в) на средах с различным изотопным составом: 1 а,б,в-B. Subtilis на обычной протонированной среде; 2 а,б,в-B.subtilis на полностью дейтерированной среде с гидролизатом дейтеро-биомассы метилотрофных бактерий.
Полученные для исследуемых микроорганизмов данные, в целом, подтверждают устойчивое представление о том, что адаптация клетки к тяжёлой воде является фенотипическим явлением, поскольку адаптированные к тяжёлой воде клетки возвращаются к нормальному росту и биосинтезу в протонированных средах после некоторого лаг-периода. В то же время обратимость роста на D2O/H2O-cpeдax теоретически не исключает возможности того, что этот признак стабильно сохраняется при росте в тяжёлой воде, но маскируется при переносе клеток на дейтерированную среду. Можно предположить, что клетка реализует лабильные адаптивные механизмы, которые способствуют функциональной реорганизации работы ферментных систем в тяжёлой воде. Также не исключено, что наблюдаемые при адаптации эффекты связаны с образованием в тяжёлой воде более прочных и стабильных связей, чем связей с участием водорода. По теории абсолютных скоростей разрыв С-Н-связей может происходить быстрее, чем C-D-связей, подвижность дейтерия D+ меньше, чем подвижность протия Н+, константа ионизации D2O в 5 раз меньше константы ионизации Н2О (Crespy J., Kalz H.H., 1979). С точки зрения физиологии, наиболее чувствительными к замене протия на дейтерий могут оказаться аппарат биосинтеза макромолекул и дыхательная цепь, т. е. именно те клеточные системы, которые используют высокую подвижность протонов и высокую скорость разрыва водородных связей.
3. ИЗУЧЕНИЕ СТЕПЕНЕЙ ВКЛЮЧЕНИЯ ИЗОТОПОВ ДЕЙТЕРИЯ и УГЛЕРОДА 13С в МОЛЕКУЛЫ ЭКЗОГЕННЫХ АМИНОКИСЛОТ B. methylicum и М. flagellatum.
Получение препаратов культуральных жидкостей, содержащих экзогенные дейтерий - и 13С-аминокислоты. Дейтерий-меченные аминокислоты были выделены в составе препаратов лиофилизованных интактных культуральных жидкостей, свободных от белков и полисахаридов, при росте штамма В. methylicum на минимальных средах с добавкой 2 об% метанола СНзОН и с различным содержанием тяжёлой воды. |3С-аминокислоты были получены за счет культивирования штамма М, flagellatum на среде, содержащей обычную воду и 1 об% 13С-метанол |3СНзОН. Данные по степеням включения дейтерия и 13С в молекулы экзогенных аминокислот двух исследуемых штаммов приведены в таблице 5. Во всех анализируемых образцах культуральной жидкости независимо от рода штаммов методом масс-спектрометрии электронного удара были обнаружены аланин, валин, лейцин/изолейцин и фенилаланин (табл. 5). В масс-спектрах дериватизованной культуральпой жидкости M.flagellatwn в дополнение к вышеобозначенным аминокислотам также фиксировался глицин.
Получение метиловых эфиров дансил-и карбобензокси-проазводных аминокислот. Степени включения изотопов дейтерия и мзотопа углерода 13С в мультикомпонептные смеси аминокислот в составе культуральной жидкости и белковых гидролизатов определяли методом высокочувствительной масс-спектромстрии электронного удара метиловых эфиров Dns-аминокислот или в виде Z-производных аминокислот после их препаративного разделения методом обращённо-фазовой высокоэффективной жидкостной хроматографии ОФ ВЭЖХ.
Аналитическое и препаративное разделение Z-производных аминокислот проводили методом ОФ ВЭЖХ, разработанным Егоровой Т. А. (Егорова Т. А., 1993). Степени хроматографической чистоты выделенных из культуральных жидкостей В. methylicwn и М. flagellatum 2-й Dns-производных дейтерий- и 13С-аминокислот составили 93-95%, а выходы 65-87% соответственно.
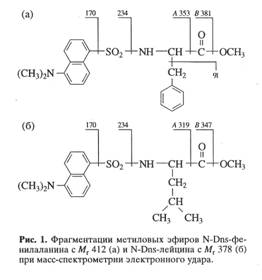
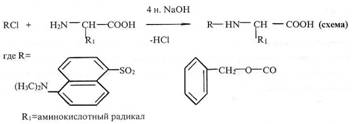
Предложенная нами модификация метода получения производных аминокислот заключалась в прямой химической обработке препаратов культуральной жидкости, полученной после отделения клеток, DnsCI (и ZCI) и CN2H2. Реакцию проводили в щелочной среде в водно-органическом растворителе в соотношении DnsCl (ZCI) -аминокислота, равным 5:1 (см. схему ниже).
Для лизина, гистидина, тирозина, серина, треонина и цистеина наряду с моно-производными было характерно образование ди-Z-(Dns)-производных: ди-Z,(Dns)-лизина, ди-Z,(Dns)-гистидина, О,N-ди-Z,(Dns5)-тирозина, О,N-ди-Z,(Dns)-серииа, O,N-AH-Z,(Dns)-Tpeoнина и N,S-ди-Z,(Dns)-цистеина (на схеме эти произодные не показаны). Кроме этого, из аргинина синтезировался три-Z,(Dns)-аргинин.
Летучесть Dns-и Z-производных аминокислот при масс-спектрометрическом анализе повышали за счет дополнительной дериватизации по карбоксильной группе (этерификации) диазометаном. Выбор диазометана в качестве этерифицирующего реагента был связан с необходимостью проведения реакции в мягких условиях, исключающих обратный изотопный (H-D-обмен в ароматических аминокислотах. При использовании диазометана происходило дополнительное N-метилирование по a-NH2-rpynne аминокислот, в результате чего в масс-спектрах метиловых производных аминокислот фиксировались дополнительные пики, соответствующие соединениям с молекулярной массой на 14 массовых единиц больше исходных.
Исследование степеней включения дейтерия в молекулу L-фенилаланина В. methylicum, полученного со сред с тяжёлой водой. Как видно из данных таблицы 2, рост данного штамма метилотрофных бактерий на средах с возрастающими концентрациями тяжёлой воды сопровождался снижением уровней накопления клеточной биомассы, увеличением времени генерации бактерий и продолжительности лаг-фазы при сохранении способности синтезировать и накапливать L-фенилаланин в ростовой среде. Поэтому было интересно изучить, как изменяются степени включения дейтерия в молекулу L-фенилаланина и других аминокислот В. methylicum в этих условиях.
Во всех опытах наблюдалось специфичное возрастание уровней изотопного включения дейтерия в молекулы аминокислот при ступенчатом увеличении концентраций тяжёлой воды в ростовой среде (табл. 5). Так, для индивидуальных аминокислот культуральной жидкости В. melhylicum, количество включённых атомов дейтерия по скелету молекул варьирует в пределах 49%-ной концентрации D2O и составляет для Phe 27,5%, Ala - 37,5%, Val - 46,3%, Leu/Ile - 47% (табл. 5). Аналогичное увеличение молекулярной массы аминокислот в зависимости от концентрации тяжёлой воды в среде было зафиксировано во всех экспериментах.
Таблица 5.
Степени включения дейтерия- и изотопа углерода 13С в молекулы секретируемых аминокислот В. melhylicum* и M. flagellation**.
| Аминокислоты |
Содержание :Н2О в среде, об% 24,5 49,0 73,5 98,0 |
13СН3ОН 1 % |
|||
| Gly | - | • | - | - | 60,0 |
| Ala | 24,0 | 37,5 | 62,5 | 77,5 | 35,0 |
| Val | 20,0 | 46,3 | 43,8 | 58,8 | 50,0 |
| Leu/Ile | 15,0 | 47,0 | 46,0 | 51,0 | 38,0 |
| Phe | 15,0 | 27,5 | 51,3 | 75,0 | 95,0 |
* Данные по включению дейтерия в аминокислоты приведены для В. methyticum при росте на средах, содержащих 2 об.% СН3ОН и 24,5; 49,5; 73,5; 98,0 об.% D2O. "Данные по включению 13С приведены для М. flagellatum при росте на среде, содержащей 1 об.% 13СН3ОН и 99 об.% Н2О.
Исследование степеней включения дейтерия в сопутствующие аминокислоты В. meihylicum на средах с тяжёлой водой. В масс-спектрах всех исследуемых образцов культуральной жидкости Б. melhylicum кроме основной секретируемой аминокислоты (фенилаланин) были обнаружены примеси, метаболически с ней связанных аланина, валина и лейцина/изолейцина обогащения лейцина, а также метаболически связанных с ним аминокислот немного ниже,С-алшнокислот из белковых гидролизатов. Поскольку при работе с микробной биомассой возникают проблемы, связанные с очисткой от сопутствующих компонентов, было необходимо применять специальные подходы при выделении фракции суммарных белков из бактериальных источников.
При выделении фракции суммарных белков биомассы метилотрофных бактерий (В. methylicum, M. flagellatum) учитывалось наличие в них углеводов. Мы использовали богатые по белку штаммы бактерий со сравнительно небольшим содержанием углеводов в них, гидролизу в качестве фракции суммарных белков подвергали остаток после исчерпывающего отделения пигментов и липидов экстракцией органическими растворителями (метанол-хлороформ-ацетон}.
Во всех случаях гидролиз белков проводили в 6 н. растворе DC1 (3 масс.% фенола в D2O) или в 4 н. растворе Ва(ОН):для предотвращения реакций обратного изотопного обмена (H-D) в ароматических аминокислотах и их разрушения.
Дейтерий- и 13С-меченные аминокислоты в составе гидролизатов суммарного белка биомассы были разделены методом ОФ ВЭЖХ со степенью хроматографической чистоты 93-96% и выходами 75-89% в условиях, аналогичных таковым для разделения секретируемых аминокислот (табл. 6). Хотя в таблице 6 приведены данные только для 10 аминокислот, очевидно, что в остальных аминокислотах уровни изотопного включения сопоставимы, хотя они не детектируются данным методом. Это предположение подтверждается данными по разделению белковых гидролизатов метилотрофных бактерий методом ионнообменной хроматографии на колонке "Biotronic LC 5001", где детектируется уже 15 аминокислот (см. рис. 4).
Исследование степеней включения дейтерия в аминокислотные остатки белка В. methylicum па средах с тяжёлой водой.
Общие принципы изучения степени изотопного обогащения молекул аминокислот при данном способе введения метки продемонстрированы на примере анализа включения дейтерия в мультикомпонентные смеси аминокислот, полученные после гидролиза суммарных белков биомассы в 6 н. DCl и 4 н. Ва(ОН).
Во всех -экспериментах по научению содержания дейтерия в аминокислотных остатках белка наблюдалась корреляция между степенью изотопного насыщения среды и уровнями включения дейтерия в аминокислоты (табл. 6), Например, для индивидуальных аминокислот белковых гидролизатов количество включенных атомов дейтерия по скелету молекулы варьирует незначительно в пределах 49%-ной концентрации тяжёлой воды и составляет для Ala 45%, Val - 36,3%, Leu/Ile - 42%, Phe -37,5%.
Таблица 6.
Степени включения D и 13С в аминокислотные остатки общих белков биомассы В. melhyiicum* и М. flagellatum**.
| Аминокислоты |
Содержание D2O в среде, об% 24,5 49,5 73,5 98,0 |
13СНзОН 1 об% |
|||
| Gly | 15,0 | 35,0 | 50,0 | 90,0 | 90,0 |
| Ala | 20,0 | 45,0 | 62,5 | 97,5 | 95,0 |
| Val | 15,0 | 36,3 | 50,0 | 50,0 | 50,0 |
| Leu/lie | 10,0 | 42,0 | 45,0 | 49,0 | 49,0 |
| Phe | 24,5 | 37,5 | 50,0 | 95,0 | 80,5 |
| Туr | 20,0 | 48,8 | 68,8 | 92,8 | 53,5 |
| Ser | 15,0 | 36,7 | 47,6 | 86,6 | 73,3 |
| Asp | 20,0 | 36,7 | 60,0 | 66,6 | 33,3 |
| Glu | 20,0 | 40,0 | 53,4 | 70,0 | 40,0 |
| Lys | 10,0 | 21,1 | 40,0 | 58,9 | 54,4 |
'Данные по включению дейтерия в аминокислоты приведены для В. melhyiicum при росте на средах, содержащих 2 об.% СН3ОН и 24,5; 49,5; 73,5; 98,0 об.% D2O. **Данные по включению 13С приведены для М. flagellatum при росте на среде, содержащей 1 об.% 13СН3ОН и 99 об.% Н2О.
Исследование степеней включения дейтерия в аминокислотные остатки белка В. melhyiicum на максимально дейтерированной среде. Полученные данные свидетельствуют о возможности достижения максимальных уровней включения дейтерия в аминокислотные остатки белков за счет адаптации культуры В. melhyiicum к росту и биосинтезу на среде с максимальной концентрацией тяжёлой воды. Как видно из таблицы 6, при росте В. methylicum на среде, содержащей 98 об.% тяжёлой воды, степени включения дейтерия в остатки Gly, Ala и Phe составляют 90, 97,5 и 95%, т.е. уровень мечения можно считать униформным. Низкие степени включения дейтерия в молекулы лейцина (49%), а также в метаболически связанных аминокислотах в этих условиях могут быть объяснены за счет ауксотрофности штамма в лейцине, который добавляли в среду культивирования в протонированной форме. Полученный результат по разбавлению дейтериевой метки в лейцине может быть объяснён сохранением доли минорных реакций в биосинтезе лейцина de novo.
Исследование степеней включения изотопа углерода I3C в аминокислотные остатки белка М.
flagellation за счёт биоконверсии 13СH3ОН.
В экспериментах по включению изотопа углерода |3С в молекулы белков за счёт биоконверсии 13СH3ОН метилотрофными бактериями М.flagellalum была показана эффективность мечения аминокислот изотопом углерода 13С. Так, в Phe детектировалось 80,5 % метки, в Ala - 95 %, в Gly - 90% (см. табл. 6).
Во всех экспериментах степени включения дейтерия и изотопа углерода 13С в метаболически связанных аминокислотах обнаружили определённую коррелляцию. Так, степени изотопного обогащения валина и лейцина (семейство пирувата), фснилаланина и тирозина (семейство ароматических аминокислот} совпадают (табл. 6). Степени изотопного включения глицина и серина (семейство серина), аспарагиповой кислоте и лизина (семейство аспарагина) также имеют близкие величины. Сравнивая данные таблицы 5 и 6, можно заключить, что степени изотопного обогащения экзогенных аминокислот и соответствующих аминокислотных остатков суммарного белка, в целом, также коррелируют.
Как и в случае с экзогенными аминокислотами, низкие степени включения изотопа углерода 13С в остатки Leu при росте на 1 об.% 13СНзОН обусловлены ауксотрофностью бактерий в этой аминокислоте.
Таким образом, нам удалось достичь максимальных уровней включения стабильных изотопов в суммарные белки биомассы метилотрофных бактерий. Именно поэтому мы посчитали возможным использовать гидролизаты их биомассы для биосинтеза других изотопно - меченных БАС.
5. ИССЛЕДОВАНИЕ ВОЗМОЖНОСТИ ИСПОЛЬЗОВАНИЯ ГИДРОЛИЗАТОВ БИОМАССЫ МЕТИЛОТРОФНЫХ БАКТЕРИЙ В. methylkum в КАЧЕСТВЕ СУБСТРАТОВ ДЛЯ ПОЛУЧЕНИЯ [1',3',4',2,8-D5]-ИНОЗИНА.
Получение [1',3',4',2,8-D5]- инозина. В следующих экспериментах было апробировано использование дейтеро-компонентов биомассы метилотрофных бактерий, полученных в условиях многоступенчатой адаптации к тяжёлой воде для синтеза высокодейтерированных нуклеозидов (на примере инозина). [1,3',4',2,8-D5]-инозин был получен биосинтетически за счёт использования штамма-продуцента В. subtilis и выделен из культуральной жидкости по методике, включающей адсорбцию инозина на активированном угле, десорбцию спиртово-аммиачным раствором и перекристаллизацию из метанола. ТСХ инозина, с детекцией при 249 нм показала наличие в анализируемом образце единственного пятна с Rf = 0,55, -соответствующего по подвижности чистому инозину.
Особенности разработанного метода получения [1,3',4',2,8-D5]-инозина заключаются в следующих аспектах:
1. В способности высокоактивного штамма В. subtilis к росту и биосинтезу инозина на средах, содержащих максимальные концентрации тяжёлой воды;
2. Замене глюкозы и аминокислот, необходимых для роста этого штамма-ауксотрофа на гидролизаты дейтеро-биомассы В. methylicutn. При последующих ферментациях в качестве источника ростовых факторов можно использовать ту же дсйтеро-биомассу метилотрофных бактерий, либо биомассу самого штамма-продуцента, содержащую в своем составе соединения, которые могут служить источниками углерода и ростовых факторов;
3. В практически полном отсутствии отходов: согласно схеме, дейтеро-биомасса базового штамма, после гидролиза в 6 н. DC1 возвращается в цикл в качестве ростовых факторов;
4. В высокой степени изотопного обогащения дейтерий-мсченного инозина (62,5% атомов водорода в молекуле замещены на дейтерий);
5. В высоких выходах (3,9 г/л) меченного продукта.
Исследование уровня дейтерированности инозина. Места локализации дейтерия в молекуле инозина, были исследованы с помощью масс-спектрометрии FAB и спектроскопии ПМР (см. схему).
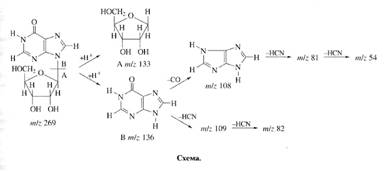
При анализе степени дейтерированности инозина учитывались следующие аспекты. Во-первых, вследствие того, что протоны в C1-C's положениях рибозной части молекулы инозина могли происходить из глюкозы, мы предположили,что характер биосинтетического включения дейтерия в рибозную часть молекулы инозина определяется, в основном, функционированием ряда процессов гексозо-моно-фосфатного (ГМФ) шунта, связанных непосредственно с ассимиляцией глюкозы и других сахаров. Во-вторых, многочисленные обменные процессы и внутримолекулярные перегруппировки, происходящие с участием тяжёлой воды могли также привести к специфическому включению метки по определенным позициям в молекуле инозина. Такими доступными позициями в молекуле инозина признаны, прежде всего, гидроксильные протоны -ОН и протоны при гетероатомах -NH (последние могут обмениваться на дейтерий в тяжёлой воде за счет кето-енольной таутомерии). Три атома дейтерия в рибозном остатке молекулы инозина могли происходить за счет функционирования многочисленных реакций ГМФ-шунта, два атома дейтерия а гипоксантинс также могли синтезироваться de novo (схема).
6. РАЗРАБОТКА СПОСОБОВ БИОСИНТЕТИЧЕСКОГО ПОЛУЧЕНИЯ ДЕЙТЕРИЙ-МЕЧЕНHOI О БАКТЕРИОРОДОПСИНА
Получение дейтерии-меченного бактериородопсина.
В качестве другой модельной системы для введения стабильной изотопной метки в белки, использовали бактериородопсин (bR), синтезируемый в клеточной мембране H. halobium ET 1QOL (рис.6). Для включения дейтериевой метки в bR использовали два принципиально отличных подхода: сайт-специфическое введение отдельных аминокислот: L-[2,3,4,5,6-D5]-Phe, L-[3,5-D2]-Tyr и L-[2,4,5,6,7-D5]-Trp в bR и униформное мечение бактериородопсина дейтерием путем выращивания П. halobium ET 1001 на среде, содержащей 99,9 ат.% тяжёлую воду и дейтеро-гидролизаты В. methylicum.
Бактериородопсин выделяли из пурпурных мембран Н. halobium ET 1001 солюбилизацией в 0,5 %-ном растворе додецилсульфата натрия (ДСН) с последующим осаждением белка метанолом. Гомогенность очищенного bR была потверждена электрофорезом в 12,5%-ном полиакриламидном геле в присутствии 0,1% ДСН.
ОФ ВЭЖХ метиловых эфиров Dns-, и Z-производных аминокислот, полученных после гидролиза bR в 4 н. Ва(ОН)2 или 6 н. DCI (3 масс.% фенола, в тяжёлой воде) показала высокие степени хроматографической чистоты выделенных аминокислот и отсутствие примесей небелковой природы в гидролизатах bR. Согласно данным по разделению дериватизованных гидролизатов bR методом ОФ ВЭЖХ, степени хроматографической чистоты выделенных дейтерий-меченных Dns-Phe-OMe, Dns-Tyr-OMe и Dns-Trp-OMe составили 96, 97 и 98% соответственно.
Исследование степени дейтерироваиности бактериородопсина. Оба подхода показали хорошие результаты по введению дейтериевой метки в молекулу bR. Например, в масс-спектре гидролизата электрофоретически чистого bR, полученного с селективной среды, содержащей L-[2,3,4,5,6-D5]-Phe, L-[3,5-D2]-Tyr и L-2,4,5,6,7-D5]-Trp, после прямой обработки реакционной смеси Dns-Cl и CN2Н2 фиксируются пики, соответствующие молекулярным ионам обогащённых дейтерием Dns-Phe-OMe с М+. при m/z 417 (вместо m/z 412 в контроле), Dns-Tyr-OMe с М+. при m/z 429 (вместо m/z 428) и Dns-Trp-OMe с М+. при m/z 456 {вместо m/z 451).
В случае с униформным мечением bR, метка включалась равномерно по всем положениям углеродного скелета в аминокислотных остатках белка.
ВЫВОДЫ:
1. Подобраны условия для проведения адаптации штаммов R. melhylicum, H.halobium, В. xubiilis и II. amyloliquefaciens к росту на D2О-средах. Селекционно отобраны штаммы, сохранившие высокие ростовые и биосинтетические характеристики на средах с максимальными концентрациями тяжёлой воды.
2. Показана принципиальная возможность использования суммы химических компонентов дейтеро-биомассы факультативных метилотрофных бактерий В. methylicum в качестве источников ростовых субстратов для синтеза дейтерий-меченных БАС.
3. Изучено
влияние меченных субстратов – D2O, CD3OD и |3СН3ОН
на ростовые
и биосинтетические параметры различных штаммов -продуцентов БАС. Показано, что
униформные уровни включения дейтерия в молекулы синтезируемых БАС
можно получить, используя высокодейтерированные среды
(D2О и СНзОН), а в
случае с 13С-мечением того же результата можно достигнуть за счёт использования |3СНзОН.
4. Предложена
дамсильная модификация препаратов культуральной жидкости для изучения степеней изотопного
обогащения аминокислот методом масс-спектрометрии
электронного удара. Метод позволяет проводить анализ изотопного состава мультикомпонентных смесей
аминокислот, как свободных
аминокислот из культуральной
жидкости, так и аминокислот в составе гидролизатов суммарных белков биомассы.
5. Проведено сравнительное изучение степеней включения дейтерия и изотопа углерода 13С в молекулы экзогенных аминокислот, так и в аминокислотные остатки суммарных белков штаммов метилотрофных бактерий в условиях их роста на средах, содержащих ступенчато увеличивающие концентрации тяжёлой воды.
6. Определена чёткая корреляция между уровнем включения изотопной метки в молекулы аминокислот и концентрации тяжёлой воды в ростовых средах.
7. Разработана схема получения дейтерий-меченных БАС с высокими степенями изотопного обогащения, основанная на использовании гетеротрофных микроорганизмов - продуцентов соответствующих БАС. Данная схема проверена на примере получения дейтерий-меченных инозина и бактериородопсина.
8. Исследованы методы сайт-специфического и униформного введения дейтериевой метки в бактериородопсин. Показано, что включение отдельных дейтерий-меченных аминокислот в молекулу бактериородопсина носит селективный характер, а использование адаптированного к D2O Н. halobium ET 1001 на средах с меченными субстратами и 99,9% D2O позволяет получать униформно меченный бактериородопсин.
СПИСОК ПУБЛИКАЦИЙ ПО ТЕМЕ ДИССЕРТАЦИОННОЙ РАБОТЫ.
1. Мосин О. В.. Карнаухова Е. Н., Пшеничникова А. Б., Складнев Д. А., Акимова О. Л. Биосинтетическое получение дсйтерий-мсченного L-фенилалаиина, секрстируемого метилотрофным мутантом Brevibaclerium methylicum II Биотехнология. 1993. №9. С. 16-20,
2. Егорова Т. А., Мосин О. В., Еремин С. В-, Карнаухова Е. Н., Звонкова Е. Н., Швец В. И. Препаративное разделение аминокислот белковых гидролизатов в виде бензилоксикарбонильных производных // Биотехнология. 1993. № 8. С. 21-25.
3. Беккер Г. Д., Мосин О. В.. Карнаухова Е. Н. Аминокислоты, меченные стабильными изотопами: получение и масс-спектро метрически и контроль. (Тезисы докл. 4-й Всероссийской научной конференции "Проблемы теоретической и экспериментальной химии")- Екатеринбург. 20-22 апрель 1994. С. 127-128.
4.Мосин О. В.. Карнаухова Е. Н., Складнев Д. А., Акимова О. Л., Цыганков Д, Ю. Штамм Brevibacterium methylicum - продуцент униформно меченной дейтерием аминокислоты L-фенилаланина. Заявка РФ № 93055824 от 15.12.1993.
5. Казаринова Л. А., Королькова Н. В., Миронов А. С., Мосин О. В.. Складнев Д. А., Юркевич А. М. Способ получения высокодейтерированных нуклеозидов и нуклеотидов. Заявка РФ № 95118778 от 14.11.1995.
6. Karnaukhova Е. N. Mosin О. V.. and Reshetova О. S. Biosynthetic production of stable isotope labeled ammo acids using methylotroph Methylobacillus JlageUattan // Ammo Acids. 1993. V. 5. № 1. P. 125.
7. Mogin O. V.. Karnaukhova
E. N., Pshenichnikova А. В., Reshetova O. S. Electron
impact spectrometry in bioanalysis of stable isotope labeled bacteriorhodopsin.
6th International Conference on Retinal Proteins. 19-24 June
1994. Leiden. The
Netherlands. P. 115.
8. Mosin O. V,. Karnaukhova E. N., Skladnev D. A. Application of methylotrophic bacteria for preparation of stable isotope labeled amino acids. 7th International Symposium on the Genetics of Industrial Microorganisms. 26 June 1994. Quebec. Canada. P. 163.
9. Matveev A. V., Mosin_O. V.. Skladnev D. A., Yurkevich A. M., and Shvcts V. Melhylolrophic adaptation to highly deuterated substrates. 8th International Symposium on Microbial Growth on Ci-Compounds. 27 August-l September 1995. San Diego. U.S.A. P. 49.
10. Mosin O. V.. Karnaukhova E. N., Skladnev D. A., and Shvets V. I. Preparation of D-and L'C-amino acids via bioconvertion of Ci-substrates, 8lh International Symposium on Microbial Growth on Сi-Compounds. 27 August-l September 1995. San Diego. U.S.A. P. 80.
11.Shvets V. I., Yurkevich A. M., Mosin_O. V.. Skladnev D. A. Preparation of deuterated inosine suitable for biornedical application // Karadeniz Journal of Medical Sciences. 1995. V. 8. № 4. P. 231-232.
12.Мосин О. В.. Складнее Д. А., Егорова Т. А., Юркевич А. М., Швец В. И. Исследование биосинтеза аминокислот штаммом Brevibacterium methylicum на средах, содержащих тяжелую воду. II Биотехнология. № 3. 1996. С. 32-37.
13.Мосин О. В.. Егорова Т. А., Чеботаев Д. В., Складнев Д. А., Юркевич А. М., Швец В. И. Получение бантериородопсина, меченного по остаткам ароматических аминокислот L-фенилаланина, L-тирозина и L-триптофана // Биотехнология. № 3. 1996. С. 14-20.
14.Мосин _О.В. Казаринова Л. А., Преображенская Е. С., Складнев Д. А., Юркевич А. М., Швец В. И. Рост бактерии Bacillus subtilis и биосинтез инозина на высокодейтерированной среде. // Биотехнология. № 4. 1996.
Перепечатка материалов без ссылки на наш сайт запрещена