Курсовая работа: Фізіолого-імунологічні аспекти формування епідемій та пандемій
Курсовая работа: Фізіолого-імунологічні аспекти формування епідемій та пандемій
Міністерство освіти і науки України
Тернопільський національний педагогічний університет
імені Володимира Гнатюка
кафедра загальної біології
Курсова робота
Фізіолого-імунологічні аспекти формування епідемій та пандемій
Виконала:
студентка 53 групи хіміко – біологічного факультету Домбровська А.В.
Науковий керівник:
доцент кафедри загальної біології Волошин О.С.
Тернопіль – 2010
План
Вступ
1. Поняття про епідемії та пандемії
2. Загальна характеристика вірусів
3. Механізми імунологічної захисту організму
4. Грип, як збудник епідемій та пандемій
4.1 Прояви імунітету
4.2 Вплив імунітету на передачу вірусу
4.3 Антитіла, специфічні до НА або NA
4.3.1 Антитіла до НА
4.3.2 Антитіла до NA
4.4 Відносна роль в імунітеті антитіл до НА і NA
4.5 Ієрархія вірусів грипу А
4.6 Гетеротипний імунітет
4.7 «Первороднй антигенний гріх»
4.8 Клітинний імунітет і грип
5. Профілактика епідемій та пандемій
5.1 Полісахариди
5.2 Похідні піримідину і пурину
5.3 Препарати різних груп
Висновки
Використана література
Вступ
Сучасна людина протягом свого життя перебуває в різних середовищах: соціальної, виробничої, місцевої (міської, сільської), побутової, природної та ін. Людина і середовище її проживання утворюють систему, що складається з безлічі взаємодіючих елементів, що має впорядкованість в певних межах і володіє специфічними властивостями. Така взаємодія визначається безліччю факторів і впливає як на саму людину, так і на відповідне середовище її проживання. Цей вплив може бути, з одного боку, позитивним, з іншого ‑ одночасно і негативним.
Негативні впливу факторів природного середовища виявляються головним чином у надзвичайних ситуаціях. Ці ситуації можуть бути наслідком, як стихійних лих, так і виробничої діяльності людини. До таких надзвичайних ситуацій відносяться епідемії та пандемії різної етіології.
1. Поняття про епідемії та пандемії
Епідемія (від грец. epi- — «серед» і demos — «народ») — тип захворювання, яке є новим для даної популяції протягом періоду збереження імунної «пам'яті» та розповсюджується зі швидкістю, що значно перевищує очікувану, засновуючись на нещодавньому попередньому досвіді (тобто числі нових випадків за одиницю часу).
Епідемія часто розвивається дуже швидко, тому потрібне проведення оперативних заходів.
Інфекційні захворювання передаються від хворих здоровим людям при безпосередньому контакті, через повітря, грунт, воду, харчові продукти.
У природних умовах джерелом інфекції можуть бути не тільки інфекційні хворі, а й бактеріоносії, які будучи самі здоровими, в організмі тривалий час зберігають мікроби, наприклад при черевному тифі, дизентерії, холері - роки. Інфекційні хворі і бактеріоносії виділяють мікроби в навколишнє їх середовище з блювотними масами, з повітрям, що видихається, з випорожненнями, сечею, через кров при укусах комах або через шприц та іншими шляхами.
Мікроби, що виділяються з випорожненнями хворої людини, потрапляють в грунт, воду, на харчові продукти, де вони розмножуються при певних температурних умовах. При вживанні зараженої води можуть виникнути масові захворювання (холера, черевний тиф, вірусний гепатит та ін.) З забрудненої ґрунтом збудники можуть потрапляти на пошкоджені ділянки шкіри. При деяких хворобах збудники проникають у шлунково-кишковий тракт через рот, при забрудненні рук, кухонне приладдя. Можливе зараження через продукти харчування, отримані від хворих тварин. Прямий контакт з хворими свійськими та дикими тваринами або зі здоровими носіями також можуть призвести до передачі інфекційної хвороби.[1]
Виникнення інфекційних хвороб і поширенню епідемії того чи іншого інфекційного захворювання обумовлено безперервністю взаємодії трьох рушійних сил, або факторів, складною епідемічною ланцюга:
‑ джерело інфекції (хвора людина, бактеріоносій, хвора тварина):
‑ фактори передачі інфекції (повітря, вода, харчові продукти, предмети праці, кліщі)
‑ сприйнятливість населення
Вимкнення будь-якого з факторів епідемічної колі призводить до її розриву. Якщо викорінення носить безповоротний характер, наприклад повністю видаляється з біосфери збудник натуральної віспи, то відбувається повна ліквідація відповідного епідемічного процесу.
Рушійними силами епідемічного процесу є також природні та соціальні чинники.
Природні чинники здатні підвищувати або знижувати агресивність (вірулентність) збудника, впливати на переносників збудників і на активність факторів передачі, а також на фізіологічний стан організму людини (підвищуючи або знижуючи його імунітет), сприяючи тим самим інтенсифікації чи ослаблення епідеміологічного процесу.
До соціальних чинників, який впливає на перебіг епідемічного процесу, відноситься вся складна сукупність умов і способу життя людей:
‑ характер виробничої діяльності;
‑ матеріальна забезпеченість;
‑ умови праці, відпочинку та побуту;
‑ щільність розселення людей і їх місцепроживання (місто, село)
‑ тип житла, його санітарно-технічний стан;
‑ особливості харчування;
‑ благоустрій;
‑ міграція населення;
‑ стан охорони здоров'я і т.д.
Медичні заходи щодо боротьби з інфекційними захворюваннями діляться на профілактичні та протиепідемічні.
Профілактичні заходи проводять незалежно від наявності інфекційних хвороб. Їх мета ‑ попередження виникнення інфекційних захворювань.
Під протиепідемічними заходами розуміють сукупність заходів, спрямованих на локалізацію та ліквідацію інфекції в епідемічному вогнищі. Від того наскільки відпрацьована ця система, яка ефективність і своєчасність їх проведення, залежить результативність комплексу вжитих заходів боротьби, а отже, і рівень подальших захворювань у вогнищі.
Комплекс протиепідемічних заходів повинен включати наступні заходи:
‑ щодо джерела інфекції;
‑ спрямовані на розрив шляхів передачі інфекції;
‑ спрямовані на підвищення несприйнятливості до інфекційних захворювань.
Особлива увага приділяється здійсненню тих заходів, які є найбільш ефективними в конкретній ситуації і в місцевих умовах.
Профілактичні заходи зазвичай спрямовані на:
‑ підвищення несприйнятливості населення (загальний і специфічний імунітет);
‑ знешкодження факторів передачі інфекції;
‑ виявлення і усунення джерела інфекції.
Щоб не допускати поширення інфекції, в осередку масових захворювань вводиться спеціальний режим - карантин або обсервація.
Пандемія (від. гр. παν «пан» — все + δήμος «демос» — народ) — епідемія, що характеризується поширенням інфекційного захворювання на території усієї країни, територію сусідніх держав, а в окремих випадках і багатьох країн світу. Характеризується відсутністю імунітету в людства, або сироватки. (наприклад, холера, грип). [3,7]
2. Загальна характеристика вірусів
Основними формами життя на Землі є організми клітинної будови. Цей тип організації характерний для всіх видів живих істот, за винятком вірусів, які розглядають як неклітинні форми життя.
Віруси настільки малі, що лише в кілька разів перевищують розміри великих молекул білків. Віруси мають розміри 10—275 нм. їх можна побачити лише під електронним мікроскопом. Вони легко проходять крізь пори спеціальних фільтрів, що затримують усі бактерії і клітини багатоклітинних організмів.
Віруси були відкриті у 1892 р. російським фізіологом рослин і мікробіологом Д. І. Івановським під час вивчення хвороби тютюну.
Віруси — збудники багатьох хвороб рослин і тварин. Вірусними хворобами людини є кір, грип, гепатит А (хвороба Боткіна), поліомієліт (дитячий параліч), сказ, віспа тощо.
Під електронним мікроскопом різні види вірусів мають форму паличок або кульок. Окрема вірусна часточка складається з молекули нуклеїнової кислоти (ДНК або РНК), скрученої в клубок, і молекул білка, розміщених у вигляді своєрідної оболонки навколо молекули кислоти (капсид).
Віруси не здатні самостійно синтезувати нуклеїнові кислоти і білки, з яких вони складаються. Розмноження вірусів можливе лише в разі використання ферментних систем клітин. Потрапивши у клітину, віруси змінюють і перебудовують обмін речовин у ній, внаслідок чого клітина починає синтезувати молекули нових вірусних часточок. Поза клітинами віруси переходять у кристалічний стан, що сприяє їх збереженню.
У житті вірусів можна виділити такі етапи: прикріплення вірусу до клітини, вторгнення вірусу в клітину, латентну стадію, утворення нового покоління вірусів, вихід віріонів. У латентну стадію вірус ніби зникає. Його не вдається виявити або виділити з клітини, але в цей період уся клітина синтезує необхідні для вірусу білки і нуклеїнові кислоти, в результаті чого утворюється нове покоління віріонів.
Проникнення вірусу в клітину організму хазяїна розпочинається із взаємодії вірусної часточки з поверхнею клітини, на якій є особливі рецепторні ділянки. Оболонка часточки вірусу має відповідні прикріпні білки, які "впізнають" ці ділянки.
Саме цим зумовлена висока специфічність вірусів стосовно клітинхазяїв: часто віруси уражують лише певний тип клітин якогось виду організмів.
Так, вірус поліомієліту уражує лише нервові клітини людини, а вірус тютюнової мозаїки — клітини листків тютюну.
Якщо часточка вірусу прикріплюється не до рецепторних ділянок, а до інших місць на поверхні клітинихазяїна, то зараження останньої може і не відбутися. Отже, наявність рецепторних ділянок на поверхні клітини визначає її чутливість до того чи іншого виду вірусів.
Усередину клітинихазяїна вірус може проникнути різними шляхами. Часом оболонки вірусних часточок зливаються з клітинною мембраною (як у вірусу грипу), і ДНК виявляється у цитоплазмі клітини, іноді вірусна часточка потрапляє в клітину шляхом піноцитозу, після чого ферменти клітинихазяїна розщеплюють її оболонку і вивільняють нуклеїнову кислоту (вірус поліомієліту тварин).
У рослинні клітини віруси можуть проникати крізь пошкоджені ділянки клітинної стінки.
У 1917 р. французький вчений Ф. д'Ерелл відкрив віруси бактерій — бактеріофаги (або фаги). Під електронним мікроскопом вони мають форму коми або тенісної ракетки розміром близько 5 нм.
Коли часточка фага прикріплюється своїм тонким відростком до бактеріальної клітини, його ДНК проникає в клітину і викликає синтез нових молекул ДНК і білка бактеріофага. Через 30—60 хв. бактеріальна клітина руйнується і з неї виходять сотні нових часточок фага, здатних спричинити зараження інших бактеріальних клітин.
Спочатку вважали, що бактеріофаги можна використовувати для боротьби з хвороботворними бактеріями. Проте згодом виявилося, що фаги швидко руйнують бактерії в пробірці, але неефективні в живому організмі. У зв'язку з цим їх використовують в основному для діагностики захворювань, виявлення бактерій. [1,4]
3. Механізми імунологічної захисту організму
Початок розвитку імунології відноситься до кінця XVIII століття і пов'язане з ім'ям Е. Дженнера, вперше застосував на підставі лише практичних спостережень згодом обгрунтований теоретично метод вакцинації проти натуральної віспи.
Відкритий Е. Дженнером факт ліг в основу подальших експериментів Л. Пастера, що завершилися формулюванням принципу профілактики від інфекційних захворювань - принцип імунізації ослабленими або вбитими збудниками.
Розвиток імунології довгий час відбувалося в рамках мікробіологічної науки і стосувалося лише вивчення несприйнятливості організму до інфекційних агентів. На цьому шляху були досягнуті великі успіхи у розкритті етіології ряду інфекційних захворювань. Практичним досягненням стала розробка методів діагностики, профілактики та лікування інфекційних захворювань в основному шляхом створення різного роду вакцин і сироваток. Численні спроби з'ясування механізмів, що обумовлюють стійкість організму проти збудника, увінчалися створенням двох теорій імунітету - фагоцитарної, сформульованої в 1887 році І. І. Мечниковим, і гуморальної, висунутої в 1901 році П. Ерліхом.
Початок XX століття - час виникнення іншої гілки імунологічної науки - імунології неінфекційної. Як відправною точкою для розвитку інфекційної імунології з'явилися спостереження Е. Дженнера, так для неінфекційної - виявлення Ж. Борде і Н. Чистовича факту вироблення антитіл в організмі тварини у відповідь на введення не тільки мікроорганізмів, а взагалі чужорідних агентів. Своє твердження і розвиток неінфекційна імунологія отримала у створеному І. І. Мечниковим в 1900 р. вченні про цитотоксину - антитіла проти певних тканин організму, у відкритті К. Ландштейнером в 1901 році антигенів людських еритроцитів.
Результати робіт П. Медавара розширили рамки і привернули пильну увагу до неінфекційної імунології, пояснивши, що в основі процесу відторгнення чужорідних тканин організмом лежать теж імунологічні механізми. І саме подальше розширення досліджень в області трансплантаційного імунітету привернуло до відкриття в 1953 році явища імунологічної толерантності - неотвечаемості організму на введену чужорідну тканину.
Таким чином, навіть короткий екскурс в історію розвитку імунології дозволяє оцінити роль цієї науки у вирішенні ряду медичних і біологічних проблем. Інфекційна імунологія - прародителька загальної імунології - стала в даний час тільки її гілкою.
Стало очевидним, що організм дуже точно розрізняє "своє" і "чуже", а в основі реакцій, що виникають у ньому у відповідь на введення чужорідних агентів (незалежно від їх природи), лежать одні і ті ж механізми. Вивчення сукупності процесів і механізмів, спрямованих на збереження сталості внутрішнього середовища організму від інфекцій та інших чужорідних агентів - імунітету, лежить в основі імунологічної науки.
Друга половина ХХ століття ознаменувалася бурхливим розвитком імунології. Саме в ці роки була створена селекційно-клональна теорія імунітету, розкриті закономірності функціонування різних ланок лімфоїдної системи як єдиної і цілісної системи імунітету. Одним з найважливіших досягнень останніх років стало відкриття двох незалежних ефекторних механізмів у специфічному імунній відповіді. Один з них пов'язаний з так званими В-лімфоцитами, що здійснюють гуморальну відповідь (синтез імуноглобулінів), інший - з системою Т-лімфоцитів (тимус-залежних клітин), наслідком діяльності яких є клітинна відповідь (накопичення сенсибілізованих лімфоцитів). Особливо важливим є отримання доказів існування взаємодії цих двох видів лімфоцитів в імунній відповіді.
Результати досліджень дозволяють стверджувати, що імунологічна система - важлива ланка в складному механізмі адаптації людського організму, а його дію в першу чергу направлено на збереження антигенного гомеостазу, порушення якого може бути обумовлено проникнення в організм чужорідних антигенів (інфекція, трансплантація) або спонтанної мутації. [2]
Але, як показали дослідження останніх років, поділ імунітету на гуморальний і клітинний вельми умовний. Насправді, вплив антигену на лімфоцит і ретикулярну клітину здійснюється за допомогою мікро- та макрофагів, переробних імунологічну інформацію. У той же час реакція фагоцитозу, як правило, беруть участь гуморальні фактори, а основу гуморального імунітету складають клітини, що продукують специфічні імуноглобуліни. Механізми, спрямовані на елімінацію чужорідного агента, надзвичайно різноманітні. При цьому можна виділити два поняття ‑ "імунологічна реактивність" і "неспецифічні фактори захисту". Під першим розуміються специфічні реакції на антигени, зумовлені високо специфічною здатністю організму реагувати на чужорідні молекули. Однак захищеність організму від інфекцій залежить ще і від ступеня проникності для патогенних мікроорганізмів шкірних і слизових покривів, та наявності в їх секрети бактерицидних субстанцій, кислотності шлункового вмісту, присутності в біологічних рідинах організму таких ферментних систем, як лізоцим. Всі ці механізми відносяться до неспецифічних чинників захисту, так як немає ніякого спеціального реагування і всі вони існують незалежно від присутності або відсутності збудника. Деяке особливе становище займають фагоцити і система комплементу. Це обумовлено тим, що, незважаючи на неспецифічність фагоцитозу, макрофаги беруть участь у переробці антигену і в кооперації Т- і В-лімфоцитів при імунній відповіді, тобто беруть участь у специфічних формах реагування на чужорідні субстанції. Аналогічно вироблення комплементу не є специфічною реакцією на антиген, але сама система комплементу бере участь у специфічних реакціях антиген-антитіл.
За клітинний імунітет відповідальні Т - лімфоцити (Т - клітини). Ці імунні клітини названі так через тимус, в якому вони піддаються основних стадіях своєї диференціації (школа Т-клітин). Активність Т-клітин спрямована проти зараженої вірусом клітини організму, а також на захист від грибів і паразитів. Т-клітини беруть активну участь в процесі відторгнення чужорідної тканини і допомагають у формуванні гуморальної імунної відповіді (див. нижче). За своєю функцією вони діляться на цитотоксичні Т-клітини ‑ Т-кілери (на схемі зеленого кольору) і клітини-помічники ‑ Т-хелпери (на схемі блакитного кольору).
У свою чергу гуморальну імунну відповідь спрямований на активацію В-лімфоцитів, які дозрівають у кістковому мозку на відміну від Т-клітин тимуса. Т-Клітини несуть на своїй поверхні антитіла і виділяють їх в плазму. Антитіла мають здатність специфічно зв'язувати відповідні антигени. Зв'язування антитіл з антигенами - вирішальне ланка в системі захисту організму від позаклітинних вірусів і бактерій. У результаті такого зв'язування останні орієнтуються як чужорідні тіла і надалі знищуються.[6]
"Пам'ять" імунної системи представлена так званими "клітинами пам'яті". Ці найбільш довгоживучі клітини існують для кожного типу імунних клітин.
На рис. 1 представлена спрощена імунна відповідь організму на антигени. Вірус, що проник в організм ендоцендоцитується макрофагами і потім частково руйнується в ЕПР (1). У результаті утворюються чужорідні фрагменти, які експонуються на клітинній поверхні макрофагів (2). Ці фрагменти «презентуються» спеціальною групою мембранних білків. Комплекс з вірусного фрагмента і білка головного комплексу гістосумісності розпізнається і зв'язується Т-клітинами за допомогою специфічних (Т-клітинних) рецепторів. Серед величезного числа Т-клітин тільки одиниці володіють відповідним рецептором (3), Зв'язування призводить до активації цих Т-клітин і появи їх селективних копій (4, "клональна селекція"). У активації Т-клітин беруть участь різні гормоноподібні сигнальні білки, інтерлейкіни. Ці білки секретуються тими клітинами імунної системи, які активуються при зв'язуванні з Т-клітинами. Так, активовані макрофаги з презентованим вірусним фрагментом секретують IL-1 (5), а Т-клітини продукують IL-2 (6), який стимулює їх власне клональне копіювання і реплікацію Т-хелперних клітин.
Клоновані та активовані Т-клітини здійснюють різні функції залежно від їх типу. Цитотоксичні Т-клітини здатні впізнавати і пов'язувати ті клітини організму, які інфіковані вірусами і на своїх рецепторах ГКГС несуть фрагменти вірусу (7). Цитотоксичні Т-клітини секретують перфорин - білок, який робить проникною мембрану пов'язаної інфікованої клітини, що і призводить до її лізису (8).
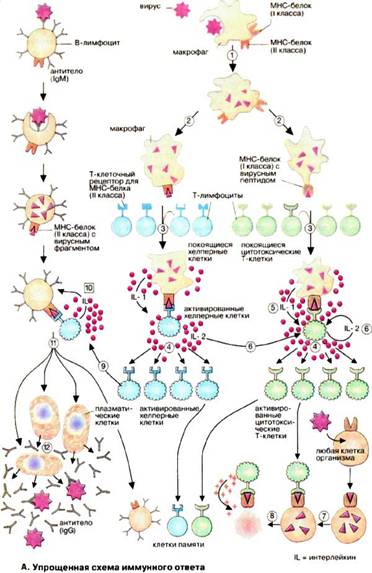
Рис. 1 Спрощена схема імунної відповіді
Т-хелпери, навпаки, зв'язуються з В-клітинами, які презентують на своїй поверхні фрагменти вірусу, пов'язані з білком ГКГС (9). Це веде до селективного клонування індивідуальних В-клітин і їх масованої проліферації. Інтерлейкін стимулює (10) дозрівання В-клітин ‑ перетворення в плазматичні клітини (11), здатні синтезувати і секретувати антитіла (12).[5]
4. Грип, як збудник епідемій та пандемій
Незважаючи на 40-річний період інтенсивного лабораторного вивчення і майже такий же період,: протягом якого розробляються вакцини проти грипу людей, існують величезні прогалини в нашому. Розумінні імунних механізмів при грипі. Ця неповнота наших знань значною мірою є наслідком унікальною і приголомшуючою здатності вірусу грипу до періодичних значним антигенним змін його поверхневих глікопротеїнів. При появі нових штамів, що містять нові поверхневі антигени, імунітет, який залежав від антитіл, спрямованих проти антигенів старих штамів, виявляється неспроможним, і виникає пандемія. Навпаки, наявність високих титрів антитіл до старих штамів в сироватці і секреті дихальних шляхів у основної частини популяції безсумнівно-сприяє тому, що новий вірус при своїй появі стає домінуючим.
Друга область невизначеностей пов'язана з питанням, опосередкований чи імунітет до грипу головним чином сироватковими антитілами або секреторними IgA антитілами в респіраторному тракті, так як. Без точного знання відносної важливості кожного з цих механізмів важко визначити оптимальний метод імунізації проти грипу.
Нарешті, мало відомо про роль імунних механізмів в одужанні. Хоча багато відомостей про те, що якщо до зараження активна імунізація інактивованих вірусом або пасивний прийом антитіл запобігає або змінює подальшу інфекцію антигенно-подібним вірусом, то пасивне введення антитіл після інфекції не впливає на захворювання. Однак наявних в даний час даних недостатньо для того, щоб оцінити внесок у процес одужання клітинних імунних механізмів.
4.1 Прояви імунітету
Остаточним проявом антивірусного імунітету служить здатність імунізованого господаря пригнічувати реплікацію вірусу і відповідно охороняти від вірусного захворювання. Реально імунітет може діяти, запобігаючи ініціацію інфекції у випадках, коли ймовірно зараження або, навпаки, досить пригнічуючи або анатомічно обмежуючи реплікацію вірусу після початку інфекції для того, щоб запобігти або змінити захворювання. Kpім того, вияв імунітету спостерігається при захисті не імунних індивідуумів в популяції (завдяки великому числу імунних людей в тій же популяції). Колективний імунітет вимагає, щоб імунні індивідууми з меншою ймовірністю ставали частиною епідемічної ланцюга інфекції, а, отже, з меншою ймовірністю служили б джерелами інфекції для інших (не імунних) організмів. Такі умови зустрічаються, якщо імунна відповідь зменшує чутливість до початку інфекції або змінює її таким чином, що зменшує ймовірність подальшої передачі. Навпаки, імунні механізми, що змінюють захворювання, але не запобігають інфекції або її подальшої передачі, не впливають на епідеміологію хвороби в імунній популяції. Було показано, що імунітет, що отримується в результаті попередньої інфекції або імунізації інактивованих вірусів грипу, забезпечує всі три ефекти: зменшену чутливість до початку інфекції, змінене перебіг хвороби та зменшений ризик захворювання у не імунних особин у тій ж популяції.
У результаті численних епідеміологічних досліджень отримані дані про те, що особи з антигемаглютиніруючі антитілами в сироватках схильні інфекції в період епідемії грипу не з тієї імовірністю, що не імунні індивідууми. Це видно по зменшенню серед них числа осіб з чотирикратним або більшим зростанням рівня антитіл. Наприклад, під час спалаху серед новобранців встановили, що у 98% осіб з початковими титрами НА-антитіл, меншими ніж 1: 8, малося чотириразове або більше збільшення титру в процесі епідемії, тоді як серед осіб з початковими титрами 1: 64 або вище тільки 6,3% виявляли серологічні свідоцтва інфекції. При аналогічному обстеженні в дитячому будинку виявили, що чотириразове і більше збільшення титру антитіл спостерігалося у 70% дітей з початковими титрами менше 1: 10, у 41% дітей з титрами 1: 10-1: 40 і у 2,4% дітей з початковими титрами 1: 80 «Чи більше. Аналогічні дані були отримані при ретельно контрольованою експериментальної інфекції добровольців. Більше того, співвідношення між титрами антитіл в сироватках і резистентністю до інфекції не залежало від того, були ці антитіла отримані в результаті попередньої інфекції або підшкірної імунізації інактивованих вірусом.
В Англії неодноразово проводилися досліди, коли добровольцям вводили віруси грипу А і В. При цьому показана лінійна обернена пропорційна (в широкому діапазоні) залежність між попередніми рівнями НА-антитіл у сироватці та ймовірністю захворювання в результаті експериментального введення вірусу.
Аналогічну залежність неодноразово демонстрували в експериментах на мишах, коли було показано, що концентрація вірусу, необхідна для початку інфекції, збільшується пропорційно дозі інактивованого вірусу, використаного для імунізації.
Крім зменшення ризику захворювання, що передує володіння антитілами до поверхневих антигенів вірусу грипу, як було показано, пов'язано із зменшенням тяжкості, захворювання, якщо зараження відбувається. У експериментальних тварин підвищена резистентність виражається в зниженні титру вірусу в легенях, зменшенні легеневих уражень і падінні смертності після введення вірусу.
Спостереження були зроблені на людях, інфікованих в процесі епідемії, або при експериментальному введенні вірусу. Наприклад, у тому ж дослідженні з новобранцями, про який говорилося раніше, були дані не тільки про зворотню залежність інфекції від попереднього рівня антитіл у сироватці, а також рівень захворювань, що супроводжуються значним підвищенням температури, також був обернено пропорційний титрам антитіл. При вивченні впливу вакцини на групі добровольців, експериментально заражених азіатським вірусом (H3N2),було показано, що у імунізованих осіб з безсумнівною інфекцією ступінь тяжкості захворювання була значно знижена. [6]
4.2 Вплив імунітету на передачу вірусу
Вплив імунітету на поширення інфекції серед не імунних членів популяції (колективний імунітет) не було вивчено так само інтенсивно, як його вплив на інфекцію і захворювання. Проте обмежена кількість даних, отриманих при лабораторних дослідженнях і епідеміологічних спостереженнях, дозволяє припускати, що при певних умовах імунні механізми можуть глибоко впливати на трансмісію.
Імунізовані добровольці при експериментальному введенні їм вірусу заражалися важче, а якщо заражалися, то продукували менші кількості вірусу в секреті носа, ніж контрольні добровольці. Мабуть, якщо достатньо велика частина якої-небудь популяції є імунної, поширення грипу серед не імунних осіб зменшується за рахунок як зниження загального числа сприйнятливих осіб у популяції, так і зменшення трансмісії імунними людьми, яких інфікували. Були проведені кілька імунізацій серед дітей шкільного віку в Текумса (Мічиган) перед спалахом грипу. Рівень респіраторних захворювань протягом епідемії був у Текумсе нижчий, ніж у Ейдріене, у якій імунізацію не проводили. Більше того, коли респіраторні захворювання досліджували у залежності від віку, виявилося, що найбільші відмінності між двома громадами були знайдені в рівнях захворювань осіб у віці 20-30 років. На підставі цього припустили, що імунізація дітей в Текумсе помітно знижувала захворюваність на грип серед батьків відповідної громади. Отримані дані. підтримують гіпотезу, висунуту Френсісом, що масова імунізація дітей, серед яких епідемії грипу зазвичай і починаються, може зменшити інтенсивність епідемії у всій популяції.
4.3 Антитіла, специфічні до НА або NA
Протягом багатьох років імунітет до грипу розглядався як пряме вираження ефектів, опосередкованих антитілами, вимірюваними в РГГА. Після відкриття на поверхні вірусу грипу двох кодованих геномом глікопротеїнових антигенів увагу було сфокусовано на спробах розділити і вивчити незалежно імунні ефекти, опосередковані антитілами, до кожного з цих антигенів. Завдяки використанню антигенно-гібридних рекомбінантних штамів та виділених очищених білків як антигенів була визначена роль обох видів антитіл в імунітеті.
4.3.1 Антитіла до НА
Ретроспективно на підставі численних даних, зібраних за останні 40 років, стало ясно, що антитіла, специфічно спрямовані проти НА вірусів грипу, здатні нейтралізувати вірус in vitro і переводити імунного господаря в стан меншій чутливості, до початку інфікування вірусом, що містить той же НА.
В експерименті показано, що миші, імунізовані рекомбінантним вірусом, що містить НА, ідентичний НА вірусу, використаного для вступу, IHO різну NA, стали резистентними до виникнення інфекції в тій же мірі, що і миші, імунізовані вірусом, що містить обидва антигени.
Очевидно також, що антитіла, специфічні до НА, можуть змінювати або не допускати захворювання, якщо інфікування все-таки відбулося. Слідом за введенням великих доз вірусу у мишей з антитілами до НА, утвореними в результаті активної або пасивної імунізації, мався на 100-1000 разів нижчий пік титрів вірусу в легенях, ніж у контрольних тварин, і в них були відсутні. ураження легень або була значно знижено ступінь їх тяжкості. Хоча порівнянні експерименти з людьми ще не проведені, тісна кореляція між рівнем НА-антитіл у сироватці і зменшеною вагою захворювання у імунних осіб, заражених вірусом грипу, дозволяє припустити, що антитіла ж НА не тільки знижують вірогідність інфекції, але можуть запобігати саме захворювання, якщо інфікування відбулося.
Вплив антитіл, специфічних до НА, на перенесення інфекції грипу серед людей не було чітко визначено. Очевидно, що особи з НА-антитілами, резистентні до вірусу грипу, не можуть брати участь в ланцюзі інфекції; відповідно ризик інфікування для інших членів популяції зменшений. Однак неясно, чи менше ймовірність перенесення інфекції від осіб з НА-антитілами, але зазнали інфекції, іншим людям. З одного боку, видається ймовірним, що більш низькі титри вірусу в таких осіб повинні супроводжуватися зменшеною ймовірністю поширення інфекції. Однак обмежені відомості, що стосуються цього питання, отримані з експериментів, проведених на тваринах, і вони парадоксальним чином вказують на те, що миші, імунізовані інактивованих вірусом або пасивно введеними антитілами до НА, будучи інфікованими, настільки ж ефективно передають інфекцію, як і не імуннізовані контрольні тварини.
Антитіла до НА надають свою дію шляхом запобігання прикріплення вірусу до клітин. У результаті вірусна інфекційність in novo або в культурі клітин зменшується. Мабуть, завдяки нейтралізації дії, іде запобігання або зміна інфекції в інтактному господареві.
4.3.2 Антитіла до NA
Існує полеміка щодо того, збільшують чи будуть антитіла, специфічні до NA, резистентність до інфекції. З точки зору того, що активність NA не впливає на прикріплення або проникнення вірусу. Здається малоймовірним, що антитіла до NA можуть запобігати інфекції. Це припущення ґрунтується на спостереженні, що для нейтралізації вірусу in ovo або в культурі клітин потрібні експериментально високі концентрації антитіл до NA. Більше того, миші з набутими ними пасивно або активно антитілами до NA вводиться вірусу так само легко інфікуються, як і контрольні тварини. Додаткові свідчення на користь того ж ефекту отримані на добровольцях з різними рівнями антитіл до NA вводиться вірусу, але не до NA. При подальшому інфікуванні частота лабораторно підтверджена інфекції (була такою ж високою в осіб, що володіють антитілами до NA, як, і у добровольців, у яких вони відсутні.
З іншого боку, є спостереження, що протягом спалаху вірусу на популяцію, що не володіє антитілами до NA нового вірусу, збільшення титру антитіл, до NA було пов'язано зі зниженням рівня серологічно доведених інфекцій. Слід зазначити, що хоча відмінності в цих дослідженнях були статистично значимими, величина зниження рівня інфекції в осіб з анти- NA -антитілами була значно нижче величини, що спостерігається при наявності антитіл до НА. В іншому дослідженні при оцінці резистентності до інфекції шляхом аналізу її рівня і титрів антитіл до НА і NA резистентність більш тісно корелювала з рівнем антитіл до NA. Важко узгодити результати цих досліджень, але отримані в даний час дані дозволяють припустити, що резистентність до інфекції набагато тісніше пов'язана з антитілами до НА, ніж з антитілами до NA.
Якщо співвідношення; між антитілами до NA і резистентністю до інфекції залишається суперечливим, їх вплив на зміну (хвороби чітко продемонстровано. У експериментальних тварин імунізація очищеної-виділеної NA супроводжується зменшенням титру вірусу в легенях і менш інтенсивним їх поразкою при введенні вірусу, що містить ту ж NA. Більш того, пасивна імунізація мишей кролячої антисироватки до NA дає такий же ефект. Це свідчить про те, що збільшена резистентність обумовлена специфічними антитілами. Аналогічні ефекти спостерігали у осіб з природно отриманими антитілами до NA або у добровольців, імунізованих інактивованих вірусом, що несе той же NA-антиген, що і вводиться вірус, але відмінний НА-антиген.
Як і у випадку антитіл до НА, вплив антитіл NA на перенесення вірусу інтенсивно не досліджували. Миші, пасивно імунізовані антитілами до NA перед експериментальним зараженням, менше передавали інфекцію незарядженим сусідам по клітці, ніж не імунізованих тварини. Навпаки, як вже вказувалося, тварини, пасивно імунізовані антитілами, специфічними до НА, не мали здатність знижувати перенесення вірусу після експериментального зараження.
Специфічна імунізація добровольців NA-антигеном введення вірусу супроводжується значним зниженням титрів вірусу в збрешете носа після зараження. Однак порівнянних досліджень впливу антитіл, специфічних до НА, на виділення вірусу після інфекції проведено не було.
Усе ще є деяка невизначеність щодо механізму,. За яким антитіла> до NA стримують інфекцію вірусу грипу в інтактним господаря. Коли починали з'ясовувати функцію вірусної NA, припускали, що специфічні антитіла стерично блокують доступ NA до високомолекулярних субстрату на поверхні клітини і, отже, перешкоджають звільненню знову синтезованого вірусу с. Поверхні «льотки. Згодом досліди з моновалентний антитілами призвели до сумніву в цій гіпотезі, коли на противагу бівалентним, концентрації моновалентних антитіл, інгібуючих NA in vitro, не впливали помітно на звільнення вірусу в процесі одиночного циклу реплікації. Як наслідок припустили, що антитіла до NA не впливають на реплікацію вірусу при специфічному придушенні вірусної NA-активності, а прикріплюють вірус до поверхні-клітини шляхом зчеплення антигенних місць на вірусної частинки з аналогічними місцями на мембрані клітини. Однак в експериментах, проведених пізніше, з моновалентний антитілами, спостерігали їх вплив на багатоциклову реплікацію вірусу і продемонстрували можливість опосередкування цих ефектів антитіл до NA. Незалежно від відносного значення цих двох механізмів ясно, що антитіла до NA не блокують прикріплення або проникнення вірусу в клітину, але за допомогою якого-небудь одного або обох механізмів пригнічують або уповільнюють звільнення вірусу з інфікованих клітин а, отже, запобігають зараженню сусідніх клітин.[3]
4.4 Відносна роль в імунітеті антитіл до НА і NA
З великого числа експериментальних і епідеміологічних даних, мабуть, правомірно зробити деякі узагальнення.
У першу чергу здається досить ясним, що антитіла до НА забезпечують більш сильний захист проти грипу, ніж антитіла до NA. В експериментальних дослідженнях тварини, які мають антитілами тільки ж НА Введені вірусу, можуть протистояти інфекції, а якщо і заражаються, то проявляють значно більше зниження титру вірусу в легенях, ніж у випадку, якщо введений вірус містить тільки NA-антиген, загальний з вірусом, використаним для імунізації. Переконливі дані можуть бути також отримані при спостереженнях над природно відбуваються спалахами епідемій грипу. При появі вірусу грипу (H3N2) в 1968 р. людина зіткнувся з новим варіантом, що містить НА-антиген, а NA-антиген був аналогічний антигену вірусів, превалювали перед цим протягом декількох років. Хоча захворюваність і смертність були нижче, ніж в 1957-1958 рр., коли новими стали обидва поверхневих антигени, захворювання на грип широко поширювалося в популяціях, які вже багато разів стикалися з вірусами, що мали аналогічну NA. Можливо, що особи з більш високими титрами NA-антитіл уникли захворювання, але очевидно, що хвороба не була попереджена у великої кількості людей з попереднім імунологічним статусом NA, спільної з NA нового варіанту. У порівнянні з цим штучна імунізація або попередня. Інфекція вірусом, що містить НА, аналогічним входить до складу переважаючого штаму, захищають більшість людей, і поширення пандемій грипу вимагає, мабуть, появи вірусу з новим НА незалежно від того, змінилася NA чи ні. З іншого боку, антитіла до NA у досить високому титрі змінюють перебіг захворювання, навіть якщо не попереджають інфекції, і ця «друга лінія» захисту може грати особливо, важливу роль тоді, коли відбуваються антигенні зміни НА. Більше того, хоча ця точка зору остаточно не доведена, можливо, що антитіла до NA можуть надавати специфічне, незалежне від антитіл до НА, вплив на зменшення виходу і подальшого розповсюдження вірусу.
Немає сумнівів, що значні зрушення в антигенною структурою НА вірусів грипу А, що відбуваються приблизно кожне десятиріччя, перекидають захисні механізми імунітету і обумовлюють пандемії грипу. Наслідки незначного дрейфу антигенної структури НА та NA, який має місце в межах існування даного підтипу вірусу грипу, менш зрозумілі. З появою нових варіантів, не ідентичних прототипу штамів, антитіла, вироблені у відповідь на інфекцію вихідним штамом, в серологічних тестах реагують в меншій мірі, і у більшої частини популяції антитіла до нового варіанту не знаходили. У результаті посадові особи, відповідальні за визначення вакцинних формул, стикаються з важкою проблемою вибору, чи дає величина антигенного зміни право на перегляд складу вакцини, і створюється невизначеність щодо того, чи захищені адекватним чином від нового варіанту люди, попередньо заражені прототипним штамом.
До нещастя, дані пов'язані з цим питань, обмежені і призводять до суперечливих висновків, зокрема тому, що варіації НА-, і NA-антигенів формуються незалежно і що, захисні ефекти антитіл до NA не завжди в достатній мірі приймалися до уваги .
4.5 Ієрархія вірусів грипу А
Приймаючи дещо іншу точку зору на антигенну мінливість, припустили, що між штамами в межах одного підтипу існує асиметричний розподіл, який полягає у тому, що в РГГА спостерігається велика ступінь перекривання при дослідженні антитіл до більш пізніх («старшим») штамів по відношенню до більш раннього («молодшого») вірусу, ніж це спостерігається при еквівалентному титруванні. Розмірковуючи над цими спостереженнями, припустили, що ідеальна вакцина повинна містити найбільш старший штам, який може бути виділений після низки серійних пасажів у присутності антитіл. Була приготовлена вакцина, що містить варіант вірусу H3N2, але чи виявиться лабораторний варіант антигенно-ідентичним варіантами, які з'являються в природі, і виявиться вакцина більш ефективною, ніж вакцини традиційні, ще належить визначити. Істотно, що антигенні варіації серед різних ізолятів, як було встановлено, більш виражені в кінці періоду існування даного підтипу, ніж спочатку. У зв'язку з цим вкрай важко передбачити заздалегідь, який варіант буде з найбільшою ймовірністю домінувати через 5-10. років після появи нового підтипу.[1]
4.6 Гетеротипний імунітет
Класифікація вірусу грипу типу А за серотипами заснована на серологічних перехресних реакціях в тестах РГГА, і РТНА. У значній мірі виправдано, що імунітет, опосередкований антитілами до НА, розглядається як специфічний для серотипу, тобто обмежений штамами вірусу, що реагують з антитілами в загальноприйнятих РГГА. Проте є деякі припущення, що можуть існувати ледь вловимі антигенні подібності в НА вірусів, які не дають подібності в РГГА або в реакції нейтралізації. Наприклад, було показано, що антитіла до виділеного НА, але реагують зі зруйнованим вірусом H1N1 в реакціях подвійної імунодифузії і одиночної радіальної імунодифузії. Фактично реакції рекомбінації ПЗ та HА антигенів можна виявити і в РГГА з певними штамами вірусів. Невдачі використання вакцин, пов'язані з появою варіантів, що володіють відзнаками НА-антигенів, роблять очевидним висновок, що імунні механізми, засновані на таких ледь вловимих антигенних взаємовідносинах, не є дуже сильними. Тим не менш можливо, що передує «знайомство» з вірусами одного підтипу може впливати на імунну відповідь при дії вірусу іншого підтипу.
З перших дослідів по імунітету до грипу, проведених в Англії і в Радянському Союзі, стало очевидно, що імунізація тварин шляхом інфікування їх вірусом грипу А одного серотипу збільшує резистентність до вірусу іншого підтипу за відсутності видимих нейтралізуючих антитіл до гетеротопічного штаму. У світлі сучасних знань можливо, що підвищена резистентність в більшій своїй частині була обумовлена антигенно близькими NA у двох вірусів. Згодом спостерігали, що після інфекцій, що повторюються морських свинок вірусом H1N1 з'являються нейтралізуючі антитіла, що реагують з вірусами HlNl, H0N1 і H2N2. Досліди на мишах показують, що навіть одиночна інфекція вірусам H0N1 забезпечує часткову резистентність. До вірусу H2N2 і що такий антигенний відповідь на Н2НА був більш виражений у тварин, раніше інфікованих гетеротопічним вірусом. Аналогічні спостереження за зміненою антигенною відповіддю у тварин, «ініційованих» попередньою гетеротелічною інфекцією, були зроблені на тхорах і хом'яків. Було проведено досліди з перенесення здібності до ініційованого відповіді разом з клітинами селезінки від попередньо інфікованих тварин. Узяті разом ці спостереження дають підставу припускати, що НА вірусів грипу А різних серотипів несуть загальні мінорні антигенні детермінанти. Хоча це антигенна спорідненість не є очевидним у звичайних серологічних тестах або не відбивається значною гетерологічною резистентністю у людини, ОЦВ, ймовірно, грає роль у розширенні імунної відповіді після множинних інфекцій, і в його посилення при інфекції або імунізації гетерологічним вірусом. Слід зазначити, що не ясно, чи необхідно для цього ефекту попереднє інфікування гетеротопічним штамом або аналогічні результати можуть бути досягнуті шляхом ін'єкції вакцини, що дається у великій дозі або з ад'ювантом.
4.7 «Первороднй антигенний гріх»
Інший прояв антигенного спорідненості між НА та АІТІ-генами вірусу грипу А різних серотипів виявляється у феномені «первородного антигенного гріха». Цей термін був введений для позначення характерної антигенної відповіді на наступні зустрічі з вірусами різних підтипів. Після впливу вірусу, що містить новий НА, продукуються антитіла, що реагують в РГГА не тільки з цим новим штамом, але і з вірусом, який зумовив первісну антигенну стимуляцію. Більш того, антитіла до нового штаму можна видалити шляхом адсорбції з вірусам, першим впливає на суб'єкта, але адсорбція з новим штамом видаляє лише антитіла, що реагують з цим штамів. Вид «антигенного первородного гріха» залежить від віку, це HswlNl для тих, хто народився між 1918 і 1930 рр., H0N1 для осіб, що народилися між 1930 і 1947 рр.. і т. д. У результаті дослідження сироваток людей різного віку дають характерні «профілі» титрів, що пригнічують гемаглютинацію антитіл до вірусів різних підтипів. Хоча спочатку припускали, що «первородний гріх антигенів» є складовою частиною імунної відповіді на всі віруси грипу А, пізніші дані показують, що у відповідь на вплив штамів H2N2 не утворюються антитіла до більш ранніх підтипів. Вивчення антигенів вірусу грипу пролило світло на імунологічні основи цього феномена. Отримані при цьому результати узгоджуються з попередніми дослідженнями порівнянного феномена, що стосується хімічно виявляються антигенів, які показали, що цей ефект, імовірно, обумовлений перехресної стимуляцією розростання популяції перехресно реагуючих клітин пам'яті В, що залишилися після первинної антигенної стимуляції.
Нещодавно отримані дані зробили очевидним, що феномен «первородного гріха антигенного» діє і по відношенню до NA. З NA-антитілами були отримані профілі залежності від віку, аналогічні профілями титрів, антитіл до НА. Більш того, неопубліковані дані, отримані в лабораторії показують, що імунізація вірусом H3N2 викликає збільшення рівня антитіл до NANl у осіб, що народилися до 1957 р., але не пізніше.
4.8 Клітинний імунітет і грип
Можливу роль клітинного імунітету у патогенезі грипу починають досліджувати тільки тепер. Той факт, що резистентність можна (передати шляхом інокуляції сироватки від імунних тварин перед введенням вірусу, робить очевидним, що попередження інфекції та захворювання може бути здійснено одними лише антитілами. Однак антитіла, передані пізніше, в ході інфекції, не змінюють захворювання і можливо , що так одужання можуть впливати механізми клітинного імунітету.
Клітинні імунні відповіді на введення антигенів вірусу грипу були продемонстровані па лабораторних тварин н людині слідом за інфекцією або ін'єкцією інактивованого вірусу, але їх вплив на стійкість-до подальшої інфекції важко оцінити через одночасно виникає відповіді гуморальних антитіл. Було знайдено, що миші, пасивно імунізовані повторними введеннями внутрішньочеревно кролячої антисироватки, були захищені від летального впливу гомологічного вірусу, але через 3 тижні у них були відсутні виявляються антитіла в сироватці і секреті слизової оболонки дихальних шляхів. Тим не менше ці тварини були частково резистентні до вторинного введення того ж вірусу. Було отримано подібні результати на пасивно імунізованих тхорах, і припустили, що часткова резистентність до повторного введення вірусу у тварин, на імунітет яких впливали пасивними антитілами, може бути опосередкована механізмами клітинного імунітету. Суперечливі дані були отримані в дослідах на тваринах з пригніченим імунітетом. Було встановлено, що введення щурам мишиної лімфоцитарної сироватки не впливає на виживання мишей, заражених вірусом грипу. З іншого боку, спостерігали підвищену виживаність заражених вірусом грипу мишей, що отримували циклофосфан, незважаючи на придушення утворення антитіл та наявність більш високих титрів вірусу в легенях, і приписали ці результати придушення клітинної імунної відповіді. У дослідах, проведених пізніше, було показано, що додавання кролячої антисироватки до лімфоцитів мишей супроводжується збільшенням виживання і зниженням уражень в легенях у мишей, заражених малими дозами вірусу H2N2. Автори прийшли до висновку, що клітинну імунну відповідь шкідлива для господаря, незважаючи на те що у імуннопригнічених тварин вірус персистував протягом більш тривалих періодів часу і що титри антитіл у них були нижчі. Поділ впливів гуморального і клітинного імунітетів на одужання ще більше, ускладнюється недавно зробленим відкриттям, що для появи антитіл до специфічних детермінант НА вірусу грипу необхідні Т-лімфоцити. При відсутності певних даних, отриманих на тваринах з дефектами системи Т-клітин шляхом порівняння нормальних та імунних лімфоцитів, фактично неможливо розібратися в цих суперечливих результатах, і вплив клітинного імунітету на інфекцію вірусом грипу (особливо у людини ) залишається неясним. [4]
5. Профілактика епідемій та пандемій
Інтерес до імуностимулюючої терапії, що має тривалу історію, різко зріс в останні роки і пов'язаний з проблемами інфекційної патології та онкології.
Специфічне лікування і профілактика, заснована на вакцинації, дієві при обмеженому числі інфекцій. При таких інфекціях, як кишкові і грип, ефективність вакцинації залишається недостатньою. Високий відсоток змішаних інфекцій, поліетіологічність багатьох роблять створення специфічних препаратів для імунізації проти кожного з можливих збудників не реальним. Введення сироваток або імунних лімфоцитів виявляється ефективним тільки на ранніх етапах інфекційного процесу. Крім того, самі вакцини в певні фази імунізації здатні пригнічувати опірність організму до інфекцій. Також відомо, що у зв'язку з швидким збільшенням числа збудників, що володіють множинною стійкістю до антимікробних засобів, з високою частотою асоційованих інфекцій, різким підвищенням імунізації здатні пригнічувати опірність організму до L-форм бактерій і значною кількістю серйозних ускладнень ефективна антибіотикотерапія стає все більш складною.
Перебіг інфекційного процесу ускладнюється, а труднощі терапії істотно посилюються при ураженні імунної системи та механізмів неспецифічного захисту. Ці порушення можуть бути генетично обумовлені або ж виникають вдруге під впливом різноманітних факторів. Все це робить актуальною проблему імуностимулюючої терапії.
З широким введенням асептики, що забезпечує попередження занесення мікроорганізмів в операційну рану, розпочалася науково обґрунтована профілактика інфекцій в хірургії.
Минуло всього вісімдесят шість років, а вчення про інфекцію в хірургії виконало великий і складний шлях. Відкриття і широке застосування антибіотиків забезпечили надійну профілактику нагноєнь операційних ран.
5.1 Полісахариди
Число повідомлень про вивчення різних ліпополісахаридів (ЛПС) продовжує стрімко зростати. Особливо інтенсивно вивчаються ЛПС грамнегативних бактерій, в оболонці яких міститься до 15-40% ЛПС. Полісахаридні препарати, останнім часом левамізол, викликають великий інтерес серед засобів неспецифічної імуностимулюючої терапії.
Більшість ЛПС через їх високу токсичність і великої кількості побічних ефектів неприйнятні для клінічного використання, але є цінним засобом імунологічного аналізу. Але ЛПС дуже активні і мають широкий спектр імуномодулюючої дії, і тому йде постійний пошук нових, менш токсичних ЛПС. Доказом цього є синтез сальмозана, який представляє собою полісахаридні фракції соматичного О-антигену бактерії черевного тифу. Він малотоксичний, практично не містить білків та ліпідів. В експериментах на мишах доведено, що при парентеральному введенні сальмозан є стимулятором проліферації і диференціювання стовбурових клітин, стимулює утворення антитіл, фагоцитарну активність лейкоцитів і макрофагів, підвищує титр лізоциму в крові, стимулює неспецифічну резистентність до інфекцій.
Дослідження останніх років доводять, що полісахариди і полісахаридні комплекси - не єдині компоненти бактеріальної клітини, здатні стимулювати імунітет.
Але з бактеріальних полісахаридів в медицині в даний час більш широко застосовуються пирогенал і продігіозан.
5.2 Похідні піримідину і пурину
В якості засобів, що підвищують резистентність організму до інфекцій, з кожним роком все ширше застосовуються похідні піримідину і пурину. Величезна заслуга у вивченні похідних піримідину належить Н. В. Лазарєва, який більше 35 років тому першим прийшов до думки про необхідність коштів, що прискорюють процеси регенерації. Похідні піримідину цікаві тим, що вони мають низьку токсичність, стимулюють білковий і нуклеїнових обмін, прискорюють клітинний ріст і розмноження, викликають протизапальні дії. Найбільшого поширення в якості стимулятора антиінфекційної резистентності отримав метилурацил, який стимулює лейкопоез, еритропоез. Похідні піримідину здатні попереджати зниження фагоцитарної активності лейкоцитів, яке настає під впливом антибіотиків, викликають індукцію синтезу інтерферону, збільшують рівень імунізації, рівень нормальних антитіл. Механізм їх дії як стимуляторів імуногенезу, мабуть, пов'язаний з включенням їх до білковий і нуклеїнових обмін, що викликають полівалентні вплив на імуногенез та процеси регенерації.
У клініці застосовується в терапії туберкульозу, хронічної пневмонії, лепри, пики, опікової хвороби. Наприклад, включення метилурацилу в комплексну терапію дизентерії, який сприяє нормалізації показників природної резистентності (комплемент, лізоцим, b-лізин сироватки, фагоцитарна активність).
Імуностимуляторами також є похідні пурину: мерадин, 7-ізопріназин, 9-метиладенін.
Ізопріназин є одним з нових імуностимулятрів, який відноситься до імуномодуляторів. Препарат має великою широтою терапевтичної дії. Він змінює імунологічну реакцію на різних стадіях: стимулює активність макрофагів, посилює проліферацію, цитотоксичну активність лімфоцитів, підсилює число і активність фагоцитозу. Відомо, що ізопріназин не впливає на функції нормальних поліморфноядерних лейкоцитів. [2]
5.3 Препарати різних груп
Тимозин. Основний ефект ‑ індукція дозрівання Т-лімфоцитів. Дані про вплив тимозин на гуморальний імунітет суперечливі. Існує думка, що посилюючи прояв імунних реакцій, тимозин знижує утворення аутоантитіл. Вплив тимозин на клітинні реакції імунітету визначило сферу його клінічного застосування: первинні імунодефіцитні стани, пухлини, аутоімунні порушення, вірусні інфекції.
Вітаміни. Вітаміни, будучи коферментами або їх частиною, завдяки своїй ролі, в обмінних процесах надають досить значний вплив на функції різних органів і систем організму, в тому числі і на системи імунітету. Надзвичайно широке використання вітамінів, часто в дозах, істотно перевищують фізіологічні, робить зрозумілим інтерес до їх впливу на імунітет.
а) вітамін С.
За численними даними дефіцит вітаміну С призводить до виразно порушення Т-системи імунітету, система ж гуморального імунітету більш стійка до С-вітамінної недостатності. Крім величини дози велике значення має характер поєднання вітаміну С іншими препаратами, наприклад, з вітамінами групи В. Стимуляція фагоцитозу пов'язана з безпосереднім впливом його на фагоцити і залежить від величини дози препарату. Вважають, що вітамін С збільшує чутливість бактерій до лізоциму. Однак, після тривалої терапії великими дозами вітаміну С можливий розвиток різкого гіповітамінозу вітаміну С після припинення його прийому.
б) Тіамін (В1).
При гіповітамінозі В1 спостерігається зниження імуногенезу по відношенню до корпускулярним антигенів, зниження стійкості до деяких інфекцій. Вплив на фагоцитоз відбувається шляхом втручання в вуглеводно-фосфорний обмін фагоцитів.
в) Ціанокобаломін (В12).
Очевидно, ефективність вітаміну В12 в нормальних дозах при вкрай пригнічених гемопоетичних та імунологiчний функціях (порушення диференціювання В-клітин, зниження числа плазмоцитів, антитіл, лейкопенія, мегалобластна анемія, рецидивуюча інфекція). Але наголошується стимулюючий вплив вітаміну В12 на зростання пухлини (на відміну від В1, В2, В6). Одним з основних імуномоделюючий дій вітаміну В12 є вплив на обмін нуклеїнових кислот і білків.
Нещодавно синтезований коферментних препарат В12 ‑ кобамамід, який нетоксичний і володіє анаболічними властивостями і на відміну від вітаміну В12 нормалізує порушений ліпідний обмін у хворих на атеросклероз. [3]
Висновки
1. Імуномоделюючий засобами є препарати хімічної або біологічної природи, здатні модулювати (стимулювати або пригнічувати) реакції імунітету внаслідок впливу на імунокомпетентні клітини, на процеси їх міграції або на взаємодію таких клітин або їх продуктів.
2. Результати досліджень дозволяють стверджувати, що імунологічна система - важлива ланка в складному механізмі адаптації людського організму, а його дію в першу чергу направлено на збереження антигенного гомеостазу, порушення якого може бути обумовлено проникнення в організм чужорідних антигенів (інфекція, трансплантація) або спонтанної мутації.
3. Специфічні антитіла, що реагують з поверхневими антигенами вірусу грипу, здатні інгібувати інфекцію і запобігати захворюванню, якщо зараження все-таки відбулося. Зокрема, відповідні титри антитіл, спрямованих проти НА, забезпечують ефективний захист від грипу, але антитіла до NA також можуть змінювати перебіг захворювання і грати специфічну роль у запобіганні поширення вірусу. До нещастя, ці імунні механізми нівелюються унікальною здатністю вірусів грипу до періодично значимих антигенних змін і в меншій мірі піддаються менш значним змінам у антигенній структурі. Хоча ймовірно, що імунітет проти грипу відображає події, що мають місце на поверхні дихального епітелію, відносний внесок секреторних і сироваткових антитіл повністю не визначений. Нарешті, залишається незрозумілою роль імунних механізмів в одужанні від інфекції, зокрема вплив клітинного імунітету на одужання і патогенез.
Використана література
1. Галактионов В.Г. Иммунология/ В.Г. Галактионов – М.: РИЦМЭК, 2000. – 408с.
2. Драник Г.Н. Имунотропные препараты/ Г.Н. Драник, Ю.А. Гриневич, Г.М.Дызик – К.: Здоров’я, 1994. – 250с.
3. Лебедев К.А. Имунная недостаточность/ К.А. Лебедев, И.Д. Понякина – М.: Медицинская книга, 2003. – 442с.
4. Плейфер Дж. Наглядная имунология/ Дж. Плейфер – М.: ГЭОТАР Медицина, 1998. – 96с.
5. Фрейдлин И.С. Клетки имунной системы/ И.С. Фрейдлин, А.А. Тотолян – С-Пб.: Наука, 2001. – 390с.
6. Хаитов Р.М. Имунология/ Р.М. Хаитов, Б.В. Пинегин, Х.И. Истамов – М.: Медицина, 2000. – 440с.
7. Хаитов Р.М. Экологическая имунология/ Р.М. Хаитов, Б.В. Пинегин, Х.И. Истамов – М.: ВНИРО, 1995. ‑ 219
Перепечатка материалов без ссылки на наш сайт запрещена