Книга: Развитие, становление и основные аспекты фармации
Книга: Развитие, становление и основные аспекты фармации
РАЗВИТИЕ, СТАНОВЛЕНИЕ И ОСНОВНЫЕ АСПЕКТЫ ФАРМАЦИИ
Для ветеринарного провизора необходимы знания, с помощью которых можно контролировать качество лекарственных веществ, определять их подлинность, условия хранения, а также сведения о способах получения новых лекарственных средств из многообразия природных ресурсов. Эта информация излагается в ряде медицинских дисциплин, среди которых фармацевтическая химия занимает центральное положение. Этот предмет включает сведения о химическом строении лекарственных веществ, закономерностях взаимосвязи химической структуры с химическими, физическими и фармакологическими свойствами, об источниках и способах получения лекарственных препаратов, способах контроля их качества и условиях хранения. В данном учебнике по ветеринарной фармации авторы постарались обобщить и аннотировать сведения ряда медицинских учебников по фармацевтической химии, фармакогнозии и др. Например, при изложении фармацевтической химии за основу взят учебник В. Г. Беликова как наиболее подходящий, а также издания государственной фармакопеи (ГФ X и ГФ XI) и другие НТД. Цель издания учебника познакомить студентов ветфаков с азами этой науки и дать необходимый минимум знаний при работе с лекарственными веществами. Авторы надеются, что эти первоначальные сведения дадут толчок для более глубокого изучения этой новой, очень нужной для ветеринарии науки, направленной на изыскание и исследование лекарственных веществ.
В разделе общей фармацевтической химии наряду с определением предмета и содержанием фармацевтической химии, а также связи ее с другими науками излагается историческая справка развития фармацевтической химии и химико-фармацевтической промышленности, изложены принципы классификации фармацевтических препаратов, показаны основные направления и перспективы создания новых лекарственных веществ, способы получения и исследования их, современные методы фармацевтического анализа и документы, рeгламентирующие фармакологический анализ, дана оценка качества лекарственных форм, приведены данные о стабильности и сроках хранения лекарственных средств, а также фармацевтический анализ в биофармации и фармакокинетике.
В основу построения второго раздела положена химическая классификация и обобщена систематизация синтетических лекарственных веществ с информацией о химической структуре, физических свойствах, способах получения и анализа лекарственных средств.
Почти в аналогичном плане излагаются сведения о биологически активных соединениях (терпены, алкалоиды, гликозиды, витамины, ферменты, гормоны, простагландины, антибиотики), изложенные в третьей части.
Следует подчеркнуть, что познание способов анализа лекарственных веществ возможно только на основе изучения их химической структуры. Поэтому при описании способов фармацевтического анализа обращено внимание на взаимосвязь химической структуры лекарственных веществ с их химическими свойствами, что позволяет логически осмыслить способы испытаний препаратов на подлинность и методы количественного определения по катионам, анионам и по функциональным группам, а также обосновать необходимость соответствующих условий хранения того или иного лекарственного вещества и уяснить химические процессы, которые могут происходить при их хранении.
Предмет и задачи фармацевтической химии и ее связь с другими науками. Фармацевтическая химия — наука, изучающая способы получения, строение, физические и химические свойства лекарственных веществ; взаимосвязь между их химической структурой и действием на организм; методы контроля качества лекарств и изменения, происходящие при их хранении.
Основными методами исследования лекарственных веществ в фармацевтической химии является анализ и синтез.
Задачи, стоящие перед фармацевтической химией, решаются с помощью классических физических, химических и физико-химических методов, которые используются как для синтеза, так и для анализа лекарственных веществ. Чтобы познать фармацевтическую химию, необходимы глубокие знания в области общетеоретических химических, медико-ветеринарных биологических дисциплин, физики и математики.
Фармацевтическая химия занимает центральное место среди других специальных фармацевтических дисциплин — фармакогнозии, технологии лекарств, фармакологии, организации и экономики фармации, токсикологической химии и является своеобразным связующим звеном между ними. Например, фармакогнозия — наука, изучающая растительное лекарственное сырье, создает основу для создания новых препаратов, которые анализирует фармацевтическая химия. Это же относится и к технологии лекарств, и к их хранению и отпуску. В области исследования взаимосвязи между структурой молекул лекарственных веществ и их действием на организм фармацевтическая химия близко примыкает к фармакологии.
Поскольку лекарство предназначено для больного организма (для человека, животного), то фармацевтическая химия тесно связана с теоретическими медико-ветеринарными (анатомией, физиологией и др.) и клиническими дисциплинами (терапией, хирургией, акушерством и гинекологией, паразитологией и др.). Базируется же фармацевтическая химия на теории и законах таких химических наук, как неорганическая, органическая, аналитическая, физическая и коллоидная химия.
При разработке способов контроля качества лекарственных препаратов в фармацевтической химии применяют методы аналитической химии. Вместе с тем фармацевтический анализ имеет свои специфические особенности и включает три обязательных этапа: определение подлинности препарата, контроль его доброкачественности (установление допустимых пределов примесей) и количественное определение лекарственного вещества.
И, наконец, развитие фармацевтической химии невозможно без широкого использования законов таких точных наук, как физика и математика, без которых нельзя познать физические методы исследования лекарственных веществ и различные способы расчета, применяемые в фармацевтическом анализе.
Историческая справка. Создание и развитие фармацевтической химии тесно связано с историей фармации, которая зародилась в глубокой древности и оказала огромное влияние на формирование медицины, ветеринарии, химии и многих других наук. История фармации представляет собой самостоятельную дисциплину, которая изучается отдельно, но для того, чтобы понять, как и почему зародилась фармацевтическая химия в ее недрах, как происходил процесс становления ее в самостоятельную науку следует кратко проследить историю развития фармации с периода алхимии.
Период алхимии (IV—XVI вв.). Алхимики более 1000 лет пытались найти «философский камень» («великий эликсир», «панацею»), с помощью которого можно было бы превращать любые металлы в золото и серебро, а также излечивать болезни и возвращать молодость. Несмотря на недостижимость цели ими накоплен огромный объем полезных экспериментальных данных, которые послужили основой для последующего развития химических наук, в том числе и фармацевтической химии. Были разработаны методы очистки веществ (перегонка, возгонка, осаждение, фильтрование, кристаллизация), получены новые химические вещества (серная, соляная, азотная кислоты, различные соли).
В период алхимии проявился талант таджикского ученого Авиценны (ибн-Сины, 980-1037). Им разработана классификация различных веществ, впервые предложен способ получения перегнанной воды. Именно Авиценну по праву считают одним из основателей фармации, впрочем как и фармакологии. Его труд «Канон врачебной науки», в пяти томах которого он обобщил достижения греческой, индийской, ирано-арабской медицины, снискал ему мировую славу. Им описано 811 лекарственных средств минерального, растительного и животного происхождения и много способов изготовления сложных лекарств.
Период иатрохимии(ХУ1—XVII-вв.). В эпоху Возрождения на смену алхимии пришла иатрохимия (лечебная химия). Ее основатель — Парацельс Филипп Гогенгейм (1493—1541) считал, что «не добыванию золота, а защите здоровья должна служить химия». Сущность его учения заключалась в том, что организм человека представляет совокупность химических веществ, и недостаток каких-либо из них может вызвать заболевание, вот почему для лечения он применял соли металлов, серу и другие химические вещества. Он усовершенствовал и предложил ряд приборов и аппаратов для выполнения анализа. Поэтому его по праву считают одним из основоположников фармацевтического анализа, а иатрохимию — периодом зарождения фармацевтической химии. Местом же зарождения явились аптеки, которые в то время были своеобразными центрами по изучению химических веществ. В них получали и исследовали вещества минерального, растительного и животного происхождения, что позволяло накопить новые химические знания и совершенствовать химический эксперимент. За 100 лет развития иатрохимии химия обогатилась большим количеством фактов, чем алхимия за 1000 лет.
Период зарождения первых химических теорий (XVII—XIX вв.). Однако для развития промышленного производства потребовалось расширить рамки химических исследований за пределы иатрохимии. Это привело к созданию первых химических производств и к формированию химической науки.
Во второй половине XVII в. появилась первая химическая теория - теория флокистона. Авторы (И. Бехер, 1635-1682 и Г. Шталь, 1660—1734) пытались доказать, что процессы горения и окисления сопровождаются выделением особого вещества «флокистона».
Эту теорию сменила кислородная теория. У ее истоков стоял М. В. Ломоносов (1711—1765). Хотя сам кислород еще не был открыт, но М. В. Ломоносов доказал экспериментально, что в процессе горения и окисления происходит не разложение, а присоединение веществом «частиц» воздуха. Кислород же впервые выделил шведский ученый — фармацевт К. Шееле (1742—1786). Он также открыл хлор, глицерин, ряд органических кислот и другие соединения.
Особенно много химических и фармакологических веществ было выделено во второй половине XVIII в.: хлор, бериллий (Л. Воклен, 1763-1829), йод из морских водорослей (Б. Куртуа, 1777-1836), морфин из опия (Сеген), стрихнин, бруцин и другие алкалоиды (Пельтье и Кавенту). Аптекарь Мор способствовал развитию фармацевтического анализа совершенствованием и созданием нового оборудования и химической посуды (бюретки, пипетки, аптечные весы и др., которые носят его имя). Многое сделали для развития фармацевтической химии и другие исследователи.
Развитие фармацевтической химии в России. Зарождение фармации в России связано с народной медициной и знахарством. В старинных рукописных «лечебниках» и «травниках» содержатся сведения о многих лекарствах растительного и животного происхождения. Первыми ячейками аптек в России (XIII—XV вв.) явились зелейные лавки. В эти времена возник и фармацевтический анализ, поскольку возникла необходимость проверки качества лекарств. Уже в XVI—XVII вв. русские аптеки являлись своеобразными лабораториями по изготовлению не только лекарств, но и кислот (серной и азотной), квасцов, купоросов, очистки серы и др., необходимых для различных ремесел. Следовательно, они были местом зарождения фармацевтической химии. Характерно, что в России почти не были восприняты идеи западных алхимиков.
Первым учебным заведением по подготовке фармацевтов была медицинская школа, открытая в Москве в 1706 г., в которой одной из дисциплин была фармацевтическая химия. Многие русские химики получили образование в этой школе.
Подлинное же развитие химической и фармацевтической науки связано в России с именем М.В. Ломоносова. По его инициативе в 1748 г. была организована первая научная химическая лаборатория, в 1755 г. открыт первый русский университет. М.В. Ломоносов указывал на единство химии и медицины: «...медик без довольного познания химии совершенен быть не может». Большой вклад в становление отечественной фармацевтической химии внесли: Т.Е. Ловиц (1757—1804) — открыл адсорбционные способности угля и применение его для очистки воды, спирта, винной кислоты, виноградного сахара, микрокристаллического анализа; В. М. Северин (1765—1826), который подчеркивал, что «без знания химии испытания лекарств предпринимать не можно». Его книги: «Способ испытывать чистоту и неподвижность химических произведений лекарственных» и «Способ испытывать минеральные воды» явились первыми отечественными руководствами в области исследования и анализа лекарственных веществ. А.П. Нелюбин (1785—1858), труды которого по праву называют «энциклопедией фармацевтических знаний», впервые сформулировал научные основы фармации, выполнил ряд прикладных исследований в области фармацевтической химии; усовершенствовал способы получения солей хинина; создал приборы для получения эфира и для испытания мышьяка. Было много и других ученых-химиков, которые внесли свой вклад в становление фармации и фармацевтической химии.
Первые химические школы и создание новых химических теорий в России. В подготовке кадров химиков и фармацевтов существенную роль сыграли первые химические школы, основателями которых были А.А. Воскресенский (1809— 1880) и Н.Н. Зинин (1812—1880), крупные ученые-химики. Первый провел ряд исследований, имеющих непосредственное отношение к фармации, — выделил алкалоид теобромин, уточнил химическую структуру хинина и др. Н.Н. Зинин открыл классическую реакцию превращения ароматических нитросоединений в ами-носоединения.
Мировую известность принесли России их достойные преемники Д.И. Менделеев (1834-1907) и А.М. Бутлеров (1828-1886). Периодическая система Менделеева и теория строения органических соединений Бутлерова оказали решающее влияние на развитие мировой химической науки. Оба ученых уделили внимание фармации и фармацевтической химии.
Исследования в области химиотерапии и химии природных веществ. Окончательным научным становлением фармацевтической химии можно считать конец XIX в., который ознаменовался зарождением новой эпохи в области лекарствоведения — химиотерапии. Одним из ее создателей был русский врач Г.Л. Романовский, который сформулировал принцип химиотерапии в 1891 г. Эти работы продолжил немецкий ученый П. Эрлих в области создания химиотера-певтических средств в ряду элементорганических соединений.
В это же время в России проведен ряд исследований по изучению природных веществ. Е.А. Шадский в 1889 г. издал монографию «Учение о растительных алкалоидах, глюкозидах и птомаинах», обобщившую исследования в области природных веществ, а чуть раньше (1885 г.) Ю. К. Трапп издал один из первых учебников по фармацевтической химии.
Из этого краткого исторического экскурса видно, что зародившаяся на заре цивилизации фармация, способствовала развитию химии, которая, развиваясь сама, уже влияла на развитие фармации, в недрах которой возникла самостоятельная отрасль химии — фармацевтическая химия.
Фармацевтическая химия в СССР. Уже в начале образования СССР были созданы новые отечественные школы химии, оказавшие большое влияние на развитие фармацевтической химии. Например, крупная школа химиков-органиков А. Е. Фаворского и Н. Д. Зелинского, исследователя химии терпенов С. С. Наметкина, создателя синтетического каучука С. В. Лебедева, В. И. Вернадского и А. Е. Ферсмана в области биохимии, Н. С. Курнакова — в области физико-химических методов исследования.
На основе фундаментальных исследований в области химических и медико-биологических наук фармацевтическая химия стала самостоятельной наукой. Основы для разработки промышленного синтеза лекарственных веществ создают теоретические исследования химического строения, кинетики и катализа, химической кибернетики и технологии. Получено много новых лекарственных веществ растительного, животного и синтетического происхождения.
В 1920 г. в Москве был открыт научно-исследовательский химико-фармацевтический институт, который в 1937 г. переименован во ВНИХФИ. Аналогичные НИИ были открыты в Харькове (1920 г.), в Ленинграде (1930 г.), в Тбилиси (1932 г.).
Наряду с созданием новых синтетических лекарственных средств и лекарственных форм, разрабатываемых вышеперечисленными НИИ, проводятся исследования природных веществ, в том числе и растений. Для этого в 1931 г. был создан Всесоюзный институт лекарственных и ароматических растений (ВИЛАР).
Одновременно уделяется внимание и аптечному делу. В 1928 г. в Москве открывается Центральная аптечная научно-исследовательская лаборатория (ЦАНИЛ), реорганизованная в 1944 г. в Центральный аптечный научно-исследовательский институт (ЦАНИИ) и в 1976 г. во Всесоюзный научно-исследовательский институт фармации (ВНИИФ), который координирует в стране всю научно-исследовательскую работу в области фармации. Здесь же проводятся исследования в области организации и экономики фармации, фармацевтического анализа, технологии лекарств, биофармации и др.
Кроме НИИ подобные исследования проводились на кафедрах фармацевтической химии Пятигорского, Пермского, Ташкентского, Харьковского, Ленинградского фармацевтических институтов, а также Московского, Курского, Кишиневского, Азербайджанского и др. фармацевтических факультетов медицинских институтов.
Для улучшения контроля качества лекарств в 1976 г. был создан Государственный научно-исследовательский институт по стандартизации и контролю лекарственных средств. Характерно, что для контроля ветеринарных препаратов подобный НИИ был организован еще раньше.
Учитывая большое значение биологически активных веществ в фармакотерапии, были созданы специальные НИИ антибиотиков и витаминов в Москве, Ленинграде и некоторых других городах.
Развитие химико-фармацевтической промышленности в СССР и РФ. Практическое отсутствие собственной химико-фармацевтической промышленности в дореволюционной России привело к тому, что до 90 % всех лекарственных препаратов составлял импорт (главным образом из Германии).
В 1933—1941 гг. в стране была проведена большая работа по строительству новых и реконструкции действующих химико-фармацевтических предприятий, что позволило увеличить объем выпуска лекарственных препаратов и уменьшить их импорт. Во время Великой Отечественной войны многие фармацевтические предприятия на западе страны были разрушены. Но уже к 1956 г. производство медицинской продукции возросло в 6 раз по сравнению с 1945 г. Вплоть до начала перестройки (1989 г.) рос выпуск фармацевтических препаратов, который значительно сокращал импорт лекарств. С 1990 г. положение изменилось в худшую сторону по ряду объективных и субъективных причин, основной из которых явился распад СССР, поскольку много производственно-фармацевтических предприятий оказалось за рубежом. И опять возникло засилие импорта лекарств, которое не ликвидировано до настоящего времени и на долю его падает более половины всех используемых в России лекарств.
В ветеринарной медицине по ряду причин ветеринарной фармации практически не существовало. Ветеринарные специалисты пользовались в основном медицинскими препаратами, а выпуск собственно ветеринарных фармакологических средств не превышал 5-6% от потребности, причем эти препараты выпускали небольшие заводы ветеринарных препаратов (наподобие Гусь-Хрустального), а также различные научно-исследовательские ветеринарные станции и единичные НИИ. В этих же учреждениях и на некоторых кафедрах фармакологии в ветеринарных вузах и факультетах проводили исследования по адаптации медицинских лекарственных средств для применения на животных. Контроль за этой работой осуществлял и осуществляет Всесоюзный государственный научно-контрольный институт контроля, стандартизации и сертификации ветпрепаратов (ВГНКИ ветпрепаратов). Интересно отметить, что в медицине такой контролирующий орган был создан после образования химико-фармацевтических НИИ, вузов и промышленных предприятий.
Аптечная сеть ветеринарии также значительно отличалась от медицинской и в основном была представлена ветеринарными аптеками при Зооветснабах, ветеринарных лечебных учреждениях и животноводческих хозяйствах. Основные поставки ветеринарных препаратов, или, точнее, препаратов для ветеринарии, производила система «Зооветснаба» во главе с Союззооветснабом (теперь Рос-зооветснаб) — головной организацией данной системы. Вполне понятно, что и в ветеринарии для лечения животных пока используют в основном импортные лекарственные средства.
В то же время в последние годы в Российской Федерации в ряде крупных научно-практических центров появились достаточно авторитетные научно-производственные фармацевтические предприятия по разработке, производству и реализации отечественных ветеринарных препаратов, чаще всего на хозрасчетной основе. Например, такие учреждения, как АОЗТ НИИ ветеринарной фармации «Эврика» при Санкт-Петербургской госветакадемии (1994 г.), специализированное предприятие «БиоТЭП» Ставропольского края и целый ряд акционерных ветеринарных предприятий в крупных мегаполисах — Москва, Санкт-Петербург, Челябинск, Новосибирск, Ставрополь и др. В настоящее время налажен выпуск многих дефицитных более дешевых лекарственных средств, по эффективности не уступающих зарубежным, а иногда даже превосходящих. Например, в АОЗТ НИИВФ «Эврика» разработаны мази против клещевых и травматических повреждений кожи, антидиарейные и некоторые гинекологические средства, не имеющие аналогов за рубежом. В «БиоТЭП» номенклатура выпускаемых препаратов в 1999 г. составила 124 наименования. Реализация этих препаратов осуществляется в 16 регионах Российской Федерации и в некоторых странах ближнего зарубежья. То же можно сказать о ряде других фирм.
Контрольно-аналитические службы. Контроль за качеством лекарственных средств в Российской Федерации как в медицине, так и в ветеринарии осуществляют государственные учреждения во главе с Фармакологическими советами. Именно они и являются последней инстанцией (в ветеринарии — предпоследней, поскольку утверждает то или иное наставление по применению лекарственного препарата Департамент ветеринарии), дающий путевку в жизнь новому лекарственному средству.
Повседневный контроль за качеством лекарственных препаратов в аптеках, зоомагазинах, ветучреждениях возложен на местные органы ветеринарной инспекции. Контроль за производством лекарственных средств проводят сотрудники ВГНКИ ветпрепаратов совместно с местными органами ветеринарной инспекции. Юридическим основанием при проведении контроля является закон Российской Федерации о производстве и реализации лекарственных средств.
Классификация лекарственных веществ. И в медицине, и в ветеринарии существует два основных принципа классификации лекарственных веществ: по системному действию на организм и по химическому строению. Первый принцип используется в фармакологии, второй — в фармацевтической химии.
Химическая классификация позволяет распределить все лекарственные препараты по группам в соответствии с их химической структурой. В то же время по этой классификации в одной и той же группе могут оказаться лекарственные вещества с различным фармакологическим действием.
Тем не менее для фармацевтической химии рассмотрение лекарственных веществ с точки зрения химической классификации имеет важное значение для изучения и исследования способов получения препаратов, установления связей между химической структурой и фармакологическим действием, а также для разработки способов фармацевтического анализа, основанного на химических и физических свойствах лекарств. По этой классификации все лекарственные препараты подразделяются на две группы — неорганические и органические. Неорганические препараты классифицируют в соответствии с положением элементов в периодической системе Менделеева и основным классам: оксиды, кислоты, гидроксиды, соли, комплексные соединения. Органические лекарственные вещества классифицируют как это принято в органической химии. При этом используют два классификационных признака: структуру углеродной цепи или цикла и природу функциональной группы.
По первому признаку органические лекарственные вещества подразделяют на алифатические (ациклические) и циклические, последние, в свою очередь, на карбоциклические и гетероциклические соединения. Гетероциклические классифицируют по числу атомов, образующих цикл, природе гетероатомов и их количеству, а также по числу гетероциклов или характеру конденсированной системы, включающей гетероциклы или ароматические циклы. Карбоциклические соединения объединяют два ряда веществ — алициклические и ароматические. Вещества, структура которых включает только атомы углерода и водорода (углеводороды), классифицируют как углеводороды, в молекуле которых один или несколько атомов водорода замещены на функциональные группы.
По второму классификационному признаку в зависимости от наличия в молекуле той или иной функциональной группы алифатические и ароматические углеводороды разделяют на галогенопроизводные, спирты, фенолы, простые и сложные эфиры, альдегиды и их производные (имины, оксимы, гидразоны, семикарбозоны, тио-семикарбозоны), кетоны, сульфокислоты, карбоновые кислоты и их производные (соли, ангидриды, амиды, гидразиды и др.), нитро- и нитрозосоединения, амины, гидразины, диазо- и азосоединения.
Классификация имеет значение для обеспечения машинной обработки при планировании, организации производства и учета, стандартизации, ценообразовании лекарственных средств. Она является составной частью Единой системы классификации и кодирования технико-экономической информации. С этой целью был разработан 93-й класс общесоюзного классификатора продукции (ОКП) «Медикаменты, химико-фармацевтическая продукция и продукция медицинского назначения». Объектами классификации в 93-м классе ОКП являются лекарственные средства, изделия медицинского назначения, полупродукты, вспомогательные вещества.
Документом, в который вносятся сведения об утвержденных лекарственных средства является «Государственный реестр лекарственных средств, разрешенных для применения в медицинской практике и к промышленному Производству».
Имеется специальный «Перечень по фармакологической классификации». Все лекарственные средства распределены на 35 фармако-терапевтических групп. В соответствии с рекомендациями Всемирной организации здравоохранения (ВОЗ) в основу перечня положено международное запатентованное наименование (МЗН) лекарственного средства. После названия индивидуального лекарственного вещества приведены важнейшие лекарственные формы.
Фармацевтическая терминология. В фармацевтической химии используют две основные группы терминов: общие и специфические. Последние идентичны терминам, применяемым в аналитической, неорганической и органической химии. В 1980 г. Министерство здравоохранения СССР ввело в действие Терминологический словарь (часть I, вып. I). В него вошли термины и смысловое содержание основных понятий в области лекарственных средств.
Термин «лекарственный препарат» в фармацевтической химии используется аналогично термину «лекарственное вещество», т. е. допускается отступление от терминологического словаря.
Есть специфические термины, используемые только для фармацевтического анализа: «испытание на подлинность», «испытание на чистоту», «количественное определение», для выполнения которого применяют такие методы, как «титриметрия» и «гравиметрия» (не рекомендуется использовать устаревшие термины — «весовой анализ» и «объемный анализ»). Термин «концентрация» постепенно теряет свое значение. В настоящее время рассматриваются три вида концентрации:
концентрация молекул — отношение числа молекул к объему всей системы (Л~1);
массовая концентрация — отношение массы компонента к объему всей системы (г/л);
молярная концентрация — отношение количества вещества к объему всей системы (моль/л).
Введен также термин «доля», когда речь идет об отношении масс, объемов или количеств компонента и всей системы:
массовая доля — отношение массы компонента к массе всей системы;
объемная доля — отношение объема компонента к объему всей системы;
молярная доля — отношение количества компонента к количеству вещества во всей системе.
Долю выражают либо дробью, либо в процентах, принимая систему за единицу или за 100% , причем все виды долей в отличие от видов концентрации являются величинами относительными (выражаемые в безразмерных единицах).
Введены также понятия «массовое отношение», «объемное отношение» и «молярное отношение». Эти термины употребляются в тех случаях, когда речь идет об отношении массы (объема, количества) компонента к основной части системы. Например, массовое отношение соли к воде равно 1:50. Эти три вида отношений также являются величинами относительными (безразмерными).
В то же время в Государственной фармакопее вып. X и XI (ГФ X и ГФ XI) и другой научно-технической документации (НТД) (ФС, ВФС) пока сохранены понятия массовая процентная концентрация, объемная процентная концентрация, массообъемная процентная концентрация.
Разработкой и унификацией химических терминов занимается Международный союз чистой и прикладной химии ИЮПАК. Комиссией по аналитической номенклатуре отделения аналитической химии ИЮПАК рекомендована однозначная терминология для титри-метрических методов анализа. Так термин «ацидиметрия» означает определение вещества титрованием кислотой, а «алкалиметрия» — титрование вещества при помощи основания. В названиях методов титриметрического анализа рекомендовано, где это возможно, заменить окончание метрия на йметрия. В соответствии с этим предложен термин «компликсиметрия», но обычно метод называют комплексонометрией. Понятие «йодометрическое титрование» включает титрование растворами йода или растворами, содержащими йод. Регламентированы также понятия о таких типах титрования, как «кислотно-основное», «неводное», «окислительно-восстановительное», «осадительное», «косвенное», «фазовое», а также «обратное титрование», «холостое титрование», «контрольное титрование». Однозначными стали термины: «раствор сравнения», «приведенный объем», «конечная точка», «точка эквивалентности», «титрант», «буферная емкость» или «буферное число», «индикатор», «индикаторная поправка», «ошибка титрования», «интервал перехода».
В фармацевтической химии следует использовать основные термины метрологических характеристик анализа вещества, таких, как «анализ вещества», «метод анализа», «методика анализа», «аналитическая навеска», «градуировочная характеристика», «диапазон определяемых содержаний», «предел обнаружений», «результат анализа», «воспроизводимость анализа», «систематическая погрешность результата анализа», «правильность результата анализа».
Допускается отклонение от правил ИЮПАК в названиях неорганических лекарственных веществ. Для препаратов, представляющих собой соли, в начале дается название катиона в родительном падеже, а затем аниона в именительном, а по правилам ИЮПАК название катиона и аниона должно быть в именительном падеже.
Важным методом является формирование названия лекарственного вещества. Отсутствие определенных правил привело к тому, что одно и то же лекарственное вещество имеет десятки разных названий в различных странах. Имеются случаи, когда отличающиеся по фармакологическому действию препараты имеют одно и то же название. Впрочем, формирование названия лекарственного вещества — весьма сложный процесс. Лекарственные вещества представляют собой широкий круг химических соединений: от простых органических веществ до сложных пол и циклических и гетероциклических систем. Формирование названия неорганических лекарственных веществ осуществляется по катиону и аниону, что, как правило, разночтений не вызывает. Для лекарственных веществ, которые являются органическими соединениями, латинские и русские наименования в ряде случаев даются по номенклатуре ИЮПАК, но они могут быть длинными и сложными. Поэтому авторы дают им более короткие названия, в которых отражается суть либо химического строения, либо фармакологического действия, либо и то и другое.
С целью упорядочения этого вопроса Комиссия по международным названиям ВОЗ разработала международную классификацию, в основу которой заложена определенная система формирования терминологий лекарственных веществ. Принцип этой системы INN— МНН (International Nonproprietary Names — международные непатентованные наименования) заключается в том, что в названии лекарственного вещества ориентировочно дается его групповая принадлежность. Это достигается за счет включения в название частей слов, соответствующих фармакотерапевтической группе, к которой относится данное лекарственное вещество. Тем не менее упорядочение этого вопроса еще далеко до совершенства.
Основные этапы разработки лекарственных веществ. Создание новых лекарственных веществ связано с неимоверной сложностью биологических испытаний, длительностью разработки технологии производства и требует огромных затрат. На Западе стоимость разработки оригинального лекарственного препарата оценивается в десятки и сотни миллионов долларов, что во много раз превышает расходы на эти же цели в нашей стране.
Принято различать два уровня создания оригинальных лекарственных веществ. К оригинальным лекарственным средствам, опережающим мировой уровень, относятся те из них, которые по своему лечебному действию превосходят известные отечественные и зарубежные аналоги. К оригинальным лекарственным средствам, соответствующим мировому уровню, относятся те, которые по лечебному действию сопоставимы с лучшими зарубежными, но превосходят отечественные аналоги. Процесс создания оригинального лекарственного средства длится не менее 12 лет, а воспроизводимых на основе зарубежных аналогов — 5—6 лет.
Разработка лекарственного препарата включает следующие этапы:
1) идея создания нового лекарственного средства. Она возникает в результате совместной работы ученых двух специальностей: фармакологов и химиков-синтетиков. Уже и на первой стадии осуществляется предварительный отбор синтезированных соединений, которые могут быть потенциальными биологически активными веществами;
2)синтез предварительно отобранных веществ. На этой стадии также осуществляется отбор, в результате которого вещества, отличающиеся нестабильностью, невозможностью или чрезмерной трудоемкостью синтеза, дороговизной исходных веществ и т. д., не подвергаются дальнейшему исследованию;
3)фармакологический скрининг. Основной этап, во время которого отсеиваются неперспективные вещества, синтезированные на предыдущем этапе;
4)клиническая проверка. Ее выполняют только для перспективных биологически активных веществ, которые прошли все этапы фармакологического скрининга;
5)разработка технологий производства нового лекарственного препарата и наиболее рациональных лекарственных форм;
6)подготовка нормативной технической документации, включающей способы контроля качества как самого лекарственного препарата, так и его лекарственных форм;
7)внедрение препарата в промышленное производство и отработка всех стадий его получения в заводских условиях.
Испытание нового препарата и соединений ведут на самых разных уровнях: молекулярном, клеточном, субклеточном, на уровне тканей и органов животных, а также целостного организма. Новый препарат обязательно должен иметь преимущества перед существующими и выдерживать необходимые требования в отношении токсичности, в том числе канцерогенности, эмбриотропности, мутагенности и других показателей безвредности. Испытания выполняются, как правило, на трех видах лабораторных животных и животных тех видов, на которых ориентирован данный препарат. Терапевтическая ценность нового лекарственного средства окончательно оценивается в процессе широких клинических испытаний. На препарат, прошедший клинические испытания, готовят регламент производства, отражающий технологию проведения и аналитический контроль каждой стадии получения препарата. Кроме того, разрабатывается научно-техническая документация на субстанцию — конечный продукт производства.
Связь между структурой молекул веществ и их действием на организм. Как правило, предпосылкой для создания нового лекарства являются накопленные теоретические и эмпирические представления о характере связи между структурой, физическими свойствами и фармакологической активностью химических соединений. Под понятием «структура—активность» понимается комплекс физических и химических свойств, обусловленных строением молекулы изучаемого соединения. Установление зависимости между химическим строением и действием вещества на организм имеет большое значение в широком биологическом плане. Решение этой проблемы позволило бы осуществлять целенаправленный синтез веществ с заданным фармакологическим действием. И хотя идея о наличии связи между химической структурой органических соединений и их биологической активностью была высказана еще в 1869 г., к настоящему времени удалось установить лишь некоторые закономерности, которые дают только ориентировочные представления о том, как может изменяться действие вещества на организм при введении в его молекулу той или иной функциональной группы.
Например, установлено, что ненасыщенные соединения более фармакологически активны, чем насыщенные. Это связано с реакционной способностью, которая значительно выше у непредельных соединений. Введение галогенов усиливает фармакологическую активность алифатических и ароматических соединений, причем как активность, так и токсичность зависят от числа атомов галогена. Галогены, введенные в ароматический цикл, повышают токсичность. Хлор- и бромпроизводные усиливают наркотическое действие и снижают кровяное давление. Йодопроизводные менее активны, но имеют более выраженное антисептическое действие. Влияние кислорода находится в зависимости от функциональной группы, в состав которой он входит. Введение в молекулу вещества спиртового гидроксила повышает фармакологический эффект, причем активность растет от первичных к третичным спиртам. У ароматических соединений введение гидроксильных групп усиливает активность, как введение альдегидной или кетогруппы. Карбоксильная группа снижает активность и токсичность и улучшает растворимость.
Присоединение метальных групп к атому азота дает различные эффекты. При введении их в молекулу аммиака или при алкилировании атомов водорода в аминогруппе, гидроксильной, карбоксильной группировках почти всегда снижается или выраженно изменяется фармакологическая активность. Существует значительное различие между влиянием этильной и метальной групп, введенных в молекулу.
Длина цепи алифатического радикала, вводимого в молекулу, — один из важнейших факторов, влияющих на активность и токсичность веществ. Обычно нарастание эффекта происходит при удлинении алифатической цепи до шести атомов углерода. Фенильный радикал, введенный в молекулу, приводит к значительному сдвигу активности вещества. Установлено, что повышение биологической активности в гомологических рядах не беспредельно. Всегда достигается «перелом» и высшие гомологи оказываются неэффективными.
Введение нитрогруппы в молекулу не снижает токсичности бензола. Усиливается его токсичность при введении в его молекулу галогена. Галогенопроизводные бензола проявляют, как правило, антимикробную активность. Гидроксильные группы, введенные в ядро бензола, придают веществу антисептические свойства, которые находятся в зависимости от числа фенольных гидроксилов. Карбонильные группы усиливают физиологическую активность и токсичность бензола. Присутствие карбоксильной группы в молекуле бензола снижает токсичность. Препараты бензойной кислоты, например ее натриевую соль, применяют внутрь в качестве лекарственного средства при бронхитах. Восстановление нитробензола приводит к образованию анилина, который токсически действует на ЦНС, но одновременно проявляет жаропонижающее и анальгезирующее действие. Токсичность анилина заметно снижается при введении фенольного гидроксила, например аминофенол и особенно его производные менее токсичны, чем анилин.
Очень важно установление связи между фармакологической активностью и стереохимией молекул органических соединений. На примере гетероциклических соединений установлено, что фармакологический эффект зависит как от самой гетероциклической системы, так и от относительной ориентации в ней различных заместителей. Замена атома углерода в ароматической или гетероциклической системе на гетероатомы, увеличение числа звеньев цикла, удлинение или разветвление алифатической цепи, присоединенной к гетероциклической системе, вызывают стереохимические изменения в молекуле. Последние могут привести к появлению геометрических, оптических и других изомеров, которые в свою очередь вызывают изменение фармакологического действия.
Установлено наличие взаимосвязи между пространственной структурой веществ, их растворимостью в воде и липидах, оптической активностью, с одной стороны, и биологическим действием — с другой. Например, такие простые вещества, как двухатомные фенолы, отличаются по токсичности. Менее токсичен из них мета-изомер (резорцин). Биологическое действие зависит от цис-транс-изомерии, трео-эритро-изомерии, оптической изомерии. Оптические изомеры, обладая одинаковым химическим строением и физическими свойствами, исключая лишь направление вращения плоскости поляризованного луча, имеют разную биологическую активность, причем иногда даже противоположную. Чаще всего один из энантиомеров, называемый эутомером, имеет выраженную фармакологическую активность одного вида, а другой энантиомер — дистомер — неактивен. Примером могут служить лекарственные вещества, имеющие в молекуле асимметрический атом углерода. Среди них более 90% адреномиметиков, адреноблокаторов, антикоагулянтов и противоэпилептических средств, более 50 % антигистаминных и местноанестезирующих средств и 20—25 % других лекарственных веществ. Более высокой биологической активностью обладают левовращающие изомеры (гиосциамин в 40 раз, адреналин в 17 раз, тироксин в 4 раза активнее правовращающих антиподов). В других случаях (стероиды, антибиотики) активнее правовращающие изомеры, значительно реже (камфора) оптическая изомерия не влияет на фармакологическую активность. Нередко наблюдается одновременное воздействие различных типов изомерии на фармакологический эффект. Так, из нескольких изомеров пилокарпина наибольшим фармакологическим эффектом обладает правовращающий цис-изомер, а у левомицетина активен только левовращающий 1>-трео-изомер.
Приведенные примеры показывают, что у химика-фармацевта есть определенные предпосылки при выборе тех или иных соединений и функциональных групп при создании нового препарата, однако это будут только ориентировочные наметки, которые далеко не всегда совпадают с поставленной целью.
Зависимость фармакологического действия лекарственных веществ от некоторых физических и химических свойств. Следует заметить, что химическая структура далеко не единственный фактор, влияющий на фармакологическую активность лекарственного вещества. Если даже выбрана оптимальная химическая структура, важно, чтобы лекарственное средство могло быть перенесено к месту действия и поставлено в условия, необходимые для взаимодействия с биологическим субстратом. А для этого надо, чтобы оно обладало определенным комплексом физических и химических свойств, обеспечивающих его распределение в организме, поскольку биологический ответ организма на данное вещество зависит от очень многих факторов: проникновения вещества через липидный слой, транспорта, процессов адсорбции, ионизации, комплексообразования, метаболизма и др., а это уже зависит от физико-химических свойств вещества.
Биологический ответ организма на вещество прежде всего зависит от его растворимости. Растворимость обусловливает распределение вещества в организме и во многом определяет фармакологические свойства препаратов, так как она существенно влияет на проникновение лекарственного вещества из кишечника в кровь (на всасывание, фильтрацию, диффузию и др.), обеспечивая определенную биодоступность вещества.
При синтезе лекарственных веществ определенную ориентировку может дать установленная закономерность на воздействие тех или иных радикалов (атомных групп) на гидрофильность или гидрофобность (липофильность) вещества. Выяснено, что сродство к воде уменьшается при введении радикалов в такой последовательности: карбоксильная -» гидроксильная -> альдегидная -> кетогруппа -> аминогруппа -> амидогруппа -> имидогруппа (гидрофильные группы) и метил -» метилен -^ этил -> пропил -> алкил -> фенил (гидрофобные радикалы).
Большинство жизненно важных систем организма функционирует в водной среде или включает воду, и эта среда представляет определенные требования к структуре лекарственных веществ, молекулы которых должны обладать гидрофильно-гидрофобными свойствами. Последние определяют возможность их распределения между водой и липидами и, следовательно, взаимодействия с ферментами и рецепторами. В этой связи была предпринята попытка систематизировать лекарственные вещества с учетом зависимости между их гидрофобностью и фармакологической активностью. Параметром гидрофобности является логарифм коэффициентов распределения лекарственных веществ в системе «октанол-вода» (lgP). Этот параметр известен для многих лекарственных веществ. Так, интервал варьирования величины lgP зависит от типа действия той или иной группы лекарственных веществ и имеет среднее значение у противомалярийных — 4,5; снотворных — 1,33; анальгетиков — 0,83; адреномиметиков — 0,43; антибиотиков — 0,27; сульфаниламидов — 0,13 и т. д. Следовательно, противомалярийные средства относятся к чрезвычайно гидрофобным веществам, снотворные — к высокогидрофобным и т. д. Подобным образом можно систематизировать все известные фармакологические группы.
Важное значение имеет растворимость лекарственного вещества в липидах, а также коэффициент его распределения между водой и липидами. Этот фактор обусловливает проникновение лекарственного вещества через мембраны к клеткам тканей. При этом проникновение вещества в клетку происходит двумя путями: один из них
— проникновение молекул водорастворимых веществ и ионов через субмикроскопические (диаметром 0,7-1 нм) заполненные водой поры, пронизывающие протоплазму; второй путь — растворение лекарственных веществ в липидах, которые входят в состав протоплазмы, особенно ее поверхностного слоя. По этому пути осуществляется транспорт лекарственных веществ, нерастворимых в воде, но растворимых в липидах.
Фармакологическая активность многих лекарственных веществ в значительной степени обусловлена блокированием функций ионных каналов в биомембранах. Это взаимодействие может быть представлено как перенос молекулы (части молекулы) вещества из водной среды в органическую фазу, которую представляет канальная система. Представления о ионных каналах как молекулярных мишенях для лекарственных веществ, а также относительной гидрофобности внутренней полости ионных каналов по сравнению с окружающей полярной средой позволяют коррелировать соотношение «структура
— активность» для данного класса органических молекул. Это дает возможность предсказать эффективность данной группы соединений и вести направленный синтез биологически активных веществ, а также исследовать их влияние на организм.
На скорость всасывания лекарственного вещества влияет и рН среды. Ионы водорода и гидроксила практически не могут проникать в клетки. Препятствием служит их высокая реакционная способность, взаимодействие с концевыми химическими группами, локализованными на поверхности клетки. Исходя из этого, изменяя рН среды при пероральном введении лекарств, можно увеличивать или уменьшать число недиссоциированных молекул и таким образом усиливать или ослаблять процесс проникновения лекарственных препаратов в клетку.
На активность лекарств влияет и молекулярная масса. Например, алифатические соединения (углеводороды и спирты) по мере увеличения молекулярной массы снижают свою активность и токсичность. Полимеры в зависимости от молекулярной массы нередко настолько меняют свое фармакологическое действие, что оно становится противоположным действию исходных мономеров.
Фармакокинетические свойства лекарственных веществ, такие как липофильность, гидрофобность, растворимость прямо или косвенно зависят в растворах от поверхностного натяжения, которое имеет своей основой некомпенсированное взаимодействие между молекулами жидкости, образующими ее поверхностный и ближайший к нему слой. Это приводит к появлению избыточной свободной энергии у молекул поверхностного слоя, которая воздействует не только на физико-химические параметры, но и на биологическую активность. Установлена, например, корреляция между поверхностным натяжением и наркотическим действием некоторых веществ.
Понятно, что каждый из перечисленных факторов сам по себе не является определяющим в фармакологическом действии лекарств. Они находятся во взаимосвязи, установление которой требует колоссальной работы, но позволяющей более целенаправленно управлять синтезом лекарственных веществ.
Пути изыскания и аспекты поиска новых лекарственных веществ. Ведущие направления создания новых лекарственных веществ — исследования в области модификации структуры известных природных соединений. Классический пример — синтез ряда новых анестетиков (анестезин, новокаин, дикаин) на основе глубокого изучения структуры природного алкалоида — кокаина. Таким путем синтезированы новые нитрофураны и некоторые другие соединения.
При разработке новых активных веществ нередко используют способ получения лекарств-предшественников путем присоединения к активной форме группы носителя через различные формы связи (ионная, ковалентная, водородная, комплексная). Носителем может быть сахароза (сердечные гликозиды), пировиноградная кислота, которая является физиологическим компонентом и ее освобождение безвредно для организма.
Определенное значение при синтезе новых лекарственных веществ имеет изучение их метаболизма в организме. Установлено, что возможность создания лекарственных веществ, не образующих метаболиты, неперспективна, так как большинство ксенобиотиков изменяются, метаболизируют в организме. Поэтому целесообразно получать вещества (по известным структурным аналогам) с предсказуемым метаболическим превращением, в результате которого будут образовываться нетоксичные метаболиты. Одновременно с этим можно запрограммировать появление у вещества активно действующего метаболита, снижающего токсичность.
Весьма важным направлением поиска новых лекарственных веществ является исследование эндогенных физиологически активных соединений, синтезированных организмом для регуляции обмена веществ. Первым таким препаратом был адреналин, открытый еще в 1895 г. К настоящему времени выделено значительное количество эндогенных соединений, представляющих по химической структуре амины, аминокислоты, пептиды, глюкопротеиды, пурины и др. Они влияют на регуляцию нервных процессов, метаболизма, на иммунные реакции, рост тканей и другие жизненные функции организма. Эти соединения представляют интерес и в том плане, что, являясь «продуктами» организма, они родственны с ним в антигенном плане и не вызывают аллергических реакций. Кроме того, они, как правило, низкотоксичны. Изучение таких веществ открывает простор для синтеза аналогов, которые бы обладали более позитивными фармакологическими эффектами (эффективностью, специфичностью, избирательностью, безвредностью и т. д.).
В организме есть все вещества, регулирующие, а при патологиях корректирующие его жизнеобеспечение и, следовательно, оказывающие влияние на системы и органы. Ряд этих веществ уже выделен и синтезирован (гормоны, ферменты, медиаторы и др.), проявляющие стимулирующее, угнетающее, противовоспалительное, анальгетическое, иммуностимулирующее и др. виды действия. За этими эндофармпрепаратами и, конечно же, за многими другими, которые будут получены, — будущее. В этом направлении и работают многие НИИ и исследователи.
Аспекты поиска новых лекарств, изыскание новых лекарственных веществ состоит из трех основных этапов: химический синтез, установление фармакологической активности и безвредности (токсичности). Такая стратегия поиска с большой затратой времени, реактивов, животных, труда чрезвычайно малоэффективна. Например, эффект поиска биологически активных веществ составляет примерно около 0,01-0,02%, т. е. в среднем из 5000—10 000 синтезированных препаратов путевку в практику получает лишь одно лекарственное средство.
При этом используется эмпирический поиск (осуществляемый классическим методом проб и ошибок), при котором, исходя из эмпирически установленных закономерностей о влиянии различных функциональных групп на биологическую активность, осуществляется синтез ряда соединений, проводятся предварительные испытания, отбираются перспективные вещества, которые и подвергаются тщательной всесторонней проверке.
Существует направленный поиск, при котором конструирование лекарств осуществляется в предварительном теоретическом предсказании возможной биологической активности вещества на основе исследования ее связи с химической структурой. При этом поиск ведется с использованием методов математического моделирования с помощью банков данных, заложенных в ЭВМ.
К эмпирическому поиску относится и принцип модификации молекул, при помощи которого синтезирован ряд полусинтетических антибиотиков, анестетиков, противоопухолевых и других средств.
Все варианты эмпирического поиска объединяет метод скрининга (просеивания), выявляющий активные препараты из огромного числа потенциально биологически активных веществ как синтезированных, так и природных соединений. Метод скрининга постоянно совершенствуется и в настоящее время используется один из его вариантов —метод расчетного скрининга, позволяющий производить не только отсев неперспективных соединений, но и на основании изучения математической зависимости между химической структурой и биологическим действием дать рекомендации по направленному синтезу лекарственных веществ. При этом методе широко используются электронные вычислительные машины, что позволяет практически конструировать лекарственные вещества с заданными параметрами.
Доклинические и клинические испытания новых лекарственных средств. Существует общее правило: все доклинические и клинические испытания должны проводиться с образцами веществ, которые были предварительно подвергнуты тщательному контролю качества. При этом данные испытания проводятся в сравнительном аспекте с существующими наиболее эффективными аналогами.
Доклинические испытания включают проверку фармакологических, фармацевтических и токсикологических свойств испытуемого образца, по унифицированным тестам и методикам, утвержденным Фармакологическими комитетами (медицинским или ветеринарным). Они подразделяются на определении специфической активности вещества (фармакологические исследования) и его безвредности (токсикологические исследования). При определении специфической активности изучают влияние препарата на физиологические системы организма с целью установления фармакотерапевтического действия. В этой стадии испытаний предварительно устанавливают оптимальную дозу, схемы (курс) применения и способы введения. Токсикологические исследования позволяют выявить возможные побочные эффекты испытуемого вещества при тщательном изучении острой, подострой и хронической токсичности, а также установить возможные специфическую и неспецифическую токсичность и совместимость или, наоборот, несовместимость с другими лекарственными веществами.
Клинические испытания проводятся с ведома Департамента ветеринарии, разрешение на которые предварительно дает Фармсовет на основании проведенных доклинических исследований. Подробно эти вопросы изложены в разделе «Определение эффективности и токсичности лекарственных веществ».
1. ОСНОВЫ ФАРМАЦЕВТИЧЕСКОЙ ХИМИИ
1.1 ОБЩАЯ ФАРМАЦЕВТИЧЕСКАЯ ХИМИЯ
1.1.1 ПОЛУЧЕНИЕ И ИССЛЕДОВАНИЕ ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ
Источники и пути получения лекарственных веществ. Для получения неорганических лекарственных веществ используют минеральное сырье либо сами минералы, либо отдельные вещества.
Основными источниками синтетических органических веществ являются продукты сухой перегонки каменного угля, дерева, горючих сланцев и различных фракций нефти и газа. Переработкой этих видов сырья занимается коксохимическая, лесохимическая и нефтеперерабатывающая промышленности. Продукты переработки широко используют в самых различных отраслях народного хозяйства, в том числе и в фармацевтической промышленности.
Значительное количество лекарственных веществ получают из каменноугольной смолы, которая представляет собой смесь, включающую более 400 различных ароматических и гетероциклических соединений. С помощью ректификационных колонок каменноугольную смолу разделяют на фракции, содержащие основные продукты и установленные температурные интервалы (пределы выкипания), после чего каждую фракцию перегоняют в более узком температурном интервале, выделяя индивидуальные вещества. Для их очистки используют адсорбцию, обработку серной кислотой (сульфирование), щелочами (выделение фенолятов) и т. д. Выделенные индивидуальные вещества служат исходными продуктами для синтеза различных органических веществ, в том числе лекарственных препаратов.
Примерно аналогично перерабатывают древесину, которая при сухой перегонке образует древесный уголь и две фракции жидкостей. Одна из них содержит метиловый спирт, ацетон и уксусную кислоту, а другая (древесный деготь) — фенолы и ряд органических веществ. Древесина является также источником получения фурфурола, из которого синтезируют нитрофураны.
Многие лекарственные средства, используемые в медицине и ветеринарии, имеют растительное происхождение (более 40%). Эти вещества, как правило, обладают низкой токсичностью и незначительными побочными эффектами при длительном применении. По данным ВОЗ, в 73 странах мира для лечебных целей применяют около 10 000 видов лекарственных растений, но в официальные издания 38 стран входит только 1884 вида. В 1978 г. в ВОЗ был издан «Перечень наиболее широко используемых во всем мире видов лекарственных растений», в который вошло 235 наименований. У нас применяют около 200 видов растений и получают из них более 100 лекарственных веществ, в том числе около 50 алкалоидов и 20 сердечных гликозидов. Само растительное сырье (листья, цветки, семена, плоды, корни, корневища растений) также может быть использовано в форме настоек, настоев, отваров, сборов при многих болезнях. Кроме того, из этого сырья выделяют эфирные и жирные масла, смолы, белки, углеводы, которые либо прямо используют как лекарственные средства, либо в качестве исходного сырья для их получения. Растительное сырье является источником получения природных биологически активных веществ: алкалоидов, терпенов, гликозидов, витаминов.
Сырье животного происхождения (органы, ткани, железы убойного скота) является источником получения индивидуальных веществ — гормональных препаратов.
С помощью микроорганизмов получают ценнейшие лекарственные средства — антибиотики, до сих пор не имеющие себе равных по частоте и глобальности применения их в медицине и ветеринарии.
В последнее время для получения лекарственных веществ стали использовать гидробионтов (морских организмов). Они являются носителями азотсодержащих алифатических веществ, галогенсодержащих соединений ароматического ряда (производных бензола), гетероциклических производных, полиеновых кислот, терпеноидов, микроэлементов, витаминов, иммуностимуляторов и др. веществ. Использование гидробионтов для получения лекарственных веществ весьма перспективно.
Однако синтез лекарственных веществ — важнейшая составная часть фармацевтической химии. С помощью органического синтеза получают ряд природных биологически активных веществ (БАВ): алкалоиды (атропин, кофеин), витамины (кислота никотиновая), антибиотики (левомицетин) и др.
С помощью частичного синтеза (полусинтеза) получают многие лекарственные вещества — синтетические аналоги алкалоидов, витаминов, продукты гидролиза гликозидов, полусинтетические антибиотики, а также аналоги андрогенных, гестагенных, эстрогенных гормонов, анаболические стероидные препараты и др.
В то же время сложность технологических процессов, многостадийность синтеза вызывают необходимость разработки рациональных схем направленного синтеза. Определенное значение в решении этой проблемы имеет изучение биогенеза природных соединений, происходящего в живой клетке через образование метаболитов и конъюгатов.
Использование достижений в области физиологии микроорганизмов позволило целенаправленно осуществлять микробиологический синтез ферментов, витаминов и других биологически активных веществ.
Процесс синтеза — сложный стадийный процесс (иногда до 10— 20 стадий и более), который по типу химических реакций можно разделить на три основные группы: реакции замещения, превращения (преформации) заместителей и окисления-восстановления. Суть этих реакций сводится к следующему.
Реакции замещения основаны на замещении атомов водорода в алифатической цепи, ароматическом гетероциклическом ядре или функциональной группе различными заместителями. Эти реакции используют для того, чтобы придать синтезированному веществу какие-либо новые свойства или получить промежуточный продукт со свойствами, необходимыми для его дальнейшего превращения в лекарственное вещество. В этих целях используют реакции сульфирования, когда атом водорода замещается сульфогруптюй SO3H, или сульфохлорирования (процесс происходит при взаимодействии 4—5-кратного избытка хлорсульфоновой кислоты с ароматическими углеводородами); реакцию нитрирования — процесс замещения атома водорода в органическом соединении нитрогруппой; реакцию галоге-нирования, которая в зависимости от природы исходных веществ может протекать либо как реакция замещения атома водорода, либо как реакция присоединения; реакцию конденсации, сопровождающуюся отщеплением молекулы воды или спирта (классический пример реакции конденсации альдегидов — синтез гексаметилентетрамина из формальдегида и аммиака); реакцию нейтрализации для получения солей алифатических, ароматических и гетероциклических кислот с использованием гидроксидов или карбонатов щелочно-земельных металлов.
Реакции превращения (преформации) заместителей основаны на химических превращениях заместителей, имеющихся в молекуле промежуточного продукта, с целью придать ему новые свойства или изменить его реакционную способность. Для этого используют реакции присоединения и элиминирования (отщепления). Реакции присоединения присущи карбонильным соединениям. При этом происходит процесс взаимодействия непредельных соединений с другими элементами и веществами, в результате которого происходит разрыв непредельных связей с одновременным присоединением соответствующих заместителей. Элиминирование — процесс обратный присоединению. Он происходит, например, при образовании непредельных соединений.
Реакции оксилирования и аминирования применяют для введения в молекулу органического соединения окси- и аминогрупп. Эти реакции протекают по механизму нуклеофильного замещения.
Получение промежуточных продуктов синтеза лекарственных веществ часто осуществляют реакциями нитрозирования, диазотирова-ния и превращения диазосоединений.
Часто используют реакции алкилирования и ацилирования двух типов. Один из них присущ углеводородам (С-алкилирования, С-ацилирования), другой — амино- и оксисоединениям. Ароматические соединения алкилируются галогеналканами или непредельными соединениями в избытке алкилируемого бензола или в безводном нитробензоле. Пример С-ацилирования — получение салициловой кислоты. Своеобразной разновидностью химического процесса алкилирования и ацилирования оксисоединений являются реакции получения простых и сложных эфиров (реакции этерификации и гидролиза эфиров). Иногда (например, в производстве новокаина) используют реакцию переэтерификации, которая представляет собой процесс превращения одного сложного эфира в другой.
Реакции окисления-восстановления — единый процесс, в результате которого одна группа атомов окисляется. В окислительно-восстановительных реакциях изменяется не только степень окисления, но и состав молекулы. Процесс восстановления используют для гидрирования непредельных и ароматических соединений, восстановления нитро- и нитрозосоединений до аминосоединений и т. д. Процесс окисления имеет важное значение для получения кислот из соответствующих ароматических или гетероциклических ал-килпроизводных. В качестве окислителя обычно используют кислород, а также богатые кислородом соединения: дихромат калия, диоксид марганца, перманганат калия, пероксид водорода, азотную кислоту и др.
Биотехнологические методы получения лекарственных веществ. Как известно, объектами биотехнологии являются культивируемые ткани и клетки животных и растений (высших организмов), а также микроорганизмы, созданные методами генной инженерии, т. е. путем переноса генетического материала от одних организмов к другим, в том числе и от высших к одноклеточным. Понятие «клеточной инженерии» включает использование либо самих культивируемых клеток„либо различные манипуляции с ними для создания новых технологий и даже целых организмов. По поводу последних достижений «клеточной инженерии» многие ученые и общественность выступают против. Что же касается лекарственных веществ, то биотехнология и ее новейшие направления обеспечивают самые прогрессивные методы их получения.
Лекарственные вещества из растительного и животного сырья. Для получения лекарственных средств из известных и перспективных растений их подвергают химическим исследованиям. Изучают процесс накопления БАВ в зависимости от фаз вегетации, климатических, сезонных и суточных изменений. Это позволяет выбирать оптимальные условия выращивания или заготовки дикорастущего лекарственного растительного сырья. Затем разрабатывают оптимальные условия выделения суммы и последующего разделения БАВ. Следует отметить, что, несмотря на наличие новых технологических приемов и использование современных физико-химических методов, выделение БАВ из растительного и животного сырья, их разделение и очистка представляют собой весьма сложную задачу. Этот процесс состоит в основном из следующих стадий: измельчение исходного сырья, приведение его в тесный контакт с растворителем, отделение экстракта от сырья, выделение и очистка БАВ. Экстракция природных веществ из сырья может быть осуществлена либо извлечением комплекса содержащихся в нем соединений с последующим разделением на отдельные компоненты, либо последовательной экстракцией отдельных соединений или их класса. Обычно в растениях содержится несколько биогенетически связанных соединений, сходных по химической структуре и свойствам, что значительно усложняет задачу. Поэтому чаще всего извлекают сумму БАВ с примесью сопутствующих соединений, содержащихся в природном сырье. При этом необходимо учитывать возможность разрушения активных веществ применяемыми экстрагентами.
Другая трудность выделения БАВ состоит в том, что основную массу растительного сырья составляют клетчатка, белки, хлорофилл, смолы, слизи, дубильные и другие вещества, от которых весьма сложно отделить необходимые активные вещества. Для этих целей широко используют различные варианты экстракции (непрерывная, полунепрерывная, реэкстракция и др.), а также более современные методы разделения, например, метод многократного фракционного экстрагирования или метод противоточного экстрагирования, а также электрофорез, диализ, позволяющие разделять сложные смеси высокомолекулярных веществ.
Учитывая возрастающие потребности фармацевтической промышленности в БАВ, полученных из растительного сырья, и снижение запасов лекарственных растений, с одной стороны, их загрязнение отходами различных производств, с другой, появилось новое направление — получение активных веществ из культуры растущих растительных клеток. При росте на питательных средах клетки синтезируют те же БАВ, что и в природных условиях, однако для этого необходимо создать определенные параметры, поскольку способность синтеза БАВ в искусственных условиях снижается. Тем не менее это весьма перспективное направление, особенно для культур клеток, растения которых не растут в наших климатических условиях. Ценным в этом направлении является и то, что в перспективе в питательные растворы можно вносить активные компоненты, которые будут усваивать клетки и синтезировать из них более активные вещества.
Методы установления структуры органических лекарственных веществ. Определение химической структуры лекарственного вещества — обязательный этап исследований, которые начинают с получения гомогенного (высокой степени чистоты) образца. Очистка от примесей достигается путем разделения жидкой и твердой фаз, а также перегонкой сублимацией (возгонкой, многократной перекристаллизацией вещества из различных растворителей). Для этой же цели широко используют различные виды хроматографии, электрофорез и ионофорез, противоточное и полибуферное распределение, метод зонной плавки.
После разделения и очистки устанавливают физические свойства индивидуальных веществ: температуру плавления (разложения) и кипения, плотность, вязкость и др. Определяют такие константы, как показатель преломления, удельное вращение, ультрафиолетовый и инфракрасный (УФ и ИК) спектры. Указанные свойства и константы не должны изменяться при повторной очистке. Затем устанавливают его эмпирическую формулу и молекулярную массу. Эмпирическую формулу устанавливают с помощью элементарного анализа, основанного на обнаружении и количественном определении углерода, водорода, кислорода, азота и других элементов в органических соединениях. Для определения молекулярной массы в зависимости от свойств испытуемого вещества пользуются физическими методами, такими, как эбулиоскопический, криоскопический, изотермический, дистилляция, газометрический. Если исследуемое соединение представляет собой кислоту или основание, то применяют также химический метод.
Сущность эбулиоскопического метода состоит в измерении разности температур кипения чистого растворителя и раствора исследуемого вещества в том же растворителе.
Криоскопическое определение основано на изменении температуры плавления растворителя, вызванном растворением в нем исследуемого вещества.
Метод изометрической дистилляции заключается в установлении равновесия молярных концентраций двух веществ в сообщающихся сосудах перегонкой растворителя при определенной температуре.
Газометрический метод используют для определения молекулярной массы у веществ, которые не разлагаются при переходе в парообразное состояние. Кроме того, для определения молекулярной массы используют вискозометрию, осмометрию, измерение светорассеяния и седиментационный анализ.
Для установления структуры жидких органических веществ определяют молярный объем, представляющий собой отношение молярной массы к плотности жидкости при температуре кипения. Аддитивную величину для жидкости представляет также свойство, называемое парахором. Парахор рассчитывают с помощью коэффициента поверхностного натяжения жидкости и плотности ее паров. Известны значения атомных парахоров элементов (углерода, водорода, азота, кислорода, фосфора, серы, галогенов); парахоров двойной, тройной связи, а также трех-, четырех-, пяти- и шестичленных циклов.
Следует отметить методы изотопного анализа, которые все шире применяют вместо элементарного анализа или в сочетании с ним. Они основаны на сжигании смеси исследуемого и меченого веществ.
Меченое вещество содержит тяжелый изотоп анализируемого элемента. Например, для определения в исследуемом соединении углерода 13С или 14С, его превращают в 13СО2 или ИСО2 сжиганием. Затем соотношение изотопов определяют методом ИК спектроскопии, масс-спектрометрии и др. Аналогично поступают при определении водорода и кислорода. Можно использовать и радиоактивные изотопы. Разрушение вещества проводят так же, как и при использовании стабильных изотопов; их радиоактивность устанавливают с помощью счетчика Гейгера—Мюллера и ионизационной камеры или сцинтилляционных детекторов.
Исследуемое вещество может оказаться идентичным описанным ранее, либо вообще неизвестной химической структуры, поэтому весьма важны исследования по идентификации данного вещества, которые проводят различными химическими и физико-химическими методами. Обычно после изучения физических констант, брутто-фор-мулы, молекулярной массы устанавливают наличие тех или иных функциональных групп и сопоставляют полученные результаты с описанными соединениями, имеющими аналогичные параметры. Если соответствующего соединения не окажется, то устанавливают структуру вещества.
Химические методы установления структуры. В функциональном анализе используют способы количественного определения подвижного водорода в группах -ОН, -SH, -СООН, -SOjH, -CONHR, -NHR, -С =СН; способы определения О-, S-, N-, С-алкильных, О- и N-ацильных групп. Кроме того, химические методы позволяют определить двойные связи, карбонильные группы, а также карбоновые кислоты, ангидриды, лактоны и сложные эфиры. Точность химических методов вполне достаточна для выяснения числа одинаковых функциональных групп, содержащихся в исследуемых соединениях. Одновременно с этим могут использоваться и другие химические реакции (окисления-восстановления, нейтрализации, конденсации, присоединения, диазотирования, ацетилирования, этерификации и др.). Большое значение имеет реакция гидролизации, которую особенно широко используют при исследовании белков и полипептидов, а также для определения химического строения веществ, представляющих собой сложные эфиры, уретаны, уреиды и др.
Как видно, химические методы дают возможность идентифицировать и количественно определить ряд функциональных групп в органическом соединении неизвестной структуры. Однако эти методы имеют вспомогательное значение в исследовании химической структуры органических соединений.
Физико-химические методы. Они не только сокращают время исследования, но по сравнению с химическими методами дают принципиально новую информацию о структуре и свойствах исследуемых соединений. Так, например, при установлении химической структуры органических соединений важные сведения можно получить, изучая взаимодействие вещества с электромагнитным излучением, которое происходи в широком интервале частот от радиоволны до у-излучения (длина волны от 100 до 10"11 см). Электромагнитное излучение является следствием изменения энергии молекулы, которая определяется соотношением:
![]()
где д£ - изменение энергии системы; Ек - энергия системы в конечном состоянии; Е^ - энергия системы в начальном состоянии; h - постоянная Планка; V - частота излучения.
Если энергия конечного состояния (Ек) выше энергии начального состояния (£н), то происходит поглощение энергии, что соответствует спектрам поглощения. И наоборот, если Еп>Ек, то происходит излучение энергии, что соответствует спектрам излучения. Как правило, электромагнитное излучение характеризуют волновыми параметрами, которые выражаются длиной волны Х(нм) или частотой колебания К (см1). Они связаны между собой уравнением X=c/V, где с — скорость света.
Электромагнитный спектр характеризуется различными типами излучения (различная длина волны).
Для структурных исследований используют абсорбционные методы или методы, основанные на поглощении излучения (спектроскопия в УФ-, видимой и ИК-областях, спектроскопия комбинационного рассеивания); методы, основанные на использовании магнитного поля (ЯМР-, ЭПР-,ЯКР*-спектроскопия и масс-спектрометрия); методы, основанные на поглощении и дифракции рентгеновского излучения.
*ЯМР — ядерно-магнитный резонанс;
ЭПР — электронный парамагнитный резонанс;
ЯКР — ядерный квадрупольный резонанс.
Установление химической структуры вещества. Делается оно на основе комплексного использования данных, полученных несколькими методами. Такой подход обеспечивает большую достоверность результатов исследований. Так, для установления молекулярной формулы используют элементарный и изотопный анализы и различные методы определения молекулярной массы: физические (эбулиоскопия, криоскопия, газометрия, изотермическая дистилляция) или физико-химические (масс-спектрометрия, дифракция рентгеновского излучения). Химические методы позволяют качественно и количественно определить подвижный водород, наличие двойных связей и ряда функциональных групп. Эти результаты затем подтверждают ИК спектроскопией. УФ спектроскопия дает возможность установить тип хромофора (если в молекуле имеются насыщенные связи), подтвердить наличие цис-, транс- и других видов изомерии. Характер и интенсивность УФ спектров поглощения дают информацию о том, к какому классу относится исследуемое вещество. Такими методами исследований, как ЯМР, ЭПР, ЯКР, масс-спектронный и рентгеновский дифракционный анализы, можно подтвердить наличие взаимосвязи функциональных групп и атомов в молекуле. Спектр ЯМР позволяет установить распределение атомов в молекуле водорода, а изучение фрагментации в масс-спектре — положение гетероатомов и наличие атомных групп, претерпевающих потерю фрагмента.
Существует положение, что химическую структуру можно считать установленной, если определены вид, число атомов и соединяющие их химические связи, а также доказано пространственное расположение атомных групп в молекуле (установлена конфигурация и конформация молекулы). Подтверждением установленной структуры является встречный химический синтез исследуемого соединения, которое подвергают затем сравнительной оценке с помощью тех же методов.
1.1.2 МЕТОДЫ ФАРМАЦЕВТИЧЕСКОГО АНАЛИЗА
Фармацевтический анализ — основа фармацевтической химии. Это — наука о химической характеристике и измерении БАВ на всех этапах производства (от контроля сырья до оценки качества полученных лекарств), изучения их стабильности, установления срока годности и стандартизации готовой лекарственной формы. Фармацевтический анализ имеет свои особенности, отличающие его от других видов анализа. Они заключаются в том, что анализу подвергают вещества различной химической природы: неорганические, элементоорганические, радиоактивные, органические соединения от простых алифатических до сложных природных БАВ. Чрезвычайно широк диапазон концентраций анализируемых веществ. Объектами фармацевтического анализа являются не только индивидуальные лекарственные вещества, но и смеси, содержащие различное число компонентов.
Ежегодное пополнение арсенала лекарственных средств вызывает необходимость разработки новых способов их анализа. Способы фармацевтического анализа нуждаются в систематическом совершенствовании и в связи с непрерывным повышением требований к качеству лекарственных средств, причем растут требования как к степени чистоты лекарств, так и к количественному содержанию в них БАВ. Вот почему к фармацевтическому анализу предъявляют высокие требования. Он должен быть достаточно специфичен и чувствителен, точен по отношению к нормативным требованиям ГФ X и XI и другой НТД (ФС, ВФС), выполняться в короткие промежутки времени с использованием минимальных количеств испытуемых препаратов и реактивов.
В зависимости от поставленных задач фармацевтический анализ включает различные формы контроля качества лекарств: фармакопейный анализ; постадийный контроль производства лекарственных средств; анализ лекарственных форм индивидуального приготовления; экс пресс-анализ в условиях аптеки и биофармацевтический анализ. Составной его частью является фармакопейный анализ, который представляет собой совокупность способов исследований лекарственных препаратов и лекарственных форм, изложенных в ГФ или другой НТД (ВФС, ФС). На основании результатов, полученных при выполнении фармакопейного анализа, делается заключение о соответствии лекарственного средства требованиям ГФ или другой НТД. При отклонении от этих требований лекарство не допускается к применению.
Заключение о качестве лекарственного средства делают на основании анализа пробы (выборки). Порядок ее отбора указан либо в частной статье, либо в общей статье ГФ XI (вып. 2), либо в соответствии с требованиями, изложенными в частных статьях или инструкциях по контролю, утвержденных МЗ РФ или Департамента ветеринарии РФ. Отбор проб производится только из неповрежденных укупоренных и упакованных в соответствии с требованиями НТД упаковочных единиц. При этом необходимо строго соблюдать особые меры предосторожности при работе с наркотическими и ядовитыми лекарственными средствами, а также с токсичными, огнеопасными, взрывоопасными, гигроскопичными и другими лекарствами. Для испытания на соответствие требованиям НТД проводят многоступенчатый отбор проб. Число ступеней определяется видом упаковки. На последней ступени (после контроля по внешнему виду) берут пробу в количестве, необходимом для четырех полных физико-химических анализов (если пробу отбирают для контролирующих организаций, то на шесть таких анализов).
Из расфасовки «ангро» берут точные пробы, взятые в равных количествах из верхнего, среднего и нижнего слоев в каждой упаковочной единице. После установления однородности все эти пробы смешивают. Сыпучие и вязкие лекарственные средства отбирают пробоотборником, изготовленным из инертного материала. Жидкие лекарственные формы перед отбором проб тщательно перемешивают. Если это сделать затруднительно, то отбирают точечные пробы из разных слоев. Отбор выборок готовых лекарственных средств осуществляют в соответствии с требованиями НТД.
Фармакопейный анализ позволяет установить подлинность лекарственного средства, его чистоту, определить количественное содержание фармакологически активного вещества или ингредиентов, входящих в состав лекарственных форм. И несмотря на то что каждый из этих этапов имеет свою конкретную цель, их нельзя рассматривать изолированно. Они взаимосвязаны и взаимно дополняют друг друга. Так, например, температура плавления, растворимость, рН среды водного раствора и т. д. являются критериями как подлинности, так и чистоты лекарственного вещества.
Для обобщения большого объема частных сведений по фармакопейному анализу, изложенному в ФС (ВФС) и технических условиях (ТУ), целесообразно рассмотреть основные критерии фармацевтического анализа и общие принципы испытаний на подлинность, чистоту и количественное определение лекарственных веществ.
Критерии фармацевтического анализа. В зависимости от поставленных задач на различных этапах фармацевтического анализа имеют значение такие критерии, как избирательность, чувствительность, точность, время, затраченное на выполнение анализа, израсходованное количество анализируемого препарата (лекарственной формы) и реактивов.
Избирательность метода очень важна при проведении анализа смесей веществ, так как дает возможность получать истинные значения каждого из компонентов. Только избирательные методики анализа позволяют определять содержание основного компонента в присутствии продуктов разложения и других примесей.
Точность и чувствительность анализа зависят от объекта и цели исследования. При испытании степени чистоты препарата используют методики, отличающиеся высокой чувствительностью, позволяющие устанавливать минимальное содержание примесей.
Фактор времени играет важную роль при выполнении постадийного контроля производства и при проведении экспресс-анализа в аптеке.
Мерой чувствительности реакций является предел обнаружен и я. Он означает наименьшее содержание, при котором по данной методике можно обнаружить присутствие определяемого компрнента с заданной доверительной вероятностью. Термин «предел обнаружения» учрежден вместо понятия — открываемый минимум. Им пользуются также взамен термина «чувствительность». На предел обнаружения влияют такие факторы, как объем растворов реагирующих компонентов, концентрация реактивов, рН среды, температура, продолжительность опыта. Это следует учитывать при разработке методик качественного фармацевтического анализа.
Для установления чувствительности реакций все шире используют показатель поглощения (удельный или молярный), устанавливаемый спектрофотометрическим методом. В химическом анализе чувствительность устанавливают по величине предела обнаружения данной реакции.
Высокой чувствительностью отличаются физико-химические методы анализа. Наиболее высокочувствительны радиохимические и масс-спектральный методы, позволяющие определить 10-8—10~9 % анализируемого вещества, а также полярографические и флуориметрические — Ю~6—10"9 %. Чувствительность спектрофотометрических методов — 10~3— Юь% , потенциометрических — 10*2%.
Точность анализа включает одновременно два понятия — воспроизводимость и правильность полученных результатов: воспроизводимость характеризует рассеивание результатов анализа по сравнению со средним значением; правильность отражает разность между действительным и найденным содержанием вещества. Точность анализа у каждого метода различна и зависит от многих факторов: калибровки измерительных приборов, точности отвешивания или отмеривания, опытности аналитика и т. д. Точность результата анализа не может быть выше, чем точность наименее точного измерения. Так, при вычислении результатов титриметрических определений наименее точная цифра — количество миллилитров титрата, израсходованного на титрование.
В современных бюретках в зависимости от класса их точности максимальная ошибка отмеривания около ±0,02 мл. Ошибка от натекания тоже равна ±0,02 мл. Если при указанной общей ошибке отмеривания и натекания ±0,04 мл на титрование расходуется 20 мл титрата, то относительная ошибка составит 0,2 %. При уменьшении навески и количества миллилитров титрата точность соответствия уменьшается. Таким образом, титриметрическое определение можно выполнять с относительной погрешностью ±(0,2—0,3%). Точность титриметрических определений можно повысить, если пользоваться микробюретками, применение которых значительно уменьшает ошибки от неточного отмеривания, натекания и влияния температуры. Погрешность допускается только при взятии навески.
Получение навески при выполнении анализа лекарственного вещества осуществляют с точностью до 0,2 мг. При взятии обычной для фармакопейного анализа навески препарата 0,5 г и точности взвешивания ±0,2 мг относительная ошибка будет равна 0,4 %. При выполнении экспресс-анализа лекарственных форм такая точность не требуется, поэтому навеску берут с точностью ±(0,001—0,01 г), т. е. с определенной относительной ошибкой 0,1—1 %. Это можно отнести и к навеске для колориметрического анализа, точность которой ±5 %.
При выполнении количественного анализа любым физическим или физико-химическим методом могут быть допущены три вида ошибок: грубые (промахи), систематические (определенные) и случайные (неопределенные).
Грубые ошибки— результат просчета наблюдателя при выполнении какой-либо из операций определения или неправильно выполненных расчетов. Результаты с грубыми ошибками отбрасываются как недоброкачественные.
Систематические ошибки отражают правильность результатов анализа. Они искажают результаты измерений обычно в одну сторону (положительную или отрицательную) на некоторое постоянное значение. Причиной систематических ошибок в анализе могут быть, например, гигроскопичность препарата при отвешивании его навески, несовершенство измерительных и физико-химических приборов, недостаточная опытность аналитика и др. Систематическую ошибку можно частично устранить внесением поправок так, чтобы она была соизмерима с ошибкой прибора и не превышала случайной ошибки.
Случайные ошибки отражают воспроизводимость результатов анализа. Они называются неконтролируемыми переменными.
Среднее арифметическое случайных ошибок стремится к нулю при постановке большого числа опытов в одних и тех же условиях. Поэтому для расчета необходимо использовать не результаты единичных измерений, а средние из нескольких параллельных определений.
Правильность результатов определений выражают абсолютной и относительной ошибкой.
Абсолютная ошибка представляет собой разность между полученным результатом и истинным значением. Эта ошибка выражается в тех же единицах, что и определяемая величина (граммах, миллилитрах, процентах).
Относительная ошибка определения равна отношению абсолютной ошибки к истинному значению определяемой величины. Выражают относительную ошибку обычно в процентах (умножая полученную величину на 100). Относительные ошибки определений физико-химическими методами включают как точность выполнения подготовительных операций (взвешивания, отмеривания, растворения), так и точность выполнения измерений на приборе (инструментальная ошибка). Значения относительных ошибок находятся в зависимости от того, каким методом выполняется анализ и что собой представляет анализируемый объект — индивидуальное вещество или многокомпонентная смесь. Индивидуальные вещества можно определять при анализе спектрофотометрическим методом в ультрафиолетовых и видимых областях с относительной погрешностью ±(3—3,5) %, полярографией ±(2—3) % , потенциометрией ±(0,3—1) %.
При анализе многокомпонентных смесей относительная погрешность определения этими методами возрастает примерно в 2 раза. Сочетание хроматографии с другими методами, в частности использование хроматооптических и хроматоэлектрохимических методов, позволяет выполнять анализ многокомпонентных смесей с относительной погрешностью ±(3—7) %.
Точность биологических методов намного ниже, чем химических и физико-химических. Относительная ошибка биологических определений достигает 20—30 % и даже 50 %. Для повышения точности в ГФ XI введен статистический анализ результатов биологических испытаний.
В то же время относительная ошибка может быть уменьшена за счет увеличения числа параллельных измерений. Однако эти возможности имеют определенный предел. Уменьшать случайную ошибку измерений, увеличивая число опытов, целесообразно до тех пор, пока она станет меньше систематической. Обычно в фармацевтическом анализе выполняют 3—6 параллельных измерений. При статистической обработке результатов определений с целью получения достоверных результатов выполняют не менее семи параллельных измерений.
Общие принципы испытаний подлинности лекарственных веществ. Испытание на подлинность — это подтверждение идентичности анализируемого лекарственного вещества (лекарственной формы), осуществляемое на основе требований ГФ или другой НТД. Испытания выполняют физическими, химическими или физико-химическими методами. Непременное условие объективного испытания подлинности лекарственного вещества — идентификация тех ионов и функциональных групп, входящих в структуру молекул, которые обусловливают фармакологическую активность. С помощью физических и химических констант (удельного N вращения, рН среды, показателя преломления, УФ и ИК спектра) подтверждают и другие свойства молекул, оказывающие фармакологическое влияние. Применяемые в фармацевтическом анализе химические реакции сопровождаются образованием окрашенных соединений, выделением газообразных или нерастворимых в воде соединений. Последние можно идентифицировать по температуре плавления.
Физические методы установления подлинности. Они основаны на выявлении физических свойств путем измерений физических констант лекарственных веществ. Подлинность подтверждают: агрегатное состояние (твердое вещество, жидкость, газ); окраска, запах, форма кристаллов или аморфность вещества; гигроскопичность или степень выветриваемости на воздухе; устойчивость к воздействию света, кислорода воздуха; летучесть, подвижность, воспламеняемость. При этом более объективным является установление различных физических констант: температуры плавления (разложения), темпера- туры затвердевания или кипения, плотности, вязкости, растворимости в воде, кислотах, щелочах, органических растворителях (эфире, хлороформе, ацетоне, бензоле, этиловом и метиловом спиртах, маслах и др.).
Температура плавления является постоянной величиной для индивидуального вещества. Присутствие примесей изменяет эту константу (чаще снижает), что позволяет судить о степени чистоты. Подтвердить индивидуальность исследуемого вещества можно пробой смешанного плавления, так как смесь двух веществ, имеющих одинаковые температуры плавления плавится при одной температуре. Для установления температуры плавления ГФ XI рекомендует капиллярный метод, при этом подразумевается интервал температур, при котором происходит процесс плавления препарата, от появления первых капель жидкости до полного перехода вещества в жидкое состояние. Интервал температур плавления между началом и окончанием плавления не должен превышать 2 "С. Если он выше, то в частной статье должно быть указано, на какую величину. Если переход вещества из твердого состояния в жидкое нечеткий, то вместо интервала температуры плавления устанавливают температуру, при которой происходит только начало или окончание плавления. Для этих исследований используют специальные приборы и методики, например прибор, описанный в ГФ XI, вып. 1, с. 16.
Под температурой затвердевания понимают наиболее высокую, остающуюся в течение короткого времени постоянную температуру, при которой происходит переход вещества из жидкого состояния в твердое. В ГФ XI, вып. 1, с. 20 описано устройство прибора и методика его применения.
Температура кипения, или, точнее, температурные пределы перегонки, — это интервал между начальной и конечной температурой кипения при нормальном давлении 760 мм рт. ст. Температура, при которой в приемник перегнались первые 5 капель жидкости, называют начальной температурой кипения, а температуру, при которой перешло в приемник 95% жидкости, — конечной температурой кипения. В ГФ XI, вып. 1, с. 17 рекомендован прибор для этих целей.
При установлении плотности берут массу вещества определенного объема и устанавливают ее с помощью пикнометра или ареометра (ГФ XI, вып. 1, с. 24—26), строго соблюдая температурный режим. Обычно это достигается термостатированием пикнометра при 20 "С. Определенные интервалы значений плотности подтверждают подлинность этилового спирта, глицерина, масла вазелинового, вазелина, парафина твердого, галогенопроизводных углеводородов (хлор-этила, фторотана, хлороформа), раствора формальдегида, эфира для наркоза, амилнитрита и др. ГФ XI, вып. 1, с. 26 рекомендует устанавливать содержание спирта этилового в его препаратах 95, 90, 70 и 40 %-ной плотности, а в лекарственных формах либо дистилляцией с последующим установлением плотности, либо по температуре кипения водно-спиртовых растворов (в том числе настоек). Дистилляцию осуществляют кипячением определенных количеств спиртоводных смесей (настоек) в колбах, герметически соединенных с приемником. Последний представляет собой мерную колбу вместимостью 50 мл. Собирают 48 мл отгона, доводят его температуру до 20 "С и добавляют водой до метки, после чего устанавливают плотность отгона пикнометром.
Определение спирта (в настойках) по температуре кипения изложено в ГФ XI, вып. 1, с. 27—28, вместе с таблицей, по которой вычисляют концентрацию.
Вязкость (внутреннее трение) подтверждает подлинность жидких лекарственных средств. Различают динамическую (абсолютную), кинематическую, относительную, удельную, приведенную и характеристическую вязкости. Каждая из них имеет свои единицы измерения. Например, для оценки качества жидких препаратов, имеющих вязкую консистенцию (глицерина, вазелина, масел) обычно определяют относительную вязкость. Она представляет собой отношение вязкости исследуемой жидкости к вязкости воды, принятой за единицу. Для измерения кинематической вязкости используют различные модификации вискозиметров типа Оствальда и Уббелоди. Эту вязкость выражают в м2-с~'. Зная плотность исследуемой жидкости, можно затем вычислить динамическую вязкость, которую выражают в Пас. Динамическую вязкость можно также установить с помощью ротационных вискозиметров различной модификации типа «полимер РПЭ-1» или микрореометров серии ВИР. Имеются и другие приборы. Все они должны термостатироваться.
Растворимость согласно ГФ XI может служить ориентировочной характеристикой испытуемого препарата. Наряду с температурой плавления растворимость веществ при постоянных температуре и давлении является одним из параметров, по которому устанавливают подлинность и чистоту практически всех лекарственных веществ. В ГФ XI, вып. 1, с. 176 приняты условные термины, обозначающие растворимость.
Определение растворимости по методике ГФ XI основано на том, что навеску предварительно растертого (в необходимых случаях) препарата вносят в отмеренный объем растворителя и непрерывно перемешивают в течение 10 мин при 20+2 °С. Растворившимся считается препарат, в растворе которого в проходящем свете не видно частиц вещества. Если для растворения препарата требуется более 10 мин, то его относят к числу медленно растворимых. В этом случае смесь с растворителем нагревают на водяной бане до 30 °С и наблюдают полноту растворения после охлаждения до 20 "С и энергично встряхивают в течение 1—2 мин. Показатели растворимости в различных растворителях указываются в частных статьях, в которых оговариваются случаи, когда растворимость подтверждает степень чистоты лекарственного вещества.
Имеется метод фазовой растворимости (ГФ XI, вып. 1, с. 149), который дает возможность осуществить количественную оценку степени чистоты лекарственного вещества путем точных измерений значений растворимости. Метод основан на правиле фаз Гибса, которое устанавливает зависимость между числом фаз и числом компонентов в условиях равновесия. Суть установления фазовой растворимости заключается в последовательном прибавлении увеличивающейся массы препарата к постоянному объему растворителя. Для достижения состояния равновесия смесь длительно встряхивают при постоянной температуре, а затем с помощью диаграмм определяют, является ли испытуемый препарат индивидуальным веществом или смесью. Этот метод можно использовать для качественного и количественного анализов, а также для изучения стабильности и получения очищенных образцов препарата (до степени чистоты 99,5% ). Одно из важных достоинств метода — возможность отличать оптические изомеры и полиморфные варианты лекарственных веществ. Метод применим ко всем видам соединений, которые образуют истинные растворы.
Химические методы установления подлинности. Идентификация неорганических лекарственных веществ —это установление их подлинности, основанное на обнаружении с помощью химических реакций катионов и аминов, входящих в состав их молекул.
Реакции осаждения анионов и катионов используют для обнаружения наибольшего числа катионов и анионов, входящих в состав молекул вещества. Образующиеся нерастворимые в воде вещества могут быть охарактеризованы по окраске, растворимости (в кислотах, щелочах, органических растворителях), способности образовывать растворимые в избытке реактивов комплексные соединения и т. д.
Реакции осаждения используют для идентификации ионов натрия (с цинкураниллацитатом) и ионов калия (с винной кислотой). Ион калия можно также обнаружить, используя в качестве реактива тетрафенилборат натрия. В нейтральной и щелочной среде он образует белый осадок тетрафенилбората калия. Процесс происходит количественно, в том числе в присутствии ионов натрия, лития, ряда анионов. Ион аммония, органические аммониевые основания (включая алкалоиды) образуют осадки в тех же условиях. Соли натрия, растворимые в воде, образуют белый кристаллический осадок с раствором карбоната натрия, а с раствором фосфата натрия — желеобразный осадок фосфата лития. Ион кальция обнаруживают по образованию белого осадка с раствором оксалата аммония. В свою очередь, ион кальция применяют как реактив на обнаружение цитрат-ионов.
По образованию окрашенных или белых осадков сульфидов испытывают подлинность препаратов ртути (черный), цинка (белый), висмута (коричнево-черный), мышьяка (ярко-желтый). Из растворов солей висмута в серной кислоте после добавления йодида выпадает черный осадок, растворимый в избытке реактива с образованием раствора желто-оранжевого цвета. После добавления к образовавшемуся комплексу нескольких объемов воды и нагревания вновь образуется осадок оранжевого цвета.
Реакциями осаждения гидроксидом аммония подтверждают подлинность катионов цинка, меди, серебра. Полученные белые осадки гидроксидов растворяют в избытке раствора аммиака вследствие образования водорастворимых комплексных солей. Подобный метод применяют для идентификации солей ртути, растворы которых с эквимолекулярным количеством йодида калия образуют красный осадок дийодида ртути. Последний в избытке йодида калия превращается в бесцветный раствор комплексной соли. Растворимые соли ртути с раствором гидроксида натрия образуют желтый осадок гидроксида ртути.
Гексацианоферрат калия — реактив на ион железа (синий осадок) и на ион цинка (белый осадок).
Некоторые реакции осаждения применяют для испытания подлинности обоих реагирующих ионов. Так, ион калия используют как реактив на тартрат-ион, а взаимодействие иона бария с сульфат-ионом — для идентификации как катиона, так и аниона. Сульфат бария практически нерастворим в воде, растворах кислот и щелочей. Аналогичную реакцию осаждения с растворами солей бария дают сульфиты. Однако образующийся белый осадок сульфита бария, в отличие от его сульфата, растворяется в разведенной соляной кислоте. Сульфат-ионы можно также обнаружить с помощью раствора ацетата свинца (белый осадок сульфата свинца). Осадок растворим в концентрированной серной кислоте и в растворах едких щелочей (гидроксидов).
Хлориды, бромиды, йодиды обнаруживают, используя в качестве реактива раствор нитрата серебра, а ион серебра — по реакции с хлоридами. При испытании бромидов (гидробромидов) и хлоридов (гидрохлоридов) — нерастворимых и малорастворимых оснований — сначала взбалтывают их с раствором аммиака и фильтруют. Затем фильтрат подкисляют азотной кислотой и выполняют реакцию с раствором нитрата серебра.
Растворы карбонатов при добавлении насыщенного раствора сульфата магния образуют белый осадок. Гидрокарбонаты дают эту реакцию только после кипячения смеси.
Растворы фосфатов, имеющие рН около 7,0, с раствором нитрата серебра образуют желтый осадок. Фосфаты, растворенные в разведенной азотной кислоте, с раствором молибдата аммония образуют желтый кристаллический осадок фосфор-молибдата аммония. Реакцию образования белого осадка фосфата магния-аммония используют для обнаружения катиона магния и фосфат-ионов. Подобную реакцию образования осадка арсената магния-аммония используют для обнаружения арсената йода. В качестве реактива на арсенит- и арсенат-ионы используют раствор ионного серебра (образуется соответственно желтый или шоколадного цвета осадок).
Тиосульфат-ион в этих условиях дает белый осадок, который затем желтеет, буреет и становится черным.
Окислительно-восстановительные реакции. Реакции восстановления металлов из оксидов или солей используют для испытания подлинности препаратов серебра, меди.
Окислительные свойства галогенов (хлора) используют для идентификации бромидов и йодидов и, наоборот, для обнаружения свободного хлора. Выделившийся бром окрашивает хлороформный слой в оранжевый цвет, а йод — в фиолетовый. Для йода специфична реакция с крахмалом (синий цвет).
Соли ионов железа образуют с тиоцианатом аммония окрашенное в красный цвет комплексное соединение — тиоцианат железа, состав которого в зависимости от концентрации реагирующих компонентов колеблется от [Fe (NCS)]2+ до [Fe(NCS)6]3~.
Реакция окисления дифениламина лежит в основе испытаний подлинности нитратов и нитритов. Дифениламин восстанавливает нитраты (нитриты), окисляясь до дифенилбензидина, а затем до хи-ноидного соединения (синий цвет). Нитраты, в отличие от нитритов, не обесцвечивают раствор перманганата калия в разведенной серной кислоте. Обнаружить нитраты можно с помощью нитробензола в присутствии концентрированной серной кислоты. Смесь охлаждают во льду, перемешивают, добавляют воду и раствор гидроксида натрия. После добавления ацетона, встряхивания и разделения слоев в верхней фазе появляется фиолетовое окрашивание, обусловленное образованием псевдонитрокислот в щелочной среде.
Йодиды при нагревании с концентрированной серной кислотой выделяют фиолетовые пары йода. Перманганат-ион обесцвечивается от действия восстановителей [лактаты, пероксид водорода, сульфат железа (II)].
Реакции нейтрализации и разложения анионов. Карбонаты и гидрокарбонаты под действием минеральных кислот образуют газообразный гидроксид углерода.
Соли аммония под действием едких щелочей (гидроксидов) выделяют аммиак, который обнаруживают по запаху или по изменению окраски лакмусовой бумаги.
Сульфаты под действием минеральных кислот разлагаются на воду и диоксид серы, имеющий характерный резкий запах.
Нитриты под действием кислот выделяют оксиды азота (диоксид азота имеет красно-бурую окраску).
Тиосульфат-ион под действием разбавленной соляной кислоты выделяет диоксид серы и мелкодисперсный желтый осадок (сера).
Изменение окраски бесцветного пламени. Соли натрия при внесении в бесцветное пламя горелки окрашивают его в желтый цвет, калия — в фиолетовый, кальция — в кирпично-красный, лития — в карминно-красный. Препараты бора (растворенные в этиловом спирте) горят пламенем, окаймленным зеленым ободком. Зги испытания позволяют обнаруживать указанные элементы в неорганических и элементоорганических лекарственных веществах.
Изменения, происходящие при нагревании и прокаливании препаратов. Йод кристаллический, препараты мышьяка и ртути возгоняются и сублимируются (испытания выполнять под тягой!), цинка оксид при прокаливании желтеет. Висмута нитрат основной разлагается с образованием желтого остатка (оксид висмута) и желто-бурых паров (диоксид азота).
Идентификация элементоорганических лекарственных веществ. Элементный анализ используют для испытания веществ, содержащих в молекуле атомы серы, фосфора, галогенов, мышьяка, висмута, ртути и др. Поскольку атомы этих элементов в данных лекарственных веществах не ионизированы, необходимым условием испытания их подлинности является предварительная минерализация. В результате происходит разрушение органической части молекулы (превращение углерода, водорода и кислорода в диоксид углерода и воду), а атомы серы, фосфора, галогенов, мышьяка, висмута, ртути образуют соответствующие ионы. Последние затем идентифицируют с помощью рассмотренных осадочных реакций на неорганические ионы.
Для обнаружения серы используют две реакции: одна основана на восстановлении серы до сульфид-иона, другая — на окислении до сульфат-иона. Процесс восстановления тиоэфирной и тиокетонной серы из препаратов (норсульфазол, фталозол, этазол, тиофосфамид, тиамин и др.) осуществляют нагреванием с 10%-ным раствором гид-роксида натрия. Образовавшийся сульфид затем обнаруживают реакцией с нитропруссидом натрия (красно-фиолетовое окрашивание), с помощью солей свинца (черное окрашивание) или по выделению сероводорода после добавления кислоты. Этим способом обнаруживают тиоэфирные и тиокетонные связи серы в растительных объектах, аминокислотах, белковых веществах и эфирных маслах.
Серу, содержащуюся в молекулах производных сульфокислот, сульфаниламидных препаратов, метансульфат-ионе, можно обнаружить озолением, окислением (концентрированной азотной кислотой) или сплавлением со смесью нитрата и карбоната калия. Происходит образование сульфат-иона, который обнаруживают реакцией с растворимыми солями бария. Способ, основанный на разрушении органической части молекулы путем спекания, можно использовать и для обнаружения хлора, например в галогенопроизводных алкилуреидов сульфакислот (хлорпропамид). Образовавшиеся сульфат-хлорид-ионы открывают обычными аналитическими реакциями. Аналогичный способ используют для обнаружения кобальта (в цианкобаламине) после спекания с гидросульфитом калия.
Галогены в элементоорганических соединениях можно обнаружить, используя восстановительную минерализацию. Процесс восстановления может быть выполнен как в кислой, так и в щелочной среде с использованием восстановителя цинковой пыли.
Элементный качественный анализ йодсодержащих органических лекарственных веществ производных алифатического, ароматического и гетероциклического рядов осуществляют двумя путями. Либо нагревают Йод-производное в пробирке на пламени горелки, либо воздействуют концентрированной серной кислотой. И в том, и в другом случаях органическая часть молекулы разрушается, а образование молекулярного йода наблюдают по выделению фиолетовых паров или по окраске в фиолетовый цвет хлороформного извлечения (йодоформ). Иногда (ти-реодин) органическую часть молекулы разрушают спеканием со смесью нитрата калия и карбоната натрия. Образовавшийся йодид-ион обнаруживают действием активного хлора, а выделившийся йод извлекают хлороформом (красно-фиолетовое окрашивание).
Фтор и хлор открывают обычными аналитическими реакциями после разрушения органической части молекулы расплавленным металлическим натрием (фторотан). Образовавшиеся фторид-ионы затем обнаруживают по исчезновению красного окрашивания раствора тиоцианата железа (III), а хлорид-ионы — реакцией с раствором нитрата серебра.
Для обнаружения органически связанного фосфора используют методику окисления фосфат-иона. Из окислителей используют смесь концентрированных серной и азотной кислот. Фосфат-ион обнаруживают реакцией осаждения в виде фосфата магния-аммония (белый осадок) или в азотнокислой среде реакцией с молибдатом аммония (желтый осадок).
Способы минерализации висмут-, мышьяк- и ртутьсодержащих элементоорганических веществ можно разделить на три группы: озо-ление (сжигание и прокаливание), минерализация в присутствии окислителей и минерализация в присутствии восстановителей.
Способ озоления пригоден только для соединений висмута, так как мышьяк и ртутьсодержащие соединения при этом возгоняются.
Минерализацию в присутствии окислителей осуществляют смесью концентрированных серной и азотной кислот, а также концентрированной серной кислотой в присутствии пероксида водорода или пер-манганата калия. Оба эти способа пригодны для качественного и количественного анализа органических соединений мышьяка и ртути.
Минерализацию в присутствии восстановителей выполняют, используя смесь концентрированной серной кислоты с сульфитом калия. Такой способ применим для анализа мышьяксодержащих элементоорганических лекарственных веществ.
Качественный анализ ртутьсодержащих лекарственных веществ основан на предварительном превращении в ионогенное состояние ртути нагреванием в растворе соляной кислоты. Затем открывают ион ртути, используя в качестве реактива раствор йодида калия.
Идентификация подлинности органических лекарственных веществ. Химические реакции, применяемые для установления подлинности органических лекарственных веществ, можно разделить на три основные группы:
общие химические реакции органических соединений;
реакции образования солей комплексных соединений;
реакции, используемые для идентификации органических оснований и их солей.
Эти группы реакций основаны на использовании функционального анализа. Функциональной группой называют реакционноспособный атом, группу атомов или реакционный центр в молекуле органического соединения. Поскольку те или иные функциональные группы обусловливают фармакологическую активность вещества, функциональный анализ позволяет дать объективную оценку его подлинности, которую подтверждают с помощью реакций на ту или иную функциональную группу. При этом происходит образование растворимого или нерастворимого в воде продукта реакции, а использование цветореагентов дает окрашенные соединения. В качестве реактивов применяют как неорганические ионы и комплексные соединения, так и органические вещества различной химической структуры. Наиболее просты по выполнению цветные реакции, выполняемые при участии ионов и органических реагентов в водной среде. Их используют для испытания подлинности, а также в фотометрическом и спектрофотометрическом анализах.
При взаимодействии ряда неорганических солей, комплексных соединений, органических реагентов с органическими лекарственными веществами образуются белые или окрашенные осадки. Реакции осаждения позволяют установить подлинность препарата. Нередко внешний эффект реакции (окраска, растворимость, кристаллическая форма), а также температура плавления, растворимость, кристаллизация и другие константы позволяют идентифицировать лекарственное вещество и дифференцировать его от других препаратов данной химической группы. Кроме того, реакции осаждения, сопровождающиеся образованием труднорастворимых осадков постоянного химического состава, могут быть применены в количественном анализе. На основе таких реакций разработаны многочисленные методики анализа, в которых использованы гравиметрические, турбидиметрические, полярографические; экстракционно-фотометрические, амперометрические и другие методы анализа.
Общие химические реакции органических соединений. Для фармацевтического анализа применимы те же три типа химических реакций, которые используют для синтеза: реакции замещения (нитрование, галогенирование, конденсация карбонильных соединений); реакции превращения заместителей (диазотирование и азосочетание, ацилирование, этерификация); реакции окисления-восстановления. В фармацевтическом анализе применяют такие химические процессы, основанные на реакциях элиминирования или гидролиза: де-сульфирование, дегалогенирование, гидролиз сложных эфиров и ацилированных производных, разложение третичных анионов, ами-нопроизводных и продуктов конденсации.
Реакция нитрования и нитрозирования. Нитрование ароматического ядра применяют для идентификации ряда препаратов (фенобарбитала, фенацетина, дикаина). Появляющееся характерное (желтое) окрашивание обусловлено образованием моно-, ди- и тринит-ропроизводных. Фенолы при этом образуют окрашенную в желтый цвет ациформу нитрофенола. Подобные продукты реакции дают в этих условиях некоторые вторичные ароматические амины, например дикаин, который образует калиевую соль о-хиноидного соединения, окрашенную в кроваво-красный цвет.
Ряд лекарственных веществ, содержащих в молекуле нитрогруппу (левомицетин, производные нитрофурина) или продукты нитрования (производные пропанового ряда, дикаин), под действием едких щелочей (гидроксидов) образуют окрашенные ацисоли.
Процесс нитрования с образованием тринитросоединений троповой или дифенилуксусной кислот, являющихся продуктами кислотного гидролиза сложных эфиров производных тропина, лежит в основе реакции Витали-Морена. В результате реакции под действием гидроксида калия образуется окрашенное в фиолетовый цвет соединение хиноидной структуры. Образование окрашенных продуктов из нитросоединений под действием раствора гидроксида натрия используют для идентификации производных нитрофурана. Предполагают, что окраска обусловлена расщеплением фуранового цикла.
Нитрозирование ряда гетероциклических веществ с подвижным атомом водорода в молекуле (антипирина, бутадиона и др.) приводит к образованию окрашенных нитрозосоединений, которые можно использовать для идентификации. Окрашенные продукты реакции при этом дают производные барбитуровой кислоты, содержащей имин-ную группу. Гидразины (апрессин) и пиперазины образуют с азотистой кислотой нитрозосоединения со стабильной температурой плавления. Реакция нитрозирования вторичных аминов в ряде случаев (резерпин) сопровождается флуоресценцией. Нитрозирование с последующим окислением до индофенола используют для идентификации производных фенолов. Индофенол — вещество интенсивно-синего цвета.
Ароматические амины (анестезин, новокаин, аминоакрихин) при окислении превращаются в орто- или пара-хинонимины. Последние, вступая в реакцию конденсации с ароматическими аминами, образуют индофенол.
С образованием индофенольных красителей связано взаимодействие с фенолами и их производными таких реактивов, как 4-амино-антипирин, диметил- и диэтил-н-фенилендиамин. Окрашенные продукты образуются в присутствии окислителей. Реакции отличаются высокой чувствительностью. Можно идентифицировать и вещества, содержащие в молекуле активную метиленовую группу. При использовании первого реактива в щелочной среде возникает красное окрашивание, а второго — синее или фиолетово-синее. Положительные результаты дают осарсол, хинозол, мезатон и др. Указанные реактивы с аммиачным раствором бутадиона в присутствии окислителей образуют белые осадки.
К реакциям, основанным на образовании индофенолов, следует отнести так называемую фенолгипохлоритную реакцию, которую использовали еще в XIX в. для обнаружения аммиака и других азотсодержащих соединений после их минерализации. Позже было установлено, что окрашенные соединения при определенных условиях дают также мочевина, ацетамид, некоторые барбитураты. При использовании в качестве реактивов 1%-ного раствора гипохлорита натрия, 5%-ного водного раствора фенола и 0,1 М раствора соляной кислоты окрашенные соединения образуют ряд производных пурина (кофеин, теобромин, теофиллин, дипрофиллин). Цвет и интенсивность окраски зависят от условий выполнения реакции. Установлено, что в образовании индофенольных красителей участвуют два атома азота пуринового цикла после расщепления имидазольного кольца.
Реакции диазотирования и азосочетания. Некоторые аминопроизводные гетероциклического ряда (этакридина лактат) образуют окрашенные диазосоединения. Диазотирование и последующее азосочетание широко используют как для качественного анализа лекарственных препаратов, производных первичных ароматических аминов (анилина, сульфаниламидов, производных и-аминобензойной кислоты и др.), так и для идентификации фенолов. Для анализа фенолов используют диазореактив, представляющий собой соль диазония. Азосочетание с фенолами и нафтолами наиболее благоприятно происходит в слабощелочной среде, а с аминами — в слабокислой.
Реакции диазотирования и азосочетания используют также для идентификации сложных эфиров, фенолов, ароматических ацилированных аминов и нитропроизводных.
Реакции галогенирования и дегалогенирования. Их широко применяют для количественного анализа непредельных соединений, спиртов, фенолов» ароматических аминов, галогенопроизводных и других лекарственных веществ. Галогенирование происходит по типу реакций присоединения и замещения. Например, обнаружение непредельных соединений основано на реакциях присоединения брома (последний при этом обесцвечивается). Способ не пригоден, если одновременно происходит реакция окисления или замещения (например, в присутствии фенолов, енолов, аминов). К методам галогенирования, протекающим по типу реакции замещения, может быть отнесена йодоформная проба, применяемая для идентификации этилового спирта и соединений, содержащих этоксильную группу (анестезин). Образующийся йодоформ выпадает в виде желтого осадка, имеющего характерный запах.
Для фармацевтического анализа широко применяют реакции бромирования или йодирования производных фенолов или ароматических аминов. Они протекают по типу реакций электрофильного замещения. Наличие в молекулах этих соединений заместителей первого ряда (окси- и аминогрупп) обусловливает количественно происходящий процесс бромирования с образованием белого осадка трибромфенола или триброманилина. Аналогично происходит процесс йодирования указанных производных. Если аминогруппа или фенольный гидроксил ацилированы, то предварительно проводят процесс гидролиза (в кислой или щелочной среде). Если у фенола или анилина в орто-или пара-положении находятся радикалы, то образуются моно- или дигалогенопроизводные.
В реакции галогенирования вступают не только ароматические, но и гетероциклические соединения, содержащие фенольный гидроксил, в том числе витамины, антибиотики.
Процесс, обратный галогенированию, — дегалогенирование — используют для анализа хлор-, бром- и йодпроизводных органических лекарственных препаратов. Галогены в органической молекуле связаны не ионогенной, а ковалентной связью. В зависимости от прочности этой связи применяют различные способы дегалогенирования, например отщепление галогена под действием раствора нитрата серебра. Дехлорирование можно проводить нагреванием препарата (хлорэтил, хлороформ) в спиртовом растворе едкой щелочи или водно-спиртовой среде с раствором нитрата серебра. Этот способ лежит в основе определения органически связанного хлора в молекуле производных бис-(р-хлорэтил) -амина. Происходит процесс дехлорирования (обратный, синтез) с образованием хлорид-иона. Последний сразу же осаждается ионом серебра. В отличие от элементного анализа органическая часть молекулы при этом не разрушается. Если ковалентная связь более прочна, то хлорид-ион образуется только после предварительного нагревания препарата с раствором гидроксида натрия.
Таким же образом анализируются бромсодержащие органические вещества (бромизовал). Образовавшийся при кипячении в растворе щелочи ион брома окисляют хлорамином до свободного брома, который окрашивает слой хлороформа в желто-бурый цвет.
Реакции десульфирования. Используют для анализа производных п- метан -сульфата натрия и производных сульфоната натрия. Производные л-метан-сульфата натрия (стрептоцид растворимый, анальгин) при нагревании в присутствии минеральных кислот разлагаются с образованием диоксида серы и формальдегида, которые выявляют по характерному запаху. Сульфонаты (викасол) в этих условиях образуют диоксид серы.
Реакции конденсации карбонильных соединений. Используют для идентификации лекарственных веществ, содержащих в молекуле аминогруппу, альдегидную и кетогруппу. При взаимодействии альдегидов с первичными аминами в кислой среде происходит конденсация с образованием оснований Шиффа. Эти соединения обычно имеют желтую, красную или оранжевую окраску. Реакцию используют для обнаружения сульфаниламидов и других первичных ароматических аминов, применяя в качестве реактивов 4-диметиламинобензальде-гид, коричный и другие альдегиды. Реакция образования окрашенных оснований Шиффа лежит в основе лигниновой пробы на первичные ароматические амины.
Для выявления кетопроизводных используют реакции образования гидразонов и реакции получения кетоксимов. Кетоны, вступая в реакции конденсации с различными гидразинами (фенилгидразин; 2,4-динитрофенилгидразин), образуют гидразоны, а взаимодействуя с гидроксиламином — кетоксимы. И те, и другие представляют собой бесцветные или слегка окрашенные устойчивые соединения, нерастворимые в воде, со стабильной температурой плавления. Это позволяет использовать их для установления подлинности таких ке-тонов, как камфора, бромкамфора, а также стероидных соединений, содержащих в молекуле кетогруппу.
В фармацевтическом анализе используют также процесс, обратный конденсации, в результате которого образуются альдегиды и кетоны. Последние затем обнаруживают по характерному запаху или с помощью цветных реакций (фтивазид и др.)
Реакции окислительной конденсации. Процесс окислительного расщепления и образования азометинового красителя лежит в основе нингидриновой реакции. При нагревании с нингидрином (трикето-гидринденгидрат) растворов аминокислот, иминокислот, пептонов, полипептидов, первичных и вторичных алифатических аминов возникает окрашивание. Наиболее широко эту реакцию используют для идентификации и фотоколориметрического определения а- и р-ами-нокислот, в присутствии которых появляется темно-синяя окраска, обусловленная образованием замещенной соли дикетогидриндили-дендикетогидрамина — продукта конденсации избытка нингидрина и восстановленного нингидрина с аммиаком, выделившимся при окислении испытуемой аминокислоты. Следует заметить, что появляющаяся окраска присуща не одному соединению, а нескольким окрашенным веществам в зависимости от химической структуры исходной аминокислоты. Однако во всех случаях образуются фиолетового цвета бис-1,3-дикетоинденил. С помощью нингидриновой реакции определяют глутаминовую, аминокапроновую аминокислоты, фени-бут, аминалон, метионин, сарколизин, дийодтирозин и др.
Кроме аминокислот и их производных, нингидрин в слабощелочной среде образует окрашенные как и в случае алифатических аминокислот сине-фиолетовые продукты реакции с метазоном и эфедрином. Положительную реакцию в этих условиях дают также рибофлавин (зеленое окрашивание), изониазид (нестойкое красное), эуфиллин (красно-фиолетовое).
Похожа по химизму с нингидриновой реакцией мурексидная проба, основанная на окислении молекулы пурина с образованием метилированных производных аллоксантина. Последующее воздействие раствором аммиака приводит к образованию аммонийной соли метилированного производного пурпуровой кислоты, окрашенного в пурпурно-красный цвет. Мурексидную пробу используют для испытания подлинности производных пурина (кофеин, теобромин, теофиллин и др.).
Альдегиды, спирты, органические кислоты, ангидриды кислот, барбитураты образуют окрашенные продукты конденсации с фенолами. Процесс конденсации лежит в основе цветной реакции формальдегида с салициловой и хромотроповой кислотами.
В этих цветных реакциях последовательно происходят процессы конденсации, а затем окисления с образованием окрашенных соединений парахиноидной структуры (ауриновый краситель). Концентрированная серная кислота оказывает дегидратирующее действие в реакции конденсации и, кроме того, является окислителем при образовании хиноидного соединения. Эту цветную реакцию применяют для обнаружения формальдегида, выделяющегося при окислении метилового спирта, а также при гидролизе некоторых лекарственных веществ (никодин, метазид, гексамидин и др.).
К этому же типу можно отнести реакцию резорцина с фталевым ангидридом, сопровождающуюся образованием флуоресцеина. Реакция образования ауринового красителя лежит в основе взаимодействия гексаметилентетрамина с фенолами в присутствии концентрированной серной кислоты. Этот реактив образует окрашенные соединения и с ментолом, терпингидратом, промедолом (красное), а также с производными бензиновой кислоты — амизилом, бензацином, метацином (сине-зеленое) и этакридином (зеленое). Вместе с тем производные дифенилуксусной и дифенилпропионовой кислот (апрофен, спазмолитик) в этих условиях не дают положительной реакции.
Рад лекарственных веществ, содержащих в молекуле фенильный радикал (промедол, фенобарбитал), подвергается формальдегидом и концентрированной серной кислотой окислительной конденсации. При осторожном наслаивании на раствор формальдегида в концентрированной серной кислоте раствора препарата на границе слоев появляется кольцо красного цвета (проба Ле Розена).
Ароматические альдегиды образуют окрашенные продукты с соединениями, содержащими в молекуле активную метиленовую группу (камфора).
С помощью ванилина можно обнаружить наличие индольного цикла в молекуле (стрихнин, резерпин).
Реакции этерификации, ацилирования и гидролиза. Для выявления веществ, содержащих в молекуле спиртовой (фенольный) гидроксил или карбоксильную группу, используют реакцию этерификации, а для идентификации сложных эфиров — обратный процесс — гидролиз (омыление). Этерификация протекает в присутствии дегидратирующих веществ (концентрированная серная кислота), а гидролиз — в кислой или щелочной среде. Аналогичный процесс лежит в основе идентификации простых эфиров. Применение в анализе находит и реакция ацилирования (особенно ацетилирования) аминопроизводных и обратный процесс — гидролиз ацильных производных. Образовавшиеся в результате этих реакций сложные эфиры, ацильные производные и продукты гидролиза могут иметь характерный запах, стабильную температуру плавления или другие константы, подтверждающие подлинность лекарственного вещества. Реакции этерификации, которые сопровождаются образованием этилацетата, имеющего характерный запах, применяют, например, для идентификации производных этилового спирта или уксусной кислоты (калия ацетат).
Чаще для испытания подлинности используют процесс гидролиза эфиров и ацильных производных (парацетамол, фенацетин и др.). Концентрированную серную кислоту применяют для гидролиза простых эфиров (кодеин, хинин, котарнина хлорид). Гидролиз простых арилалифатических эфиров (димедрол) основан на дезалкилирова-нии при нагревании в присутствии минеральных кислот.
Для идентификации сложных эфиров салициловой кислоты (ацетилсалициловой кислоты, метилсалицилата, фенилсалицилата) проводят гидролиз и в кислой, и в щелочной средах. Образовавшиеся продукты гидролиза идентифицируют с помощью цветных реакций, органолептически (по запаху) или по температуре плавления. Сложные эфиры арилалифатических кислот определяют путем щелочного гидролиза с последующим установлением температуры плавления выделенных кислот. Сложные эфиры азотной кислоты (нитроглицерин, эринит) образуют при гидролизе нитраты, которые затем и обнаруживают, используя в качестве реактива дифениламин. Иногда для выявления сложных эфиров их в начале подвергают гидролизу, а затем проводят этерификацию образовавшейся органической кислоты спиртом (амилнитрит, кислота ацетилсалициловая) или, наоборот, выделившегося спирта кислотой (мепротан). Возможен также вариант, когда полученные при гидролизе двойного эфира (кокаин) спирт и кислота взаимодействуют между собой с образованием сложного эфира. Его обнаруживают по характерному запаху или по температуре плавления.
Для веществ, содержащих в молекуле сложноэфирную, лактонную или лектамную группы, общим способом испытаний является гидроксамовая реакция. Если процесс гидролиза сложных эфиров выполнять в щелочной среде в присутствии гидроксиламина, то образуются гидроксамовые кислоты, которые взаимодействуют с солями металлов, ионов железа (III), и в зависимости от рН среды образуют различные по составу и окраске продукты реакции (красно-бурая, вишне во-красная, красно-фиолетовая). Особенно часто эту реакцию применяют для идентификации сложных эфиров (салициловой кислоты — фенилсалицилат, метилсалицилат, л-аминобензой-ной кислоты, алифатических и других кислот), содержащих сложную эфирную группу, алкалоидов (атропин, кокаин), стероидных гормонов (кортизона ацетат, тестостерона пропионат и др.), высших жирных кислот, коллагенов, пептидных связей в белках. Дают эту реакцию также амиды (бромизовал, фенацетин, парацетамол, нитразепам) и имиды (барбитураты, бемегрид, фенсукцинимид).
С гидроксиланом легко реагируют сложные эфиры, значительно медленнее в сильнощелочной среде и при повышенной температуре — амиды и имиды. Также в щелочной среде вступают в эту реакцию лактоны (пилокарпин и сердечные гликозиды с лактоновым циклом). Для образования окрашенных комплексов наряду с солями железа (III) используют соли меди (II), реже другие катионы металлов. Синтетические и природные пенициллины, содержащие р-лактамный цикл, образуют гидроксамат меди при рН 7,0, цефалоспорины при рН 6,0 в присутствии никеля. Образование устойчивых красно-фиолетовых комплексов гидроксамовых кислот с солями железа (III) в кислой среде (рН 1,5—3,0) с максимумом светопоглощения в области 470—540 нм использовано для фотометрического определения большинства указанных лекарственных веществ. При выборе условий выполнения анализа важное значение имеют не только химическая структура препарата, но и природа растворителя, рН среды, температура.
Реакция разложения аминов и аминопроизводных. Некоторые соли четвертичных аммониевых оснований при нагревании до плавления выделяют триметиламин, другие (ацетилхолин-хлорид) разлагаются с его выделением под действием щелочей. Амиды ароматических, гетероциклических кислот при нагревании в растворах едких щелочей (гидроксидов) разлагаются с образованием аммиака или соответствующего алкил- или диалкиламина, которые регистрируют по характерному запаху. Этот процесс лежит в основе испытаний подлинности амида салициловой, диэтиламида никотиновой и других кислот. Производные уретана под действием щелочей образуют спирт, аммиак и карбонат натрия (прозерин, пармидин, мепротан).
Вещества, содержащие в молекуле уреидную группу, гидролизу-ются в кислой и в щелочной средах по общей схеме. Для испытания подлинности циклических и ациклических уреидов, алкилуреидов сульфокислот, производных гуанидина и семикарбазона используют реакцию гидролиза в щелочной среде. При этом образуется аммиак, который обнаруживают по запаху или изменению окраски влажной красной лакмусовой бумаги. Мочевина, образующая под действием щелочей производные гуанидина, разлагается до аммиака и карбоната натрия. Если на продукты щелочного гидролиза подействовать избытком минеральной кислоты, то наблюдается выделение газа (диоксид углерода). Продукты гидролиза ациклических и циклических уреидов при этом нейтрализуются с образованием соответствующей жирной кислоты, которую обнаруживают по запаху.
Амиды сульфаниловой кислоты идентифицируют реакцией пиролитического расщепления (пиролиза) плавлением порошка лекарственного вещества в пробирке. При этом выделяется аммиак (или другие газы), придающий веществу характерную окраску. Реакцию разложения нагреванием в присутствии карбоната натрия используют для обнаружения некоторых производных пиридин карбоновых кислот и их амидов. Образуется пиридин, определяемый по запаху.
Реакции окисления-восстановления. Лежащие в основе многих химических реакций, эти реакции используют для испытания подлинности лекарственных веществ. Реакцию гидрирования нитросоединений (металлическим цинком в присутствии соляной кислоты) применяют для получения аминов и последующего образования из них окрашенных диазо- и азосоединений. Процесс гидрирования, основанный на присоединении водорода по месту двойной связи, можно использовать для идентификации непредельных соединений. Препараты, содержащие в молекуле непредельные связи (сферофизи-набензоат, карбокромен, нистатин, амфотерицин В), под действием окислителей (перманганат калия) подвергаются окислительной гидратации. Происходит обесцвечивание раствора перманганата калия.
Препараты, содержащие в молекуле хинонную группу (викасол), под действием восстановителей (цинковая пыль в присутствии минеральных кислот) гидрируются до образования фенольных групп.
Реакцию окисления спиртов до альдегидов используют для идентификации веществ, содержащих первичную спиртовую группу. Вторичные спирты при окислении образуют кетоны.
В фармацевтическом анализе широко используют реакцию окисления альдегидов до кислот.
Восстановительные свойства производных альдегидов (формальдегид, хлоралгидрат, цитраль, глюкоза), изоникотиновой кислоты (изониазид, салюзид), стероидных гормонов, содержащих в молекуле а-кетольную группу, антибиотиков тетрациклинового ряда и стрептомицина устанавливают с помощью реакции образования «серебряного зеркала», а также реактивами Фелинга и Несслера. Реакция «серебряного зеркала» основана на восстановлении серебра из его солей в аммиачном растворе. Реактив Фелинга представляет собой смесь двух приготавливаемых отдельно растворов: раствора сульфата меди и раствора, содержащего соль винной кислоты (сеньетова соль) и гидроксид натрия. При смешивании этих растворов с альдегидами после нагревания образуется вначале желтый осадок гидроксида меди (I), а затем красный осадок оксида меди. Процесс окисления лежит в основе реакции «серебряного зеркала» и реактива Фелинга для обнаружения а-кетольной группы в стероидных соединениях (кортизона ацетат, гидрокортизон, преднизолон, ДОКСА). Действие реактива Несслера основано на восстановлении ртути в щелочной среде.
Восстановительные свойства альдегидов можно использовать для испытания подлинности неорганических лекарственных веществ (соединения ртути, серебра).
Вещества, содержащие в молекуле гидразиновую группу (изониазид, апрессин), окисляются под действием раствора сульфата меди и аммиачного раствора нитрата серебра. Под действием минеральных кислот а-гидроксикарбоновой кислоты адреналина гидротартрат, натрия цитрат, кальция лактат, ациклидин, платифиллина гидротартрат разлагаются.
Многие лекарственные вещества претерпевают химические изменения под действием окислителей. Окрашенные продукты окисления образуют гетероциклические соединения, производные пиразо-лона и фенотиазина; алкалоиды, производные бензилизохинолина (папаверин), фенантрена (морфин, кодеин, апоморфин), индола (резерпин). Процесс окисления использован в мурексидной (тауриновые алкалоиды) и таллейохинной (хинин) пробах. В основе испытаний подлинности гормонов, имеющих в молекуле фенольный гидроксил, а также препаратов ряда витаминов лежит процесс окисления. В качестве окислителей используют галогены (раствор йода, бромную воду) или вещества, легко отщепляющие галогены (хлора-мины, гипохлориты), а также растворы пероксида водорода, перман-ганата калия, солей церия и др.
Реакции образования солей и комплексных соединений. Эти реакции с использованием неорганических солей железа (III), меди (II), серебра, кобальта, ртути (II), кадмия, свинца, сурьмы широко используют для испытания подлинности карбоновых кислот (в том числе аминокислот, оксикислот), производных барбитуровой кислоты, спиртов, фенолов, сульфаниламидов, некоторых алкалоидов, гормонов, антибиотиков. Соответствующие соли или комплексные соединения образуются за счет наличия в молекулах карбоксильной группы, вторичной аминогруппы и спиртового гидроксила. Образование из органических кислот солей и комплексных соединений происходит по общей схеме, алифатические амины вступают в реакцию комплексообразования. Реакции на натриевые, калиевые, кальциевые соли, соли органических кислот, в том числе сульфаниламидов, витаминов, антибиотиков и др., выполняют так же, как и при испытании неорганических лекарственных веществ. Для идентификации используют реакцию нейтрализации натриевых (калиевых) солей органических кислот (бензойной, салициловой и др.). Выделившиеся в воде нерастворимые кислоты осаждаются, затем их идентифицируют по температуре плавления или цветными реакциями с ионами тяжелых металлов.
В фармацевтическом анализе широко применяется хлорид железа (III). Взаимодействуя с фенолами, он образует комплексные ионы феноксидов (фенолятов) железа. Они в зависимости от присутствия в молекуле тех или иных функциональных групп могут иметь различную химическую структуру. Феноксиды железа окрашены в синий или фиолетовый цвет (фенол, резорцин и др.). Установлено, что наличие карбонильной и некоторых других групп в ортоположении к фенольному гидроксилу обусловливает фиолетовую окраску испытуемого вещества, в параположении — желтую или красную; метазамещенные фенолы не образуют окрашенных соединений (тимол).
Окрашивающиеся соединения с хлоридом железа (III) образуют лекарственные вещества, содержащие в своей молекуле фенольный гидроксил: производные я-аминофенола, сложные эфиры салициловой кислоты и производные салициламида с незамещенным феноль-ным гидроксилом, оксипиридиновые витамины и витамины группы флавоноидов, производные 8-оксихинолина, 4-окси кумарина, препараты гормонов, являющихся производными аминофенолов, антибиотики тетрациклинового ряда, продукт щелочного гидролиза стрептомицина — мальтол и ряд других веществ.
Соли тяжелых металлов используют в качестве реактивов для обнаружения органических кислот различной химической структуры: лимонной, бензойной, цинхониновой; аминокислот, и-аминосалициловой и др.
Вещества, содержащие в молекуле меркаптогруппу (цистеин, мер-казолил, меркаптопурин), образуют с солями тяжелых металлов нерастворимые в воде меркаптиды, которые под действием растворов едких щелочей гидролизуются с образованием сульфидов. Последние можно обнаружить с помощью цветных реакций, используя в качестве реактивов нитропруссид натрия или ацетат свинца.
Препараты, содержащие в молекуле сульфогруппы (хиниофон, сигенин, диазолин), взаимодействуя с ионами бария, образуют осадки.
Ионы железа (III), серебра, меди (II), кобальта позволяют подтвердить наличие амидной группы в молекулах сульфаниламидов, барбитуратов, пуринов. Соли меди (II) в нейтральной среде дают комплексные соединения с сульфаниламидами. Подобные комплексы с сульфаниламидами образуют и ионы других тяжелых металлов. Различие в растворимости и окраске позволяет идентифицировать получаемые продукты.
Препараты, молекула которых включает циклическую уреидную группу (барбитураты, производные пурина), с солями тяжелых металлов в присутствии гидроксида натрия образуют комплексные окрашенные соединения (сине-фиолетовые с солями кобальта и кальция; голубые до сиреневых с солями меди). Кроме того, соли тяжелых металлов позволяют выявлять некоторые алкалоиды (цитизин), витамины (рибофлавин, фолиевую и никотиновую кислоты, витамины группы А и D).
Часто в качестве реактива используют нитропруссид натрия, с помощью которого испытывают на подлинность производные тио-семикарбазона (метасазон), сульфаниламиды, производные имидазола (мерказолил, нафтизин), пиридина (ипразид), фурохромона (келлин), изоникотиновой кислоты (изониазид), а также некоторые алкалоиды (пилокарпин, теофиллин, пахикарпин, сферофизин) и ряд сердечных гликозидов. Окраска возникает вследствие замещения нитрозогруппы в ионе нитропруссида.
Сходный по химической структуре с нитропруссидом пентациано-акваферриат натрия образует окрашенные в синий или зеленый цвет соединения с первичными ароматическими аминами, серосодержащими соединениями (меркаптанами, тиокетонами и др.), в том числе с производными тиоурацила. Пентацианоаминоферроат натрия образует окрашенные вещества, взаимодействуя с гидразинами (красного или фиолетового цвета), изоникотиновой кислоты, л-оксиуретанами.
Идентификация органических оснований и их солей. Она предусматривает использование двух групп реакций. Одна основана на осаждении органического основания и обнаружении связанной с ним кислоты, другая заключается в использовании так называемых оса-дительных и специальных реактивов.
Общим испытанием на соли оснований с неорганическими или органическими кислотами является реакция нейтрализации растворами гидроксида натрия. Большинство оснований при этом выпадает в осадок. Образовавшееся основание можно извлечь органическим растворителем, а затем установить температуру плавления или идентифицировать с помощью цветной реакции.
Соли органических оснований идентифицируют по аниону соответствующей связанной кислоты: соляной — по хлорид-иону, серной — по сульфат-иону, бромводородной — по бромид-иону, йодводородной — по йодид-иону, фосфорной — по фосфат-иону, азотной — по нитрат-иону. Йодметилаты и бромметилаты, связанные с органическими основаниями, идентифицируют соответственно по йодид-или бромид-иону.
Тартраты обнаруживают по связанной винной кислоте, осаждая ее ионом калия, салицилаты и бензоаты открывают ионом железа (III), лактаты испытывают с помощью реакции на молочную кислоту (по обесцвечиванию раствора перманганата калия). Тартраты можно обнаружить также цветными реакциями. В среде уксусной кислоты после добавления растворов сульфата железа (II), пероксида водорода и гидроксида натрия появляется пурпурное или фиолетовое окрашивание. При действии на тартраты концентрированной серной кислотой, резорцином, бромидом калия и нагревании на водяной бане (5—10 мин) появляется интенсивно-синее окрашивание. После охлаждения жидкость выливают в воду, раствор приобретает красный цвет.
Известно более 200 «осадительных реактивов», применяемых для идентификации органических оснований и их солей. Чаще это — комплексные неорганические (иногда органические) соединения.
Наиболее употребительны следующие осадительные реактивы: раствор йода в йодиде калия (реактив Вагнера—Бушарда); раствор йодида висмута в йодиде калия (реактив Драгендорфа); раствор йодида ртути в йодиде калия (реактив Майера); раствор йодида кадмия в йодиде калия (реактив Марме); фосфорновольфрамовая кислота (реактив Шейблера); фосфорномолибденовая кислота (реактив Зонненштейна); кремневольфрамовая кислота (реактив Бертрана); дихлорид ртути (сулема); платинохлороводородная кислота; золотохлороводородная кислота; стифниновая кислота; пикроноло-вая кислота; раствор танина (водный или спиртовой).
Осадительные реактивы дают положительные реакции с веществами алифатической (амины), ароматической (фенолы, производные л-аминобензойной кислоты), гетероциклической (производные пиразолона, пиридина, хинолина, фенотиазина и др.) структуры.
Для идентификации органических оснований и их солей широко используют концентрированную серную или соляную кислоту и их смесь. В основе их взаимодействия с органическими основаниями — реакции окисления и конденсации. При этом концентрированная серная кислота — реактив не только для органических оснований, но и для сердечных гликозидов, гормонов.
Кроме перечисленных при фармацевтическом анализе широко применяют различные цветореагенты: ксантгидрол; водный раствор 1,2-нафтохинон-4-сульфоната натрия (для первичных ароматических аминов, например сульфаниламидов); 2,3-дихлор-1,4-нафтохи-нон (первичные амины, производные гидразина, натриевые соли слабых кислот, вещества с активной метиленовой группой в молекуле; все они образуют окрашенные соединения и с первым реактивом); хлоранил и его производные — хлораниловую кислоту, хлоранило-вокислую ртуть (цветные реакции с аминоспиртами, арилалкилами-нами, оксифенилалкиламинами, гидразидами изоникотиновой кислоты, первичными ароматическими аминами, причем последние приобретают красное окрашивание, а вторичные и третичные амины — зеленое, сине-зеленое или фиолетовое, что делает эти реакции селективными); ароматические С-нитрозосоединения, как 1-нитрозо-2-на-фтол, нитрозо-К-соли, л-нитрозодиметиланилин, нитрозоантипирин, я-нитрозодифениламин (окрашивание с первичными ароматическими аминами, веществами, содержащими подвижные атомы водорода, образуются азометиновые производные и хинонимины; с вторичными ароматическими аминами, производными индола и др.).
Способы испытаний на чистоту. Источники загрязнения лекарственных веществ. Ими являются технологические и специфические примеси — исходное сырье, аппаратура и другие вещества, используемые для получения лекарственных средств. Материал, из которого изготовлена аппаратура (металл, стекло, пластмасса), может служить источником примесей тяжелых металлов, мышьяка и других веществ. При плохой очистке в препаратах могут быть примеси растворителей, волокна тканей или фильтровальной бумаги, песок, асбест и т. д., а также остатки кислот или щелочей. На качество лекарственных веществ могут влиять и другие факторы.
Технологические факторы, такие, как степень чистоты исходных веществ, температурный режим, давление, рН среды, растворители, сушка, могут быть источником различных примесей, накапливающихся от одной стадии производства к другой. При этом возможно образование продуктов побочных реакций или продуктов распада и появление таких промежуточных веществ, от которых трудно затем отделить основной продукт. В процессе синтеза возможно также образование различных таутомерных форм как в растворах, так и в кристаллическом состоянии. Например, многие органические соединения могут существовать в амидной, имидной и других таутомерных формах. Причем в зависимости от условий получения, очистки и хранения вещество может представлять собой смесь двух таутоме-ров или других изомеров, в том числе оптических, различающихся по фармакологической активности.
Вторая группа факторов — образование различных кристаллических модификаций, или полиморфизм. Около 65% лекарственных веществ, относящихся к числу барбитуратов, стероидов, антибиотиков, алкалоидов и др., образуют по 1—5 и более различных модификаций. Остальные дают при кристаллизации стабильные полиморфные и псевдополиморфные модификации. Они различаются не только по физико-химическим свойствам и фармакологическому действию, но имеют различную величину свободной поверхностной энергии, а следовательно, неодинаковую устойчивость к действию кислорода воздуха, света, влаги, что значительно влияет на сроки хранения.
Основные примеси в лекарственных веществах, получаемых из растительного и животного сырья, — сопутствующие природные соединения (алкалоиды, ферменты, белки, гормоны и др.). Многие из них очень сходны по химическому строению и физико-химическим свойствам с основным продуктом экстракции, поэтому его очистка представляет большую сложность.
Иногда на загрязнение одних лекарственных веществ другими может влиять запыленность производственных помещений химико-фармацевтических предприятий. В рабочей зоне этих помещений при условии получения нескольких препаратов (лекарственных форм) все они могут содержаться в виде аэрозолей в воздухе. При этом происходит гак называемое «перекрестное загрязнение». На чистоту лекарственных веществ могут влиять и операторы, участвующие в синтезе (несоблюдение личной гигиены, загрязнение спецодежды, предохранительных средств личной безопасности и др.)- Не случайно в 1976 г. ВОЗ были разработаны специальные правила организации производства и контроля качества лекарственных средств, предусматривающие предотвращение «перекрестного загрязнения». На доброкачественность лекарства влияют и условия хранения. Излишняя влажность может привести к гидролизу, в результате которого образуются основные соли, продукты омыления и др. вещества, изменяющие фармакологическое действие и усиливающие их токсичность. При хранении же препаратов-кристаллогидратов (натрия арсенат, меди сульфат и др.) необходимо, наоборот, соблюдать условия, исключающие потерю кристаллизации воды.
Под влиянием света и кислорода воздуха может происходить разложение хлорной извести, серебра нитрата, йодидов, бромидов, гидроксидов и др. Следует учитывать и качество тары, в которой хранят или транспортируют лекарственные средства.
Следовательно, примеси, содержащиеся в лекарственных веществах, можно условно разделить на две группы: технологические, образовавшиеся в процессе синтеза, и приобретенные, возникшие при хранении и транспортировке. Как те, так и другие должны строго контролироваться, а лекарственное вещество должно иметь достаточную степень чистоты, отвечающую требованиям определенной спецификации.
Принято считать, что лекарственное вещество является чистым, если дальнейшая очистка не меняет его фармакологической активности, химической стабильности, физических свойств и биологической доступности.
К сожалению, в последние годы из-за общего ухудшения экологической обстановки в лекарственном и животном сырье имеется много опасных примесей, например солей тяжелых металлов, а также некоторых мутагенов и даже канцерогенов. Существует определенный фармакопейный тест на выявление примесей тяжелых металлов, применяемый во всех национальных фармакопеях мира. Данный тест рекомендуется не только для исследования индивидуальных лекарственных веществ, но и масел, экстрактов, ряда инъекционных форм. По мнению экспертов ВОЗ, такие испытания следует проводить в отношении лекарственных средств, имеющих дозы не менее 0,5 г.
Общие требования к испытаниям на чистоту. Все лекарственные препараты независимо от способа получения испытывают на чистоту и устанавливают содержание в них примесей, которые условно делят на две группы: примеси, влияющие на фармакологическое действие препарата, и примеси, указывающие на степень очистки вещества. Последние (особенно в больших количествах) снижают общую активность препарата и могут вызывать определенные побочные эффекты. Поэтому фармакопеи устанавливают пределы этих примесей в лекарственных веществах.
Таким образом, основной критерий доброкачественности лекарственного препарата — наличие допустимых пределов физиологически неактивных и отсутствие токсичных примесей. Понятие отсутствие условно и связано с чувствительностью способа испытания. Существуют общие требования, которые предъявляются к испытаниям на чистоту, — чувствительность, специфичность и воспроизводимость используемой реакции, а также пригодность ее применения для установления допустимых пределов содержания примесей. Поэтому избирают реакции с такой чувствительностью, которая позволяет определить допустимые пределы примесей. Эти пределы устанавливают предварительной биологической проверкой с учетом возможного токсического воздействия примеси.
Содержание примесей можно определить двумя путями (эталонным и безэталонным). При использовании первого пути раствор препарата сравнивают с эталонным раствором (стандартом), наблюдая изменения под воздействием определенного реактива. Второй путь — установление предела содержания примесей по отсутствию положительной реакции, используя химические реакции, чувствительность которых ниже, чем предел обнаружения допустимых примесей.
Для ускорения и наиболее точного выполнения испытаний на чистоту, их унификации и достижения одинаковой точности анализа в фармакопеях использована система эталонов. Эталон представляет собой образец, содержащий определенное количество открываемой примеси. Наличие примесей устанавливают колориметрическим или нефелометрическим методом, сравнивая результаты реакций в растворе эталона и препарата после добавления одинаковых количеств рекомендуемых реактивов. При этом необходимо соблюдать все указания, предусмотренные фармакопеями (чистота воды, точность отвешивания до 0,001 г, последовательность добавления реактивов и т. д.).
Общие испытания на примеси неорганических ионов. Проводят согласно общей статье ГФ XI, вып. 1 (с. 165) «Испытания на чистоту и допустимые пределы примесей*, в которой указаны требования и условия выполнения испытаний на хлориды, сульфаты, соли аммония, соли кальция, железа, цинка, тяжелых металлов. Там же изложены сведения об эталонных растворах, необходимых для определения указанных примесей.
При этом:
испытание на хлориды основано на их взаимодействии с ионом серебра. Хлорид серебра дает белую опалесценцию, не исчезающую при добавлении азотной кислоты и растворяющуюся в растворе аммиака;
испытание на сульфаты основано на их взаимодействии с ионом бария. Сульфат бария образует белую опалесценцию, не исчезающую от прибавления разведенной соляной кислоты;
испытание на соли аммония основано на взаимодействии реактива Несслера с образованием желто-бурого осадка или желтого окрашивания;
испытание на соли кальция основано на взаимодействии ионов кальция с оксалат-ионами. Образующийся белый мелкокристаллический осадок (опалесценция) не исчезает при добавлении уксусной кислоты, но легко растворяется при внесении соляной и азотной кислот;
испытание на соли железа (II) и (III) в зависимости от концентрации основано на образовании с раствором сульфосалициловой кислоты в аммиачной среде коричнево-красных или желтых растворов феррилсульфосалицилатных комплексов. Окраска и состав ионов комплексов зависят от рН среды;
испытание на соли цинка основано на взаимодействии их с растворами гексацианоферрата калия (И). Образуется белый осадок, нерастворимый в кислотах;
испытание на соли тяжелых металлов основано на их взаимодействии с растворами сульфидов. Образуется черный осадок или бурое окрашивание раствора. Эталоном служит раствор соли свинца.
Обнаружение примеси мышьяка. В ГФ XI принято два способа обнаружения примеси мышьяка: реакция Зангера—Блека и реакция Буго—Тиле.
Сущность реакции Зангера—Блека — восстановление соединений мышьяка, содержащихся в испытуемом препарате, цинком в специальном приборчике до арсина. С помощью данного способа можно обнаружить в реакционной смеси 0,001 мг мышьяка. Предел чувствительности можно повысить до 0,0005 мг (обработка бумаги, пропитанной раствором дихлорида ртути, раствором йодида калия). С помощью этой реакции нельзя обнаружить примесь мышьяка в присутствии соединений сурьмы, фосфора, солей тяжелых металлов, сульфид- и сульфат-ионов.
Реакция Буго—Тиле, хотя и менее чувствительна, но позволяет обнаружить примесь мышьяка и в присутствии вышеуказанных веществ. Сущность ее — использование восстановительных свойств натриевой соли фосфорноватистой кислоты (гипофосфита натрия). Последняя восстанавливает в кислой среде соединения мышьяка (III) и (V) до свободного мышьяка. Фосфорноватистая кислота при этом окисляется до фосфористой, и в зависимости от содержания примеси мышьяка появляется бурое окрашивание или бурый осадок.
Определение летучих веществ и воды. Летучие вещества могут попасть в лекарственные препараты вследствие плохой очистки или от накопления продуктов разложения. Вода в веществе может содержаться в виде капиллярной, абсорбционной связанной, химически связанной (гидратной и кристаллогидратной) или свободной.
ГФ XI предусматривает три метода определения воды в препаратах: два физических — метод высушивания и метод дистилляции и один химический — метод акваметрии. В жидких лекарственных веществах примесь воды устанавливают по помутнению при охлаждении до О °С или с помощью пикриновой кислоты (сравнивая окраску с эталоном).
Сущность метода высушивания — установление разности массы вещества до и после высушивания (сушат вещество до постоянной массы при очередном взвешивании).
Метод дистилляции основан на физическом свойстве паров двух несмешивающихся жидкостей (например, воды и органического растворителя). При этом смесь воды с органическим растворителем перегоняют при более низкой температуре, чем каждая из этих жидкостей. Содержание воды в испытуемом препарате устанавливают по объему в приемнике после окончания процесса перегонки.
Химический метод — метод акваметрии, известный под названием метода Фишера (один из вариантов акваметрии), позволяет определить суммарное содержание как свободной, так и кристаллогидратной воды в органических, неорганических лекарственных веществах, растворителях. Преимущество метода — быстрота выполнения и селективность по отношению к воде. Реактив Фишера представляет собой раствор диоксида серы, йода и пиридина в метаноле. Процесс должен осуществляться в закрытой системе, поскольку реактив сразу же взаимодействует с атмосферной влагой. К числу недостатков метода помимо соблюдения герметичности относится невозможность определения воды в присутствии веществ, которые реагируют с компонентами реактива. Например, альдегиды и кетоны взаимодействуют с метанолом, образуя ацетали (кетали). Но если метанол в реактиве заменить диметилформамидом, то определение становится возможным. Этим реактивом невозможно определить содержание воды в присутствии аскорбиновой кислоты, меркаптанов, сульфидов, гидрокарбонатов и карбонатов щелочных металлов, оксидов, гидроксидов и некоторых других соединений.
ГФ рекомендует наряду с визуальным определением эквивалентной точки реактивом Фишера (по изменению окраски от желтой до красновато-коричневой) осуществлять титрование электрометрическим методом (до полного превращения тока в конечной точке).
Следует заметить, что методы, рекомендованные ГФ для определения влажности, имеют ряд ограничений и недостатков. Перспективен для этой цели метод газожидкостной хроматографии (ГЖХ) с использованием хроматографов типа «Цвет» или ЛХМ. Испытывают образцы массой 0,003—0,02 г при температуре колонок 100 °С, детектора — 140 °С, токе детектора — 100 мА, сорбенте — полисорб-1. Содержание рассчитывают методом абсолютной калибровки. Время, затрачиваемое на два параллельных анализа, не более 10 мин. Сходность результатов ±6%. Перспективными для определения влаги могут оказаться и некоторые оптические методы, например отражательная спектрофотометрия, позволяющая измерить светоотражение анализируемых поверхностей в видимой области спектра.
Установление рН среды. Этот показатель может служить характеристикой химических свойств вещества — кислотности и щелочности, по которым определяют примеси свободных кислот и щелочей. ГФ XI из многочисленных способов определения рН среды рекомендует колориметрический, потенциометрический способы и дает описания стандартных буферных растворов и индикаторов (для первого способа) и рН-метров — для второго, который отличается более высокой точностью и основан на электродвижущей силе элемента, составленного из стандартного электрода.
Испытание на чистоту по некоторым физическим и химическим свойствам. Используют для ориентировочного представления о наличии примесей в испытуемых образцах. В этих целях определяют прозрачность и степень мутности путем сравнения вертикально установленных пробирок образца с эталоном (те же жидкости и растворители); окраску жидкостей — сравнивая испытуемый раствор с эталонной жидкостью; адсорбционную способность и дисперсность, определение золы, восстанавливающих веществ, красящих веществ, кислотное число (масса гидроксида калия в миллиграммах, которая необходима для нейтрализации свободных кислот, содержащих в 1 г испытуемого вещества); число омыления (масса гидроксида калия в миллиграммах, которая необходима для нейтрализации свободных кислот и кислот, образующихся при полном гидролизе сложных эфиров, содержащихся в 1 г испытуемого вещества); эфирное число (масса гидроксида калия в миллиграммах, которая необходима для нейтрализации кислот, образующихся при гидролизе сложных эфи-ров, содержащихся в 1 г исследуемого вещества, т. е. разность между числом омыления и кислотным числом); йодное число (масса йода в граммах, которая связывает 100 г исследуемого вещества). В ГФ XI приведены методики указанных констант и способы их расчета.
Испытания на специфические примеси. Дают наибольшую эффективность при оценке чистоты лекарственного вещества. Специфические примеси могут представлять собой либо промежуточные продукты синтеза, либо продукты разложения, либо сопутствующие БАВ (из источников растительного и животного происхождения). Эти примеси влияют не только на характер фармакологического действия, но могут представлять собой токсичные продукты. Количество этих примесей строго нормируется ГФ XI и другой НТД. Суть определения этих примесей можно условно разделить на пять групп:
1)способы оценки чистоты, основанные на установлении таких констант, как температура плавления, растворимость, удельное вращение, удельный показатель поглощения растворов и др. Эти константы позволяют не только идентифицировать лекарственные вещества, но и оценивать их чистоту. В ГФ и другой НТД приведены не константы индивидуальных (свободных от примесей) веществ, а допустимые пределы значений этих констант, т. е. такие их интервалы, в которых сохраняется достаточная степень чистоты препарата;
2)способ, основанный на приготовлении эталонного раствора из вещества, являющегося примесью к данному препарату. Готовят испытуемый раствор препарата и эталонный раствор, содержащий предельно допустимое количество химически чистой примеси. Затем к обоим растворам добавляют соответствующий реактив. Интенсивность окраски или опалесценции у раствора препарата должна быть меньше, чем у эталона;
3)выделение примеси из
препарата бумажной хроматографией. Одновременно получают хроматограмму
«свидетеля»- (стандартного образца примеси). Проявляют хроматограмму с помощью
реактивов или наблюдают окраску пятен в ультрафиолетовом свете, сравнивая
результаты. Этот метод широко используют для установления примесей некоторых
гликозидов в препаратах (целанида, дигитоксина), а также для обнаружения
примесей посторонних стероидов в препаратах (кортизон-
ацетата, преднизона, преднизолона, метандростенолона и др.);
4)методы, основанные на избирательном взаимодействии примесей с каким-либо реактивом. При этом наблюдают появление или отсутствие опалесценции, регламентированное определенным временем;
5)метод, основанный на сочетании экстракции (чаще всего эфиром) примеси с последующей отгонкой растворителя и взвешивания остатка, который должен либо отсутствовать, либо не превышать 0,1—0,2%. Вместо взвешивания количество извлеченной примеси можно определять каким-либо титриметрическим методом. Иногда примесь извлекают водой из препарата, практически нерастворимого в воде, а фильтрат испытывают на отсутствие (присутствие) примеси с помощью какой-либо цветной реакции.
В ГФ XI и другой НТД регламентировано отсутствие или допустимые пределы примесей некоторых исходных продуктов синтеза как неорганических, так и органических веществ.
Методы количественного определения лекарственных веществ. Количественное определение лекарственного вещества — заключительный этап фармацевтического анализа. Оно выполняется после того как испытуемое вещество идентифицировано и установлено наличие допустимого количества примесей различными методами, обеспечивающими достаточную точность. Однако эти методы не всегда специфичны, особенно для органических лекарственных веществ. Обычно количественное содержание препарата устанавливают по какому-либо одному его химическому свойству, связанному наличием той или иной функциональной группы, атома (катиона, аниона), в ряде случаев — по количеству связанной с органическим основанием минеральной кислоты. В этих целях применяют четыре группы методов: химические, физические, физико-химические и биологические. При этом химические реакции, используемые для идентификации, в ряде случаев используют и для количественного определения.
Химические методы. Количественное определение лекарственных веществ можно проводить гравиметрическим (весовым) и титриметрическим (объемным) методами, газометрическим и количественным элементным анализом.
Гравиметрический (весовой) метод применяют для определения сульфатов, переводя их в нерастворимые соли бария, и силикатов, предварительно прокаливая их до диоксида кремния, а также ряда других веществ.
Рекомендуемые ГФ методы гравиметрического анализа препаратов солей хинина основаны на осаждении основания этого алкалоида раствором гидроксида натрия. Аналогично определяют бигумаль. Препараты бензилпенициллина осаждают в виде N-этилпепиридиновой соли бензилпенициллина; прогестерон — в виде гидразона. Возможно применение гравиметрии для определения алкалоидов (взвешиванием свободных от примесей основания или пикратов, пикро-лонатов, кремневольфраматов, тетрафенилборатов), а также для определения некоторых витаминов, которые осаждают в виде нерастворимых в воде продуктов гидролиза (викасол, рутин) или в виде кремневольфрамата (тиамина бромид). Известны также гравиметрические методы, основанные на осаждении из натриевых солей кислотных форм барбитуратов.
Титриметрические (объемные) методы наиболее распространены в фармацевтическом анализе, они менее трудоемки по сравнению с гравиметрическими и достаточно точны. Для этого используют титрированные растворы (титранты), имеющие точно известную концентрацию, выражаемую в нормальности. В ГФ XI, вып. 2, с. 61—81 описаны способы приготовления и установка титра таких растворов, В соответствии с СИ и рекомендациями ИЮПАК основной единицей количества вещества является моль, поэтому содержание веществ в титрантах в молярной концентрации — это выраженное в молях количество растворенного вещества в 1 л раствора (моль/л). Согласно требованиям ГФ XI молярную концентрацию ср вычисляют двумя способами.
Способ
расчета по навеске химически чистого вещества проводят по формуле ![]()
где а — масса химически чистого вещества, г; 1000 — количество миллилитров в 1 л раствора; М— молярная масса условных частиц химически чистого вещества, г/моль; V'— объем раствора, израсходованный на титрирование навески, мл.
Способ,
основанный на вычислении молярной концентрации по титрованному раствору
известной концентрации или по фисканалу. Расчет выполняют по формуле ![]()
где с0 - молярная концентрация раствора вещества, по которому устанавливают титр, моль/л; Vg — объем раствора, по которому устанавливают титр, мл; V — объем раствора определяемой молярной концентрации, мл.
В приготовленных титрованных растворах вычисляют поправочный коэффициент к молярной концентрации (К). Он представляет собой отношение полученной концентрации к теоретически заданной и должен быть в пределе 0,98-1,02. При больших отклонениях величины К титрованных растворов необходимо повысить концентрацию или разбавить раствор и вновь вычислить поправочный коэффициент.
Химические вещества, позволяющие при титриметрических определениях устанавливать прибавление эквивалентного количества титранта к анализируемому веществу, называют индикаторами. Изменения, происходящие с ними в точке эквивалентности, устанавливают визуальными или инструментальными способами. В зависимости от типа используемых при анализе химических реакций индикаторы делят на кислотно-основные для водных и неводных средств, металлохромные, используемые в комплексонометрии, адсорбционные и окислительно-восстановительные. Растворы индикаторов и индикаторные смеси готовят из веществ классификации «химически чистый» (х. ч.) или «чистый для анализа» (ч. д. а.), такой же квалификации должны быть и другие, используемые при приготовлении растворов и смесей, вспомогательные вещества. В ГФ XI, вып. 2 с. 82— 102 приведены рациональные химические названия, физические свойства, способы приготовления растворов, индикаторов и индикаторных смесей, интервалы рН, при которых происходит переход окраски их растворов, а также описание индикаторной бумаги.
Используемые в фармацевтическом анализе титриметрические методы можно подразделить на осадительное титрирование, кислотно-основное, окислительно-восстановительное, комплексонометрию и нитритометрию. С их помощью количественную оценку производят, проводя определение отдельных элементов или функциональных групп, без предварительной деструкции молекулы или после ее деструкции. Указанные методы являются групповыми и не всегда дают возможность судить о доброкачественности вещества, поскольку фармакологические свойства лекарственных веществ зависят не только от указанных выше идентифицированных групп.
Осадительное титрирование включает в себя: аргентометрическое титрование, меркуриметрию и меркурометрию.
Аргентометрия основана на реакциях осаждения галогенов раствором нитрата серебра (титрант) и может быть выполнена прямым и обратным методами. Эквивалентную точку при прямом методе устанавливают с помощью индикатора хромата калия (метод Мора) или с адсорбционными индикаторами (метод Фаянса). При обратном аргентометрическом титровании (метод Фольгарда) индикатором избыток нитрата серебра оттитровывают тиоцианатом аммония. Этот же химический процесс лежит в основе количественного определения серебра и известен под названием тиоцианатометрии или рода-нометрии. Обоими методами определяют неорганические лекарственные вещества — галогениды (хлориды, бромиды, йодиды), щелочные металлы, галогениды четвертичных аммониевых оснований (пента-мин) и соли галогеноводородных кислот (гидрохлориды, гидробромиды, гидройодиды), органических оснований (ганглерон, тримека-ин, ксикаин), в том числе алкалоидов (морфина гидрохлорид, пахи-карпина гидройодид).
Прямой метод используют для количественного определения йод-метилатов органических оснований (метацин), дийодметилатов (ди-тилин), йодэтилатов (кватерон). Этим же методом определяют сульфаниламиды, образующие соли серебра.
Обратной аргентометрией можно определить препараты натрия я-аминосалицилат, меркаптопурин, этоксид, образующие соли серебра.
Для аргентометрического определения органических веществ, содержащих галогены, связанные с органической частью молекулы, необходимо атомы галогенов предварительно превратить в ионы. При этом используют термические методы, а также щелочные или восстановительное дегалогенирование.
Меркуриметрия основана на образовании малодиссоциированных соединений ртути (II). Например, при взаимодействии нитрата ртути с хлорид-ионами получается малодиссоциированный дихлорид ртути. При титровании хлоридов в качестве индикаторов используют дифенилкарбазид или дифенилкарбазон. В эквивалентной точке они образуют сиреневого цвета комплексные соединения с ионом ртути (И), содержащимся в точке титранта.
Меркурометрия в отличие от меркуриметрии используют для определения анионов (в основном галогенидов), образующих малорастворимые соединения с катионами ртути (I), содержащимися в тит-ранте. При определении галогенидов в качестве индикаторов используют также бромфеноловый синий и дифенилкарбазон, но в отличие от кислотно-основного и меркуриметрического титрования они выполняют роль адсорбционных индикаторов (подобно эозина-ту натрия в аргентометрии).
Кроме выше перечисленных методов при осадительном титровании используют висмутометрию, пикриновую кислоту, определение по сульфат-иону.
Кислотно-основное титрование (метод нейтрализации) наиболее широко применяют в фармацевтическом анализе. Его используют для определения более 40% фармакопейных лекарственных веществ.
Титрование в водной среде заключается в том, что растворимые в воде вещества с кислотными свойствами титруют растворами гидроксида натрия, а вещества основного характера — растворами соляной или серной кислоты. В качестве индикаторов используют красители, изменяющие окраску в широком диапазоне рН — от 1,2 до 10,5. В фармакопейном анализе наиболее часто используют: метиловый оранжевый (3,1—4,4), метиловый красный (4,8—6,0), бромтимоловый синий (6,0—7,6), феноловый красный (6,4—8,0), фенолфталеин (8,2— 10,0) и тимолфталеин (9,4-10,6).
Ацидометрией определяют натриевые соли неорганических и органических кислот (натрия гидрокарбонат и тетраборат, калия ацетат, натрия бензоат, натрия салицилат, натрия л-аминосалицилат, кофеин-бензоат натрия и др.), используя в качестве титранта соляную кислоту, в том числе определяют соли барбитуратов.
Алкалиметрию используют для количественного определения лекарственных веществ, представляющих собой неорганические (соляная, борная) и органические (уксусная, лимонная, глутаминовая, аскорбиновая, никотиновая) кислоты, а также вещества сложной гетероциклической структуры, содержащие в молекуле карбоксильную группу (салюзид). Соли органических оснований (в том числе алкалоидов, витаминов) определяют по связанной соляной, азотной или фосфорной кислоте (хинозол, секуринина нитрат, пиридоксина гидрохлорид и др.). Щелочью также титрируют лактаты, гидротартраты органических оснований.
Иногда, например при определении препаратов ртути (II), используют косвенную нейтрализацию. Ртути оксид желтый, амихло- . рид и цианид под действием йодида калия образуют гидроксид калия или аммиак, которые затем титрируют соляной кислотой.
Формольное титрование (метод Серенсена). Первичные алифатические и ароматические аминокислоты и их соли (кислота амино-капроновая, калия и магния аспарагинаты, кислота глутаминовая, ПАСК-натрий), взаимодействуя с раствором формальдегида, образуют азометины. При этом происходит усиление кислотных свойств аминокислоты и ее титруют раствором гидроксида натрия с индикатором фенолфталеином, натриевые соли (ПАСК-натрий) титруют методом формольного титрирования в среде смешанных растворителей (смесь метанола и ацетона) с использованием индикатора тимолового синего.
Оксимный метод основан на нейтрализации эквивалентного количества соляной кислоты, выделившейся в результате взаимодействия гидроксиламина гидрохлорида с кетопроизводными. Метод применяют для определения бициклических терпенов (камфора) и стероидных соединений, содержащих в молекуле кетогруппу.
Косвенное определение алкалоидов теобромина и теофиллина проводят реакцией осаждения ионами серебра, сопровождающейся выделением эквивалентного количества азотной кислоты, которую затем выявляют алкалиметрическим методом. Аналогичный принцип лежит в основе определения мерказолина.
Титрование в смешанных растворителях, состоящих из воды и органических растворителей, проводят тогда, когда препарат плохо растворим в воде или водные растворы имеют слабо выраженные кислотные (щелочные) свойства. Так, при алкалиметрическом титровании плохо растворимых в воде органических кислот (ацетилсалициловой, салициловой, бензойной, цинхофена) растворителем служит спирт, а титрантом — водный раствор гидроксида натрия. Смешанные растворители (спирт-вода или ацетон-вода) используют для алкалиметрического титрования сульфаниламидов. Не смешивающиеся между собой растворители (воду и хлороформ) сочетают при определении некоторых солей органических оснований — производных я-аминобензойной кислоты.
Титрование в среде неводных растворителей (неводное титрование) применяют для веществ, обладающих кислотными и основными свойствами, но трудно растворимых в воде. При этом можно осуществлять выбор неорганического растворителя, который способен изменять силу кислотных или основных свойств вещества. В качестве тит-рантов используют растворы сильных кислот и оснований. Метод требует наличия герметизированной титровальной установки.
Неводное титрование органических оснований (и их солей) выполняют, используя в качестве растворителя безводную уксусную кислоту с уксусным ангидридом. Титрантом служит раствор уксусной кислоты, а индикатором — раствор кристаллического фиолетового, тропеолина 00 или метилового оранжевого. Хлорной кислотой в неводной среде титруют соли сильных оснований и слабых кислот (калия ацетат). По этой схеме можно оттитровать многие лекарственные вещества основного характера (производные пиразолона — амидопирин; пиридина — никотинамид, фтивазид; основания различной структуры — адреналин, норадреналин, гидротартраты, нит-ранол, хингамин, трихомонацид, нафтамон и др.). Исключение составляют галогениды четвертичных аммониевых оснований и соли галогеноводородных кислот (гидрохлориды, гидробромиды, гидройо-диды органических оснований). Поэтому галогеноводороды титруют в присутствии ацетата ртути (II) или в качестве растворителей используют смесь муравьиной кислоты и уксусного ангидрида 1:20.
Неводное титрирование органических веществ, проявляющих кислотные свойства, выполняют, используя обычно в качестве растворителя диэтил форм амид или его смесь с бензолом, а также этилен-диамин, бутиламин, пиридин. Титрантом служит раствор гидроксида натрия в смеси метилового спирта и бензола или раствор метилата натрия (лития), индикатор — тимоловый синий. Определяют фенолы, карбоновые кислоты, аминокислоты, сульфаниламиды, барбитураты, производные тиоурацила и др. Барбитал, фенобарбитал, фталазол титрируют в среде диметилформамида раствором гидроксида натрия, а вещества с более слабо выраженными кислотными свойствами (фенолы) — раствором метилата натрия.
Окислительно-восстановительное титрирование предусматривает использование йодометрии, йодхлорометрии, броматомет-рии, дихроматометрии, перманганатометрии, периметрии.
Йодометрия основана на использовании окислительных свойств свободного йода и восстановительных свойств йодид-ионов. Этим методом определяют количество органических и неорганических веществ, способных окисляться или восстанавливаться, а также образовывать с йодидом продукты замещения. Индикатором служит крахмал, образующий с йодидом соединение, окрашенное в синий цвет (определяют: натрия тиосульфат, препараты мышьяка (Ш), хлоралгидрат, формальдегид, фурацилин, метионин, анальгин и др.).
Йодометрию используют для определения фтивазида, апрессина и кислоты аскорбиновой. Происходит процесс окисления веществ титрованным раствором йодата калия. Избыток титранта устанавливают йодометрическим методом.
Вещества, образующие осадки, — полийодиды также можно опреде- -лять этим методом: ряд алкалоидов (хинина гидрохлорид, папаверина гидрохлорид, кодеин, кофеин, кокаина гидрохлорид, пахикарпина гид-ройодид), витаминов (тиамина бромид), гетероциклические основания и их соли (хинозол, спазмолитин, дипрофен, дибазол, карбахолин, ква-терон, амидопирин), четвертичные аммониевые соли (прозерин) и др.
Иодхлорометрия — метод аналогичный йодометрии, но отличается тем, что в качестве титранта используют раствор йодмонохлорида, обладающего большей устойчивостью. По ГФ этим методом определяют этакридина лактат. Также можно определять фенолы, сульфаниламиды, производные я-аминобензойной кислоты и другие первичные ароматические амины.
В броматометрии в качестве титранта используют бромат калия, проявляющий в кислой среде окислительные свойства. Определение обычно ведут в присутствии бромида. Индикаторами служат красители из азосоединений (метиловый красный и оранжевый), которые окисляются и обесцвечиваются под действием избытка титранта после достижения эквивалентной точки. Этим методом определяют неорганические соединения мышьяка и элементоорганические, но после предварительной минерализации. При количественном определении производных фенолов (фенол, тимол, резорцин, салициловая кислота) и первичных ароматических аминов используют метод обратной броматометрии. Вьщеляющийся бром (в присутствии бромида) расходуется на галогенирование фенолов или аминов, образуя ди- или трибром-производные. Избыток брома определяют йодометрическим методом.
На основе бромат-бромидной реакции разработаны методы кинетического определения фенола, фентоламина гидрохлорида, карби-дина, апрессина, производных я-аминобензойной кислоты в готовых лекарственных формах.
Дихроматометрия — метод, основанный на осаждении титрованным раствором дихромата калия некоторых солей органических оснований (метиленовый синий, акрихин). Нерастворимые дихроматы оснований отфильтровывают, а избыток титранта определяют йодометрическим методом.
Перманганатометрия основана на использовании перманганата калия (титрант) в сильнокислой среде. При прямом титрировании индикатором является сам титрант, избыток которого придает раствору розовое окрашивание. Прямым титрованием определяют железо, восстановленное и пероксид водорода. Натрия нитрит определяют обратным титрированием. Избыток титранта устанавливают йодометрически. Определение йодидов щелочных металлов и органически связанного йода в раде иодорганических веществ также можно произвести окислением перманганата калия в сернокислой среде до йодноватой кислоты с последующим ее титрованием йодометрическим методом. Этот способ имеет преимущества перед фармакопейным, основанным на восстановительной минерализации с аргенто-метрическим окончанием.
Цериметрия основана на использовании в качестве титранта солей церия (IV), которые в кислой среде восстанавливаются до церия (III). Индикаторами служат дифениламин или о-фенантролин (фе-роин). При обратном титрировании избыток титранта (сульфат церия) определяют йодометрически. Цериметрию используют в анализе как неорганических [железа (II), мышьяка], так и органических (углеводов, органических кислот, производных фенотиазина) лекарственных веществ, а также для определения викасола, токоферола ацетата и производных бензотиадиазепина (дихлотиазид). Преимущества метода — соединения церия (IV) обладают устойчивостью в титрированных растворах и не образуют промежуточных продуктов взаимодействия.
Комплексонометрия. Метод основан на образовании прочных, растворимых в воде комплексов катионов металлов с трило-ном Б — динатриевой солью этилендиаминтетрауксусной кислоты (ЭДТА) или другими комплексонами. Взаимодействие происходит в стехиометрическом соотношении 1:1 независимо от заряда катиона. Метод применяют для определения неорганических и элементоорга-нических лекарственных препаратов, содержащих ионы магния, калия, цинка, висмута, свинца, алюминия и др. Для визуального установления точки эквивалентности используют индикаторы, называемые металлоиндикаторами, представляющие собой органические красители, которые образуют с указанными ионами непрочные ярко окрашенные комплексы. В конце титрования комплексы разрушаются, меняя окраску в эквивалентной точке.
В ГФ металлоиндикаторами используют ксиленоловый оранжевый, хальконкарбоновую кислоту, хромовый темно-синий (кислотный хром темно-синий), эриохром черный Т (протравной черный II). Применяют прямое и обратное титрование.
Нитритометрия основана на реакциях первичных ароматических аминов с нитритом натрия, который используют в качестве титранта. Первичные ароматические амины образуют с нитритом натрия диазосоединения в кислой среде. Эквивалентную точку устанавливают с помощью внешних (йодкрахмальная бумага) и внутренних индикаторов (тропеолин 00, нейтральный красный, смесь тропеолина 00 с метиленовым синим) или потенциометрически (индикатор — платиновый электрод, а электрод сравнения — хлорсереб-ряный или насыщенный каломельный). Метод применяют для определения сульфаниламидов, производных л-аминобензойной кислоты (анестезин, новокаин, новокаинамид), л-аминосалициловой кислоты (натрия л-аминосалицилат), представляющих собой первичные ароматические амины, а также вторичные амины (дикаин).
Газометрический анализ имеет ограниченное применение в фармацевтическом анализе. Определяют газообразные вещества — кислород, циклопропан. Сущность определения кислорода заключается во взаимодействии его с поглотительным раствором, содержащим легкоокисляющийся медно-аммиачный комплекс. Опре- деление проводят на приборе Гемпеля, измеряя объем непрореагиро-вавшего газа (ГФ IX, с. 349). Аналогично определяют циклопропан (ГФХ, с. 228).
Количественный элементный анализ используютдля определения органических и элементоорганических соединений, содержащих азот, серу, галогены, а также мышьяк, висмут, ртуть, сурьму и другие элементы.
Фармакопейный метод определения азота в органических соединениях известен как метод Кьельдаля. Он основан на сочетании минерализации органического вещества с последующим кислотно-основным титрованием. Используют для анализа азотсодержащих органических веществ, а также лекарственных веществ, содержащих аминный, амидный и гетероциклический азот. Определение проводится в несколько стадий. Существует упрощенный вариант метода, исключающий минерализацию.
Метод сжигания в колбе с кислородом ~ перспективный в фармацевтическом анализе. Основан на разрушении органического вещества (сжигание в колбе с кислородом), растворении образовавшихся продуктов в поглощающей жидкости и последующим определении элементов, находящихся в растворе в виде ионов или молекул. Определение выполняют химическими или физико-химическими методами. Выявляют органические вещества, содержащие в молекуле галогены, серу, фосфор, азот и другие элементы. Преимущества метода — быстрота и отсутствие минерализации. ГФ рекомендует метод для определения йода в йодоорганических веществах. Однако исследования показывают, что он пригоден для определения многих других веществ.
Количественный элементный анализ галоген-, мышьяк- и ртутьсодержащих лекарственных веществ с предварительной минерализацией. ГФ рекомендует метод для определения йодосодержащих органических лекарственных веществ, основанный на минерализации и окислении образовавшегося иона йода в йодат-ион. Последний регистрируют, используя в качестве восстановителя йодит калия по общему принципу йодотометрии. Аналогично определяются галогены, мышьяк и ртуть.
Физические и физико-химические способы анализа. Эти методы приобретают все большее значение как недеструктивный анализ (без разрушения анализируемого объекта). Для его выполнения пригодны многие физические и физико-химические методы, такие, как оптические ЯМР-, ПРМ-, УФ- и ИК-спектроскопия, ГЖХ, ВЭЖХ и др. В фармацевтическом анализе эти методы классифицированы на следующие группы: оптические; основанные на поглощении излучения; основанные на испускании излучения; основанные на использовании магнитного поля; электрохимические; разделения; термические. Эти методы имеют ряд преимуществ перед химическими. Они основаны на использовании как химических, так и физических свойств веществ и в большинстве случаев отличаются экспрессивностью, возможностью унификации и автоматизации.
Оптические методы основаны на определении показателя преломления луча света в растворе испытуемого вещества (рефрактометрия), измерении интерференции света в растворе испытуемого вещества (интерферометрия), способности раствора вещества вращать плоскость поляризованного луча (поляриметрия).
Рефрактометрию используют для испытания подлинности лекарственных веществ, представляющих собой жидкости (диэтиламид никотиновой кислоты, метилсалицилат, токоферола ацетат), а также для внутриаптечного контроля лекарственных форм, в том числе двойных и тройных смесей.
Интерферометрический метод используют для анализа лекарственных препаратов, титрованных растворов и дистиллированной воды.
Поляриметрию применяют для анализа веществ, в молекуле которых имеется асимметричный атом углерода.
Помимо этих методов используют химическую микроскопию и др.
Методы, основанные на поглощении излучения (абсорбционные методы), используют свойства веществ поглощать свет в различных областях спектра.
Атомно-абсорбционная спектрофотометрия основана на использовании ультрафиолетового или видимого излучения резонансной чистоты. Поглощение излучения вызывается переходом электронов с внешних орбиталей атомов на орбитали с более высокой энергией. Объектами, поглощающими излучение, являются газообразные атомы, а также некоторые органические вещества. Сущность этого метода состоит в том, что через пламя, в котором распыляется анализируемый раствор, проходит резонансное излучение от лампы с полым катодом. Это излучение попадает на входную щель монохрома-тора, причем из спектра выделяется только резонансная линия испытуемого элемента. Расчет концентрации производят с помощью специального уравнения. Имеются специальные атомно-абсорбционные спектрометры.
Ультрафиолетовая спектрофотометрия — наиболее простой абсорбционный метод анализа. Он разработан для анализа многих лекарственных веществ, методики которых изложены в различных НТД и ГФ XI.
Дифференциальные методы позволяют расширить область применения фотометрии в фармацевтическом анализе. Например, сущность метода дифференциальной спектрофотометрии и фотоколориметрии, включенного в ГФ XI, вып. I, с. 40, состоит в изменении светопоглощения анализируемого раствора относительно раствора сравнения, содержащего определенное количество испытуемого вещества.
Фотоколориметрический метод широко применяют в фармацевтическом анализе. В отличие от УФ-спектрофотометрии определение в этом случае осуществляют в видимой области спектра, при этом вещество с помощью какого-либо реагента переводят в окрашенное соединение, а затем измеряют интенсивность окраски раствора в фотоколориметре. Метод включен в НТД для количественного определения ряда нитропроизводных (нитроглицерина, фурадонина, фуразолидона), а также витаминов (рибофлавина, фолиевой кислоты) и сердечных гликозидов (целанида). Разработаны многочисленные методики фотоколориметрического определения препаратов в лекарственных формах.
Кроме того, в фармацевтическом анализе используют фототурбодиметрию и фотонефелометрию, хронофототурбодиметрию, термонефелометрию и инфракрасную (ИК) спектроскопию и их различные модификации.
К методам, основанным на испускании излучения, относят фотометрию пламени, флуоресцентные и радиохимические методы.
Эмиссионная и пламенная спектрометрия включена в ГФ XI для качественного и количественного определения химических элементов и их примесей в лекарственных веществах. Измерение интенсивности излучения спектральных линий испытуемых элементов выполняют на пламенных фотометрах. Регистрирующими системами служат фотоэлементы, связанные с цифровыми и печатающими устройствами. Точность определения этими методами находится в пределах 1—4% , предел обнаружения может достигать 0,001 мкг/мл.
Люминесцентные методы основаны на измерении вторичного излучения, возникающего в результате воздействия света на анализируемое вещество. К их числу относят флуоресцентные методы, хе-милюминесцентные методы, рентгенофлуоресценцию и др., для чего используют ряд приборов, например спектрофлуориметры, сравнивая на них показания испытуемых образцов со свидетелями (эталонными образцами).
К методам, основанным на использовании магнитного поля, относятся ЯМР- и ПМР-спектроскопии, масс-спектроскопия, отличающиеся высокой специфичностью, чувствительностью и возможностью анализировать многокомпонентные смеси, в том числе лекарственные формы без предварительного их разделения. При использовании данных методов подлинность лекарственных веществ может быть подтверждена либо по полному набору спектральных параметров, характеризующих структуру данного соединения, либо по наиболее характерным сигналам спектра. Подлинность можно установить с помощью стандартного образца, добавляя его количество к анализируемому раствору. Полное совпадение спектров анализируемого вещества и его смеси со стандартным образцом указывает на их идентичность. В специальных аннотациях изложены правила работы со спектрофотометрами и другой аппаратурой, используемой для этих методов, а также указаны лекарственные вещества, которые можно определять ими.
Электрохимические методы анализа основаны на электрохимических явлениях, происходящих в исследуемой среде и связанных с изменениями химической структуры, физических свойств или концентрации веществ.
Потенциометрия основана на измерении равновесных потенциалов, возникающих на границе между испытуемым раствором и погруженным в него электродом (ГФ XI, вып. 1, с. 121).
Амперометрическое титрирование с двумя индикаторными электродами, или титрирование «до полного прекращения тока», основано на использовании пары идентичных инертных электродов (платина, золото), которые находятся под небольшим напряжением. Часто используют для нитритойодометрического титрования. Точку эквивалентности находят по резкому увеличению силы тока, проходящего через ячейку (в течение 30 с) после добавления последней порции реагента (ГФ XI, вып. 1, с. 123). Разновидностью этого метода является ионометрия с использованием ионоселективных электродов.
Полярография — метод анализа, основанный на измерении силы тока, возникающего на микроэлектроде при электровосстановлении или элек-троокислении анализируемого вещества в растворе. Электролиз проводят в полярографической ячейке, которая состоит из электролизера (сосуда) и двух электродов. Используют методы калибровочных кривых, стандартных растворов и добавок (ГФ XI, вып. 1, с. 154).
Кроме того, из электрохимических методов можно использовать кондуктометрию, кулонометрию и метод диэлектрических измерений.
К методам разделения, которые часто используют в фармацевтическом анализе, относятся хроматография, электрофорез и экстракция.
Хроматографические методы разделения веществ основаны на их распределении между двумя фазами: подвижной и неподвижной. Подвижной фазой может быть жидкость или газ, неподвижной — твердое вещество или жидкость, адсорбированная на твердом носителе. Отношение скорости перемещения вещества к скорости перемещения растворителя обозначают Rf. Эта величина — константа вещества для данных условий разделения и используется для идентификации. Хроматофафия дает возможность наиболее эффективно осуществлять избирательное распределение компонентов анализируемого вещества (очень важно при исследовании смеси из нескольких веществ). По механизму процесса разделения хроматофа-фические методы классифицируют на ионообменную, адсорбционную, осадочную, распределительную, окислительно-восстановительную хроматографию. По форме проведения процесса выделяют колоночную, капиллярную и плоскостную хроматографию. Подробное описание приборов и методик изложено в ГФ XI, вып. I, с. 98 и другой НТД.
К данным методам относят и газожидкостную (газовую) хрома-тофафию (ГЖХ), основанную на распределении вещества между газовой и жидкой или твердой фазами, а также жидкостную хромато-фафию (ЖХ), отличающуюся от газовой тем, что подвижной фазой служит не газ, а жидкость. Вариантом последней ЖХ является высокоэффективная жидкостная хроматофафия (ВЭЖХ), которую называют также жидкостной хроматофафией высокого давления.
Широкое применение при анализе получила хроматофафия в тонком слое сорбента (ТСХ, ГФ XI, вып. 1, с. 102), отличающаяся от хроматофафии на бумаге тем, что процесс, протекающий при перемещении подвижной фазы, происходит на сорбенте, нанесенном тонким слоем на инертную поверхность, чем достигается высокая чувствительность, простота использования и устойчивость к температурным и химическим воздействиям.
Иногда для идентификации ряда лекарственных веществ сочетают ТСХ с ИК-спектроскопией, УФ-спектроскопией и другими методами и их модификациями.
Электрофорез на бумаге и в тонких слоях сорбента по технике выполнения и аналитическим возможностям сходен с ТСХ. В ГФ XI включен электрофорез, как метод анализа, основанный на способности перемещения заряженных частиц в электрическом поле и их регистрации. Различают фронтальный, зональный электрофорез, иммуноэлектрофорез и метод пептидных карт (сочетание бумажной и тонкослойной хроматофафии с высоковольтным электрофорезом).
Термические методы анализа. В зависимости от природы веществ, температуры и условий нафевания в них могут происходить химические превращения, структурирование, термическая, окислительная или гидролитическая деструкция. Термическая деструкция сопровождается поглощением или выделением теплоты, а также выделением газов, которые можно фиксировать.
Термография позволяет оценить термическую стабильность по температурам термоэффекта связанного с деструкцией вещества, поэтому термический анализ находит применения в фармацевтической химии.
Термический анализ основан на точной (до 0,1 °С) регистрации равновесного состояния между кристаллической и жидкой фазами анализируемого вещества. Основные недостатки этого метода: невозможность использования для исследования термолабильных веществ; значительные затраты времени; отсутствие должной воспроизводимости. Существует несколько модификаций метода: термомикроскопический метод; дифференциальный термический анализ; дериватогра-фия; дифференциальная сканирующая колориметрия; метод дифференциальной микроколориметрии, термофрактография и др.
Биологические методы анализа. Биологический контроль качества лекарственных средств обычно проводят по силе фармакологического эффекта или токсичности. Эти методы применяют тогда, когда с помощью химических, физических или физико-химических методов не удается сделать заключение о чистоте или токсичности препарата или когда способ получения препарата не гарантирует постоянства активности (например, антибиотики). Биологические испытания проводят на животных (мыши, крысы, кролики, морские свинки, а также кошки, собаки, лягушки), отдельных изолированных органах (рог матки, часть кишки, кожа), отдельных группах клеток (культура клеток, форменные элементы крови) и на определенных сероварах микроорганизмов. Активность ряда препаратов при этом выражают в единицах действия (ЕД), например, при определении гликозидов, антибиотиков и др.
Биологический контроль на сердечные гликозиды проводят как растительного сырья, так и самих препаратов (ГФ XI), например, разных видов наперстянки, горицвета, ландыша, строфанта, желтушника. Испытания проводят на лягушках, кошках и голубях, устанавливая соответственно лягушачьи (ЛЕД), кошачьи (КЕД) и голубиные (ГЕД) единицы действия. Одна ЛЕД соответствует дозе стандартного образца, вызывающей в условиях опыта систолическую остановку сердца у большинства подопытных стандартных лягушек (самцы массой 28—33 г). Одна КЕД или ГЕД соответствует дозе стандартного образца или испытуемого препарата из расчета на 1 кг массы животного, в том числе птицы, также вызывающего систолическую остановку сердца кошки или голубя. Содержание ЕД рассчитывают в 1 г растительного сырья или сухих концентратов, в одной таблетке или в 1 мл (в жидких лекарственных формах).
Испытание на токсичность проводят согласно ГФ XI, вып. 2, с. 182, для чего отбирают по два флакона или две ампулы от каждой серии, содержащей не более 10 000 ед. Из партий большего количества отбирают по 3 ампулы (флакона) от каждой серии. Содержимое отобранных проб одной серии смешивают и испытывают на здоровых белых мышах (массой 19—21 г). Раствор вводят в хвостовую вену пяти мышам и наблюдают за ними 48 ч. Препарат считается выдержавшим испытания, если в течение указанного времени не погибнет ни одна мышь. Если погибнет хоть одна мышь, испытание повторяют по определенной схеме. В статьях НТД указаны дозы введения раствора для каждого препарата. При повторении отрицательных результатов партия бракуется.
Испытания на пирогенность. Пирогенную реакцию (повышение температуры тела) вызывают живые и мертвые микроорганизмы (чаще грамотрицательные). Допустимо содержание, например, в изотоническом растворе натрия хлорида 10 микроорганизмов в 1 мл, а при введении не более 100 мл допускается 100 микроорганизмов в 1 мл. Испытанию на пирогенность подвергают воду для инъекций, инъекционные растворы, иммонобиологические лекарственные средства, растворители, используемые для приготовления инъекционных растворов, а также лекарственные формы, вызывающие пирогенную реакцию.
В ГФ XI включен биологический метод испытания на пирогенность, основанный на измерении температуры тела кроликов после введения в ушную вену испытуемых стерильных жидкостей. Отбор проб ведется так же как при испытании на токсичность (ГФ XI, вып. 2, с. 183-185).
Испытуемые жидкости считают непирогенными, если сумма повышений температуры у всех трех кроликов не превышает или равна 1,4 "С. Если сумма температур превышает 2,2 °С, то жидкость считают пирогенной, если меньше 2,2 °С, то дальнейшее испытание проводят уже на восьми кроликах. Жидкость считают непиро-генной, если сумма повышения температур у всех восьми кроликов не более 3,7 "С.
В последнее время для определения пирогенности испытывают различные физические и физико-химические методы, например спек-трофотометрию, полярографию и др.
На содержание веществ гистаминоподобного действия испытывают парентеральные лекарственные средства на взрослых кошках. Методика испытания подробно описана в НТД.
Микробиологический контроль проводят для нестерильных лекарственных средств (испытание на микробиологическую чистоту) и средств для парентерального введения (испытание на стерильность). В ГФ XI, вып. 2, с. 187, 193 подробно описаны данные методики. Следует подчеркнуть исключительную важность проведения данных определений, поскольку они имеют жизненно важные интересы.
Стандартные образцы— это вещества, с которыми сравнивают испытуемые лекарственные средства при проведении их анализа физико-химическими или биологическими методами. Их условно подразделяют на химические и биологические, но это не исключает использование их для различных методов как физико-химического, так и биологического анализа. В ГФ XI, вып. 2, с. 60 даны определения терминов «государственные стандартные образцы» (ГСО), «рабочие стандартные образцы» (РСО) и «стандартные образцы веществ-свидетелей» (СОВС). Активность или содержание вещества в процентах в ГСО принимается за 100, если нет других указаний на этикетке. Выпуск ГСО осуществляют с требованиями ФС, которая разрабатывается и пересматривается предприятием-разработчиком. В качестве РСО используют образцы серийных лекарственных веществ, которые соответствуют требованиям ФС. Расчет количественного содержания препарата в лекарственной форме проводят по сравнению с РСО. В качестве СОВС используют ГСО, РСО и вещества, специально изготовленные в порядке, предусмотренном частной ФС. Некоторые особенности имеют стандартные образцы на антибиотики. При изготовлении стандартов для многокомпонентных антибиотических средств, используют субстанции, соответствующие отдельным компонентам.
Аттестацией, хранением и реализацией стандартных образцов занимается ГНИИСКЛС. Такие стандартные образцы имеются для многих лекарственных веществ. Ряд аналогичных ветеринарных стандартных препаратов находится в ВГНКИ ветпрепаратов, позволяющих более объективно проводить идентификацию (качественную и количественную) лекарственных препаратов. В отличие от медицины, где условия анализа препарата излагаются в ФС, в ветеринарии эти сведения излагаются в ТУ, без которых не должен внедряться ни один новый лекарственный препарат.
1.1.3 ОБЩИЕ ПРИНЦИПЫ ОЦЕНКИ КАЧЕСТВА ЛЕКАРСТВЕННЫХ ФОРМ
Особенности анализа лекарственных форм. Лекарственные формы можно классифицировать по агрегатному состоянию: твердые (порошки, таблетки, драже, гранулы); жидкие (растворы истинные и коллоидные, суспензии, эмульсии, капли); мягкие (мази, линименты, суппозитории, пилюли, капсулы желатиновые и др.); газообразные (аэрозоли, газы). Они могут содержать 1—3 и более компонентов, поэтому различают одно-, двух-, трех-, четырех- и т. д. компонентные лекарственные смеси. При оценке качества лекарственных форм на подлинность в однокомпонентных лекарственных формах обычно используют те же химические реакции, что и для соответствующих субстанций.
На чистоту испытывают только растворы для инъекций, устанавливая прозрачность и окраску (цветность) раствора, рН среды или щелочность (кислотность), а также допустимые пределы примесей тяжелых металлов. В этом плане неверной является трактовка, что если исходное лекарственное вещество соответствует требованиям по содержанию тяжелых металлов, то этому будет соответствовать и его лекарственная форма. Но при приготовлении последней источниками загрязнения могут быть технологическое оборудование, тара, упаковка, вспомогательные средства и др.
Сложность выполнения количественного анализа зависит от числа компонентов. Даже однокомпонентные растворы могут содержать различные стабилизаторы (сульфат, гидросульфат натрия), антибактериальные добавки (бензойная кислота), т. е. представлять собой многокомпонентные смеси. Все это следует учитывать при анализе.
При анализе таблеток, драже, гранул, мазей, пилюль и т. д., включающих даже одно лекарственное вещество, его, как правило, предварительно отделяют от основы или наполнителя. Газообразные лекарственные формы перед анализом пропускают через растворитель, а затем выполняют испытания с полученным раствором препарата.
Сложность анализа многокомпонентных форм состоит в том, что способы определения индивидуальных веществ не всегда дают положительные результаты, поскольку каждый из компонентов смеси и в целом может вызывать различные процессы взаимодействия (явления адсорбции, гидролиза и др.), поэтому очень важно выбрать условия, позволяющие анализировать одно лекарственное вещество в присутствии другого, или предварительно отделить их друг от друга.
Разделение ингредиентов — сложный процесс. Для этого необходимы (нередко трудоемкие) методы экстракции и разделения, поэтому, где это возможно, желательно проводить анализ компонента(ов) в присутствии остальных компонентов, предварительно убедившись, что сопутствующие вещества не влияют на результаты анализа. Для этого можно проводить испытания на модельных смесях, которые готовят, отвешивая на аналитических весах навески каждого вещества, входящего в лекарственную форму, соблюдая технологию ее изготовления. Если положительных результатов получить не удается, то необходима полная экстракция лекарственного вещества с последующим количественным определением. Выбор экстрагентов и оптимальных методик также проводится на модельных смесях, большинство из которых изложены в соответствующей НТД.
Нормативные требования к качеству лекарственных форм. Лекарственные формы изготавливают на заводах, фармацевтических фабриках (официальные лекарственные средства) и в аптеках (магистральные лекарственные средства). Контроль готовых лекарственных форм на фармацевтических предприятиях осуществляют в соответствии с требованиями НТД (ГФ, ФС, ВФС). Построение и изложение содержания ФС на лекарственные формы осуществляют в строгом соответствии с ОСТ 42-1—71. В ГФ XI, вып. 2 приведены общие статьи на лекарственные формы, в которых описаны также основные требования к их качеству, даны указания по проведению испытаний различных характеристик и параметров, указаны допустимые нормы отклонений массы, объема, размеров частиц и др. Здесь же изложены требования к их упаковке, маркировке и условиям хранения.
Коротко приведем основные испытания и требования к лекарственным формам, подробно изложенные в ГФ XI, вып. 2, с. 136—162.
Таблетки испытывают на распадаемость. Если нет других указаний в частной статье, то таблетки должны распадаться в течение 15 мин, а покрытые оболочкой не более 30 мин. Кишечно-растворимые таблетки не должны распадаться в течение 1 ч в растворе соляной кислоты, но должны в течение 1 ч распадаться в растворе натрия гидрокарбоната. Прочность таблеток на истирание должна быть не менее 75 %. Лекарственное средство, содержащееся в таблетке, должно растворяться в воде за 45 мин не менее чем на 75 %. Среднюю массу определяют взвешиванием 20 таблеток с точностью до 0,001 г. Допускаются отклонения от средней массы: ±7,5 % — для таблеток массой 0,1—0,3 г и ±5 % — для таблеток массой 0,5 г и более. В таблетках также контролируют содержание талька и аэросилу.
Гранулы — определяют размер с помощью ситового анализа. Он должен быть 0,2—3 мм, а число более мелких и более крупных гранул не должно превышать 5 %. Испытание распадаемости гранул проводят из навески 0,5 г так же, как и таблеток. Время распадаемо-сти не должно превышать 15 мин. Определяют влагу. Для выявления содержания лекарственного вещества берут навеску не менее чем из 10 растертых гранул.
Капсулы — контролируют среднюю массу. Отклонение от нее каждой капсулы не должно превышать ±10%. Подобно тому, как это проводят с таблетками, контролируют распадаемость и растворимость, а также определяют однородность дозирования для капсул, содержащих 0,05 г и менее лекарственного вещества. Количественное определение лекарственных веществ выполняют по специальным методикам, используя для этих целей содержимое от 20 до 60 капсул.
Порошки — устанавливают отклонения в массе дозированных порошков. Они могут быть+15 % при массе порошка до 0,1 г; ±10 % - от 0,1 до 0,3 г; ±5 % - от 0,3 до 1,0 г; ±3 % - свыше 1,0 г.
Суппозитории — визуально определяют однородность на продольном срезе. Среднюю массу устанавливают взвешиванием с точностью до 0,01 г, отклонения не должны превышать ±5 %. Суппозитории, изготовленные на липофильных основах, контролируют по температуре плавления методом 2а (ГФ XI, вып. 1, с. 18). Она не должна превышать 37 °С. Если эту температуру установить невозможно, то определяют время полной деформации, которое должно быть не более 15 мин. Суппозитории, изготовленные на гидрофильной основе, испытывают на растворимость (показатель «растворение»). Определяют время растворения при температуре 37+1 °С, которое не должно превышать 1 ч. Количественное определение лекарственных веществ проводят по специальным методикам.
Настойки — определяют содержание спирта или плотность (ГФ XI, вып. 1, с. 24—26). Содержание действующих веществ устанавливают с помощью специальных методик. Кроме того, определяют сухой остаток после выпаривания в бюксе 5 мл настойки досуха и высушивания его в течение 2 ч при 102,5±2,5 "С. В таком же объеме настойки после сжигания и прокаливания ее смеси с 1 мл концентрированной серной кислоты определяют содержание тяжелых металлов (ГФ XI, вып. 2, с. 149).
Экстракты — как и в настойках, определяют плотность или содержание спирта, действующих веществ, тяжелых металлов. Устанавливают также сухую массу остатка, а в густых и сухих экстрактах — содержимое влаги (высушиванием в сушильном шкафу при 102,5+2,5 °С).
Аэрозоли — измеряют давление внутри баллона с помощью манометра при комнатной температуре (если пропеллентом служит сжатый газ). Проверяют упаковку на герметичность. В дозированных упаковках определяют среднюю массу препарата в одной дозе, отклонение в которой допускается не более ±20 %. Устанавливают процент выхода содержимого путем удаления его из баллона с последующим взвешиванием. Количественное определение вещества проводят в соответствии с требованиями частных статей ГФ. Отклонения от изложенных количеств не должны превышать ±15 %.
Мази — общим испытанием является метод определения размера частиц лекарственного вещества в мазях (ГФ XI, вып. 2, с. 146). Используют микроскоп с окулярным микрометром МОВ-1. Допустимые размеры частиц, а также способы анализа активных веществ указаны в частных статьях.
Пластыри. Состав, показатели качества, методики испытаний изложены в частных статьях.
Капли глазные испытывают на стерильность и на наличие механических включений (ГФ XI, вып. 2, с. 187 и специальная инструкция МЗ РФ). Количественное определение ингредиентов проводят по методикам, приведенным в частных статьях.
Инъекционные лекарственные формы. Особого внимания требуют инъекционные лекарственные растворы, вводимые внутривенно в больших количествах. Используют такие характеристики, как внешний вид, в том числе окраска и прозрачность растворов, отсутствие механических примесей, апирогенность, стерильность, объем раствора, количество в нем действующего вещества, рН и изо-тоничность плазме крови, упаковка, маркировка, объем наполнения ампул. Нормы допустимых отклонений указаны в частных статьях и в ГФ XI. Кроме того, определяют содержание вспомогательных веществ; для некоторых из них (фенол, крезол, сульфиты, хлорбута-нол) предусмотрены допустимые количества (от 0,2 до 0,5% ). Требования к рН зависят от препарата, обычно его показатель может находиться в пределах от 3,0 до 8,0. На каждой ампуле (флаконе) указывают название лекарственного средства, его содержание (%) или активность (ЕД), объем или его массу, номер серии, срок годности. Проведение всех испытаний инъекционных лекарственных форм регламентировано НТД (ГФ, ФС и ВФС).
Анализ гомеопатических лекарственных средств весьма труден из-за высоких разведений лекарственных веществ. Если БАВ содержатся в настойках, эссенциях, мазях и других формах в разведениях до 2 С (2-сотенное) или 0,0001, то их анализ и стандартизация практически не отличаются от контроля качества лекарственных форм, используемых в аллопатической медицине. Лекарственные средства в разведении 2—3 С (10~4—10~6) анализируют после проведения специальных приемов концентрирования с помощью упаривания, сжигания веществ с последующим определением одним из физико-химических методов, исходя из его разрешающей способности. При более чем 3 С-разведении (1С6) достаточно установить подлинность лекарственного вещества, содержащегося в одной разовой или суточной дозе. При очень высоких разведениях (до 50 С или 1С10-10"100) контроль качества гомеопатических средств существующими методами выполнить невозможно. Для таких лекарств контроль качества осуществляют на стадии получения, строго контролируя технологический процесс. Качество контролируют при закладке ингредиентов и фиксируют в акте загрузки. Каждый ингредиент подвергают предварительному анализу. Во всех перечисленных случаях для анализа и стандартизации гомеопатических лекарственных средств используют хроматографические (ГЖХ, ВЭЖХ), фотометрические, флуоресцентные и другие методы.
Фармакопейный анализ однокомпонентных лекарственных форм. Основные этапы выполнения анализа. Систематизация сведений об испытаниях подлинности, чистоте и количественном определении однокомпонентных лекарственных форм позволяет сделать вывод об общих принципах оценки их качества.
Испытания на подлинность выполняют, как правило, с помощью химических реакций, указанных в ФС на индивидуальные вещества, входящие в состав данной лекарственной формы. Некоторые лекарственные вещества предварительно извлекают из лекарственной формы органическими растворителями.
Вещества в растворах для инъекций испытывают на подлинность так же, как индивидуальные лекарственные вещества. Таблетки и драже перед испытанием на подлинность растирают в порошок, взбалтывают с водой или другим растворителем и фильтруют. Затем с фильтратом проводят испытания, используя реакции, рекомендуемые ГФ для данного лекарственного вещества. При плохой растворимости процесс экстракции выполняют при нагревании до определенной температуры. Иногда реактив добавляют к порошку с остатком тертых таблеток или извлекают препарат и проводят испытание с остатком (после удаления органического экстрагента). Из мазей вещество предварительно экстрагируют эфиром или другим растворителем. Масляные растворы предварительно растворяют в бензоле, петролейном эфире, хлороформе или активное вещество извлекают смесью растворителей. Подлинность извлеченного вещества подтверждают либо по температуре плавления (самого препарата или его производного), либо цветными или осадочными реакциями, либо с помощью тонкослойной хроматографии.
Количественный анализ однокомпонентных лекарственных форм выполняют в несколько этапов: отбор пробы и взятие навески, подготовка лекарственной формы к анализу, извлечение лекарственного вещества из лекарственной формы, создание условий, необходимых для анализа, выполнение необходимых измерений, обработка результатов измерений. Все они в той или иной степени регламентированы соответствующей НТД.
Отбор пробы и взятие навески твердых или жидких лекарственных форм проводят по общим правилам отбора проб. Таблетки (необходимое количество) и драже растираются, а затем из них берут навеску.
Подготовка лекарственной формы к анализу осуществляется растворением (иногда с нагреванием) навески, после чего отбирается аликвотная часть для проведения измерения. Растворитель выбирают с учетом растворимости лекарственного вещества и других компонентов лекарственной формы, а также используемого метода определения. Например, димедрол в таблетках количественно определяют методом нейтрализации в неводной среде, поэтому в качестве растворителя берут безводную уксусную кислоту. Для растворения жидких лекарственных форм чаще применяют воду, а масляных растворов — этиловый или метиловый спирт, бензол, петролейный эфир.
Извлечение лекарственного вещества из лекарственной формы бывает неизбежным, когда в лекарственной форме присутствуют ингредиенты, мешающие количественному определению лекарственного вещества, поэтому либо выделяют лекарственное вещество, либо отделяют мешающие компоненты, используя различные способы: фильтрование, центрифугирование, экстракцию, бу- мажную хроматографию, ТСХ и др.
Создание условий, необходимых для проведения анализа, диктуется методом, с помощью которого проводят исследования данной лекарственной формы. Например, для комплексономет-рии создают необходимый показатель рН среды, для метода нейтрализации в неводных средах добавляют ацетат ртути (II) и т. д.
Выполнение измерений проводят гравиметрическим, титриметрическим, физико-химическим и биологическим методами. Все они были рассмотрены ранее. Однако из-за того что на исследуемое вещество влияет ряд факторов (наполнители, стабилизаторы и др.), нередко используют не тот метод, который изложен в НТД для той же субстанции индивидуального вещества, а применяют различные модификации, либо дополнительные методы, которые обычно изложены и частных статьях, а также в ТФ XI, вып. 2.
Обработка результатов измерений, т.е. расчет концентрации лекарственного вещества в лекарственной форме имеет свои особенности. В ФС указаны нижний и верхний пределы содержания лекарственного вещества в граммах на определенное количество лекарственной формы. Для растворов приведены пределы содержания в 1 мл; для таблеток в пересчете на содержание в 1 таблетке, покрытой оболочкой; для мазей и присыпок даны пределы содержания лекарственного вещества в процентах.
Для расчета используют специальные формулы, разработанные или модифицированные для применяемых методов и изложенные в НТД.
Анализ многокомпонентных лекарственных форм. Качественный анализ лекарственных форм, содержащих различные лекарственные вещества, как уже указывалось ранее, затруднен из-за того, что один ингредиент может мешать обнаружению другого или реактив одновременно реагирует с несколькими компонентами. Поэтому в отличие от анализа однокомпонентных лекарственных форм возможны следующие варианты:
1) ала идентификации подобраны специфические реакции (на ионы или функциональные группы), при выполнении которых обнаружению одного компонента не мешают другие;
2) используют реактив, который последовательно реагирует сначала с одним, а затем с другим компонентом. Например, раствор формальдегида в концентрированной серной кислоте вначале образует сине-фиолетовое (кодеин), а затем красное окрашивание (кислота ацетилсалициловая);
3) реактив взаимодействует с обоими компонентами, но продукты взаимодействия можно легко разделить. Например, анализ смеси натрия бензоата и натрия салицилата при воздействии раствором сульфата меди в присутствии хлороформа: хлороформный слой приобретает голубое окрашивание (бензоат-ион), водный — зеленое (салици-лат-ион);
4) один из компонентов смеси в присутствии реактива дает цветную реакцию на другой компонент. Так можно обнаружить первичные ароматические амины, если в смеси присутствует резорцин (отпадает необходимость в добавлении р-нафтола);
5) при добавлении реактивов для обнаружения одного компонента последовательно открывают остальные. Например, обнаружение анестезина в смеси с натрия гидрокарбонатом и анальгином реакцией образования азокрасителя. После добавления соляной кислоты выделяются пузырьки газа (гидрокарбонат-ион), при последующем добавлении раствора нитрита натрия появляется быстроисчезающее сине-фиолетовое окрашивание (анальгин) и, наконец, от добавления щелочного раствора р-нафтола смесь приобретает красный свет (анестезин);
6)обнаружить один компонент в присутствии других невозможно без предварительного их разделения. Для разделения используют различные растворители и затем в экстрактах идентифицируют каждый из компонентов;
7)использование различных видов хроматографии (ВЭЖХ, ГЖХ, ТСХ) для разделения и последующей идентификации компонентов;
8)при анализе жидких
лекарственных форм присутствие в них галеновых препаратов (настоек,
экстрактов), а также настоев и отваров нередко мешает определению других
ингредиентов. В данном случае также проводят экстракцию или разделение
компонентов, в
том числе с помощью хроматографии;
9)в некоторых случаях, например, в присутствии настоя и настойки валерианы или пустырника, содержащиеся в них малые количества алкалоидов, тритерпеновых и других соединений не мешают идентификации других компонентов.
Количественный анализ лекарственных форм. Этот анализ лекарственных веществ в многокомпонентных смесях может быть выполнен без разделения компонентов смеси или после предварительного разделения.
Количественный анализ без разделения компонентов смеси можно выполнить при использовании титриметрических методов, основанных на различии свойств веществ, содержащихся в смеси (кислотно-основных свойств, констант комплексообразования, произведений растворимости и др.). Чаще применяют методы, основанные на одновременном титровании суммы двух компонентов. Затем количественно определяют содержание одного из этих компонентов, используя методы, основанные на свойствах, присущих только данному веществу. Расчет проводят по разности между количеством миллилитров титрантов (одинаковой молярности), затраченных на первое и второе титрование. Например, смеси хлоридов (натрия, калия, кальция) или бромидов (натрия, калия) определяют аргенто-метрически (индикатор хромат калия или бромфеноловый синий) по сумме их содержания. В этих же целях для других химических веществ используют методы нитритометрии, броматометрии или другие.
Комплексонометрию применяют тогда, когда один из компонентов смеси представляет собой соль кальция, магния, цинка, ртути или других тяжелых металлов. При этом используют различные приемы и индикаторы.
Кислотно-основное титрование смесей основано на различии констант диссоциации компонентов. Поэтому данный метод используют при наличии в смеси не только одного, но и нескольких компонентов с кислотно-основными свойствами. При этом можно варьировать индикаторами в следующих случаях:
1)если смесь содержит два
компонента, значительно различающихся по основности, то используют два
различных индикатора и последовательно титруют вначале один, а затем второй
ингредиент.
Так титруют вначале кодеин кислотой с индикатором (метиловым красным), а затем
амидопирин (индикаторная смесь метилового оранжевого и метиленового синего);
2)если один из компонентов представляет кислоту, а второй — соль или другое основание, то в одной навеске вначале титруют кислоту, а затем сумму образовавшейся соли или основания. Расчет выполняют по разности количеств затраченных титрованных кислоты и щелочи (например, смесь ацетилсалициловой кислоты с амидопирином);
3)при анализе смеси веществ, одно из которых не растворимо или мало растворимо в воде, используют несмешивающиеся или смешивающиеся растворители (воду и спирт) и соответствующие индикаторы;
4)при количественном
определении двухкомпонентных смесей используют метод неводного титрования,
применяя два способа. При одном из них титруют каждый из компонентов в том
растворителе, в котором проявляются только его кислотные или основные свойства
(так можно определять смеси кислоты и основания, кислоты и соли, основания и
соли). Второй способ основан на дифференцированном титровании в одном растворителе
обоих веществ, имеющих разные константы ионизации (смеси оснований с солями и
смесь оснований);
5)последовательное титрование навески вначале в водной, а затем в неводной среде применяют, когда в состав бинарной лекарственной формы входят слабые основания (пуриновые алкалоиды) и алкалоиды с более сильными основными свойствами.
Количественный анализ смесей после разделения компонентов чаще используют для многокомпонентных препаратов, проводя разделение с помощью экстракции. При этом многие лекарственные вещества по различию растворимости можно распределить на группы.
Неорганические вещества, как правило, не растворимы в органических растворителях, оксиды металлов не растворимы в воде, но растворимы в кислотах, соли большинства неорганических кислот и щелочных и щелочноземельных металлов, а также тяжелых металлов (за исключением сульфата кальция и бария) хорошо растворимы в воде и т. д. Все эти сведения по растворимости тех или иных соединений имеются в НТД и справочной литературе, например во многих справочниках лекарственных препаратов.
Используя различия в растворимости лекарственных веществ, можно разделить компоненты следующими методами:
1) при наличии в смеси веществ, хорошо растворимых и не растворимых в воде, разделение проводят растворением смеси в воде с последующей фильтрацией. На фильтре остаются нерастворимые вещества. Так отделяют от других компонентов растворимые в воде неорганические соли, соли органических кислот, соли азотсодержащих органических оснований; 2) вещества, растворимые в органических растворителях, не смешивающихся с водой (хлороформ, эфир), отделяют путем экстракции хлороформом или эфиром; 3) вещества, растворимые в органических растворителях, можно отделять от некоторых алифатических кислот и производных фенолов. Последние предварительным действием щелочей необходимо превратить в водорастворимые феноксиды (феноляты). Затем вещества, нерастворимые в воде, отделяют органическими растворителями, в которых они растворяются;
4) для отделения веществ, растворимых в хлороформе или эфире, от органических оснований последние предварительно нейтрализуют кислотами. Полученные соли оснований остаются в водном растворе;
5) соли
органических оснований можно предварительно превратить в основания путем
нейтрализации связанных кислот щелочами.
Образующиеся органические основания затем экстрагируют хлороформом или эфиром.
Полученные вышеизложенными или другими методами компоненты определяют тем или иным титриметрическим методом. При разделении смесей, содержащих три компонента и более, нередко получаются двухкомпонентные экстракты веществ с одинаковой растворимостью. Их анализируют методами осаждения или кислотно-основного титрования, последовательно определяя каждый из компонентов.
В частных статьях изложены и другие методы модификации для разделения и количественного определения лекарственных веществ многокомпонентных смесей с различными нюансами выполнения исследований.
Расчет содержания компонентов в лекарственных формах, определяемых различными методами титриметрического анализа (прямое, обратное, заместительное, реверсивное титрования), производят определенными приемами для данного способа титрования.
Когда определение одного компонента в присутствии других доступными методами невозможно, используют различные приемы анализа и варианты расчетов. Наиболее часто в анализе многокомпонентных лекарственных форм применяют варианты определений по разности. Если один ингредиент титруют в сумме с другим, содержание которого определено иным методом, количество анализированного компонента рассчитывают по определенной формуле. Таких формул предложено несколько для каждого конкретного случая и различных нюансов, возникающих при количественном определении многокомпонентных смесей.
Физико-химические методы анализа многокомпонентных лекарственных форм. Эти методы позволяют анализировать двух- и даже трех-компонентные смеси без предварительного разделения с достаточной точностью. В этих целях практически используют те же методы с определенными модификациями, что и для анализа индивидуальных лекарственных веществ.
Количественный анализ смесей без предварительного разделения компонентов выполняют полярографией, спектрофо-тометрией и другими физико-химическими методами. Наиболее широко используют различные варианты спектрофотометрического метода.
Количественный анализ смесей после предварительного разделения компонентов, как правило, используют для многокомпонентных смесей. Растворение смеси основано на различии их растворимости и осуществляется теми же способами, что и при титриметрических методах. Для экстракции используют эфир, хлороформ, растворы кислот, щелочей и др.
Метод экстракционной фотометрии позволяет выделить вещества из смеси с последующим количественным определением, например препаратов алкалоидов. При этом возможно сочетание физико-химических методов с химическими.
Ионообменную хроматографию используют для разделения органических и неорганических смесей. После разделения на ионообменных колонках количественно определяют индивидуальные вещества титриметрическим или физико-химическими методами.
Тонкослойную хроматографию (ТСХ) особенно широко применяют при анализе лекарственных форм, содержащих практически все группы лекарственных веществ. Разделение с помощью ТСХ сочетают с количественным определением непосредственно на хромато-граммах или после элюирования веществ, используя для этих целей различные методы:
1) лекарственную форму хроматографируют, проявляют хроматограмму и проводят сравнительную оценку площади пятен анализируемого вещества и стандартного образца (так определяют пуриновые и опийные алкалоиды, токоферолы и др.);
2) сочетание разделения с помощью ТСХ и спектрофотометрического определения непосредственно на хроматограммах применяют для анализа смесей алкалоидов, сульфаниламидов, стероидных гормонов. Однако точность метода сравнительно мала;
3) измеряют интенсивность окраски пятна на
хроматограмме, пользуясь денситометрическим методом, а также методами,
основанными на измерении интенсивности отражения или флуоресценции.
Способ применим для анализа витаминов, гликозидов;
4) элюируют лекарственные вещества из соответствующих зон тонкослойной хроматографии стандартного образца и лекарственной формы. Затем в каждом из элюатов устанавливают концентрацию веществ, используя для этого титриметрические оптические методы, полярографию и др.; объемными методами определяют в элюатах, например барбитураты. Но чаще анализ веществ в элюатах проводят методами УФ-спектрофотометрии или фотоколориметрии.
Разделения смесей достигают также с помощью капиллярного зонного электрофореза с флуориметрическим или электрохимическим детектором.
В последнее время для количественного анализа лекарственных форм, как и вообще для фармацевтического анализа, широко используют газожидкостную и жидкостную хроматографии, которые имеют ряд преимуществ перед ТСХ по более широкой анализацион-ной возможности, в том числе и для определения трехкомпонентных" смесей лекарственных веществ.
Сочетание химических и физико-химических методов нередко используют для анализа многокомпонентных смесей. Чаще применяют сочетание титриметрических методов с фотометрическими. Так, кислоту ацетилсалициловую в смеси с фенацетином и кофеин-бензоатом натрия титруют гидроксидом натрия. Кофеин-бен-зоат натрия определяют косвенным комплексонометрическим методом, а фенацетин — колориметрическим по реакции с нитритом натрия и тимолом. При анализе смеси эфедрина, папаверина и натрия бензоата используют фотометрический метод для определения эфедрина, остальные компоненты титруют в неводной среде.
Перспективно комбинированное использование нескольких фотометрических методов для анализа многокомпонентных смесей, например сочетание производной и дифференциальной спектрофото-метрии, а также ряда других методов.
Экспресс-анализ лекарственных средств. Этот вид анализа особенно необходим в аптеках, поскольку изготовление в них лекарств ограничено короткими сроками. Основные требования, предъявляемые к экспресс-анализу, — расход минимальных количеств лекарственных форм, простота и быстрота выполнения, достаточность и возможность проведения анализа без изъятия приготовленного лекарства. Поэтому для оценки качества лекарств в аптеках широко используют различные методы как качественного, так и количественного экспресс-анализа, с применением различных химических и физико-химических методов.
Качественный экспресс-анализ лекарственных форм отличается от макроанализа тем, что на его выполнение расходуется меньшее количество веществ и реактивов. Анализ растворов и порошков выполняют без предварительного выделения лекарственных веществ, когда наполнители не мешают проведению качественных реакций. Для выделения лекарственного вещества из таблеток, драже, мазей, суппозиториев бывает достаточно перемешивания или растирания с растворителем. При этом используют цветные или осадочные химические реакции на соответствующие катионы, анионы неорганических или функциональные группы органических веществ. Анализ выполняют капельным методом, при котором расходуется от 0,001 до 0,01 г порошка или 1—5 капель жидкости.
Цветные реакции выполняют на фильтрованной бумаге или в фарфоровых чашках, а осадочные — на часовых стеклах. Чувствительность реакций, выполняемых на фильтрованной бумаге, можно повысить, используя такие физические явления, как поверхностное натяжение, капиллярность, адсорбция, диффузия. Например, за счет различия в скорости диффузии растворенных компонентов смеси можно одновременно идентифицировать два или даже три вещества без их разделения. Они образуют с реактивом окрашенные кольца, отличающиеся по цвету и расположенные на различном расстоянии от центра. Избирательность цветных реакций можно повысить обработкой фильтрованной бумаги парами летучих веществ.
Иногда одним реактивом можно обнаружить два ингредиента. Например, действуя окислителями, можно последовательно открывать бромиды и йодиды, раствором хлорида железа (III) — бензоаты и салицилаты и т. д. Можно подобрать реактив, который с одним лекарственным веществом, содержащимся в смеси, образует окрашенное соединение (растворимое или нерастворимое в воде), а с другим вьделяет газообразный продукт (действие серной кислоты на смесь, содержащую гидрокарбонат и алкалоиды).
При невозможности выполнения анализа без разделения компонентов используют те же принципы разделения, что и при макроанализе. Они основаны на различии в растворимости веществ. С помощью воды, этилового спирта, ацетона, хлороформа можно разделять смесь, состоящую из веществ, растворимых и нерастворимых в указанных растворителях. Растворы кислот, щелочей, буферные растворы позволяют последовательно извлекать из смеси вещества, различающиеся по кислотно-основным свойствам. Идентификацию выделенных индивидуальных веществ осуществляют теми же реакциями, которыми испытывают на подлинность субстанции.
Качественный экспресс-анализ веществ, содержащихся в мазях, суппозиториях и пастах, обычно выполняют смешиванием и растиранием на стеклянной пластинке с соответствующим реактивом, или препарат предварительно обрабатывают спиртом, бензолом, эфиром или хлороформом для растворения основы — жиров и вазели-нов (если первый способ не дает положительных результатов). Можно также из мази или пасты извлекать лекарственное вещество водой или растворами кислот и щелочей при слабом подогревании. Иногда сочетают оба эти способа. Если компоненты нерастворимы в воде, то мазевую основу растворяют в эфире, бензине или хлороформе. Затем фильтруют и остаток на фильтре растворяют, подбирая для этого соответствующий растворитель. Полученные экстракты анализируют теми же методами, что и сухие или жидкие лекарственные формы.
Для качественного экспресс-анализа в условиях аптеки используют физические и физико-химические методы, которые применяют в обычном анализе в различных модификациях.
Количественный экспресс-анализ выполняют титри-метрическими или физико-химическими методами, которые также отличаются от проведения макроанализа.
Титриметрический экспресс-анализ отличается от макрометодов расходом меньших количеств анализируемых форм (0,05—0,1 г порошка или 1—3 мл раствора). Это позволяет анализировать лекарственную форму без изъятия, т. е. контролировать качество того лекарства, которое отпускается больному. На выполнение анализа затрачивается минимальное время, так как используются методики, не требующие, как правило, процессов извлечения, выпаривания, фильтрования. Навески порошка или объем жидкой лекарственной формы берут с таким расчетом, чтобы на определение расходовалось не более 2 мл 0,1 М титрованного раствора. Из твердых лекарственных форм вначале получают раствор. При необходимости жидкие лекарственные формы предварительно разбавляют. Навеску мази, если основа не мешает определению, растворяют в 3—5 мл этанола или эфира, а затем титруют. Для уменьшения раствора анализируемого вещества и реактивов в количественном экспресс-анализе используют не только 0,1 М, но и 0,02 и 0,01 М титрованные растворы. Чтобы упростить расчеты, титрованные растворы готовят точной нормальности (из фиксаналов). При этом используют аналогичные методы, применяемые в макроанализе с акцентом на неразделение компонентов. Для упрощения расчетов можно пользоваться так называемыми факторами титрования (Ф), значение которых вычисляют в процентах и граммах по специальным формулам (Ф= Т 100/а и Ф — ТЬ/а)ь в которых фактор титрования включает навеску (а) и титр исследуемого вещества (Г). Последующий расчет концентрации (К) или массы сводится к вычислению произведения ФУК, а для титрованных растворов с К~ 1 — к произведению ФУ.
Важным этапом внутриаптечного контроля является оценка качества концентрированных растворов (концентратов). Концентраты подвергаются обязательному количественному анализу во всех аптеках. Они содержат одно лекарственное вещество и анализируются как обычный водный раствор высокой концентрации, который перед определением разбавляют. Для облегчения расчетов титримет-рического экс пресс-анализа концентратов разработаны специальные таблицы.
И при количественном экспресс-анализе кроме химических используют и физико-химические методы, например рефрактометрию. Ее применяют для количественного экспресс-анализа глюкозы, кислот (борной, аскорбиновой, никотиновой), солей неорганических и органических кислот (калия и натрия бромиды, хлориды, йодиды, кальция хлорид и глюконат, калия ацетат, натрия тетраборат, тиосульфат, гидрокарбонат, цитрат, бензоат, салицилат), водорастворимых натриевых солей сульфаниламидов. Более точные результаты достигаются, если концентрация лекарственного вещества выше 5%. Иногда при анализе многокомпонентных смесей рефрактометрию сочетают с титриметрическими методами.
Кроме того, в аптечном количественном экспресс-анализе используют интерферометрический метод, отличающийся от титриметри-ческих небольшим количеством испытуемого объекта. Интерферометрия основана на измерении показателей преломления растворов, но в отличие от рефрактометрии измеряется разность показателей преломления п испытуемого вещества и эталона с известной величиной п0. Расчет концентраций в интерферометрическом анализе выполняют по калибровочным графикам или по формуле. Метод применяют для количественного экспресс-анализа неорганических веществ, а также гидрохлоридов алкалоидов (пилокарпина, эфедрина, папаверина) и органических оснований (новокаина, дикаина, димедрола, дибазола) и др.
Для определения веществ, обладающих флуоресценцией, используют количественное флуориметрическое определение, а также фотоколориметрию или визуальную колориметрию и дифференциальный фотометрический метод с использованием заменителей растворов сравнения. Последний метод весьма перспективен. Имеются и другие физико-химические методы, которые можно использовать в аптечном количественном экспресс-анализе лекарственных веществ.
По всей видимости, целесообразно взять эти методы на вооружение ветеринарным фармацевтам, а также контролирующим ветеринарным органам, в которых должны быть подготовленные для этого дела специалисты.
1.2 СПЕЦИАЛЬНАЯ ФАРМАЦЕВТИЧЕСКАЯ ХИМИЯ
1.2.1 НЕОРГАНИЧЕСКИЕ ЛЕКАРСТВЕННЫЕ СРЕДСТВА
Препараты галогенов и галогенидов. Препараты галогенов.
Гипохлориты — препараты солей хлорноватистой кислоты, получают при взаимодействии хлора с гидроксидами щелочных металлов: 2NaOH+Cl2=NaQO+NaCl+H3O. Промышленный способ получения основан на электролизе хлоридов натрия или калия. Испытание на подлинность, количественное определение и применение ос-" нованы на окислительных свойствах этих веществ. Основные лекарственные средства: известь хлорная (дезинфектант, антисептик, дезодорант), натрия гипохяорит, кальция гипохлорит.
Препараты йода получают из буровых вод и морских водорослей. В ГФ включен йод и раствор йода спиртовой 5%-ный.
Йод летуч при обычной температуре, при нагревании возгоняется, образуя фиолетовые пары. Температура плавления 113—114 °С, мало растворим в воде, растворим в органических растворителях. Подлинность йода и его лекарственных форм устанавливают реакцией взаимодействия йода и крахмального клейстера с образованием продукта синего цвета. Количественно йод определяют титрованием тиосульфатом натрия в присутствии индикатора крахмала: I2+2Na2S3O3=2NaI+Na2S4O6.
Спиртовой раствор пода 5%-ный — одно из основных антисептических средств.
На основе йода получены другие антисептики.
Йодопирон — смесь комплекса поливинилпирролидона с йодидом калия. Содержит 6—8 % йода. Используют в форме 0,1, 0,5 и 1 % -ных растворов.
Йодонат — сходен с йодопироном по составу и действию — водный раствор поверхностно-активных веществ, содержащий около 3 % йода.
Препараты галогенидов. В эту группу входят препараты бескислородных соединений галогенов: кислота хлористоводородная (соляная), натрия хлорид, калия хлорид, натрия бромид, калия бромид, натрия йодит и калия йодит (по терминологии ГФ XI).
Кислота хлористоводородная (соляная) — продукт производства химической промышленности. Получают растворением в воде хло-роводорода. В ГФ включены два препарата соляной кислоты: кислота хлористоводородная (плотность 1,222—1,224; объемная доля 24,8— 25,2 %) и кислота хлористоводородная разведенная (плотность 1,038— 1,039; объемная доля 8,2—8,4% ). Хлорид-ион можно обнаружить с помощью нитрата серебра или при нагревании с диоксидом марганца. Определяют содержание хлороводорода в препаратах методом нейтрализации, титруя раствором гидроксида натрия в присутствии индикатора метилового оранжевого, а также аргентометрическим методом по хлорид-иону. В терапевтических целях используют разведенную соляную кислоту при патологиях желудочно-кишечного тракта.
Препараты хлоридов, бромидов, йодидов имеют много общего по физическим свойствам. Натрия хлорид получают из воды озер и морей выпариванием, источники калия хлорида — минералы сильвинит или карналлит, из которых выделяют препарат методом флотации с последующей очисткой. Бромиды получают различными способами, в том числе из бромида железа, являющегося отходом химических производств. Аналогично получают натрия и калия йодиды из йодида железа. По физическим свойствам галогениды представляют собой белые или бесцветные кристаллические вещества без запаха, соленого вкуса, легко (особенно йодиды) растворяющиеся в воде. Йодиды легко растворяются в этаноле и глицерине, хлориды и бромиды менее растворимы в этих растворителях.
Испытания на подлинность галогенидов основаны на реакциях с соответствующими катионами и анионами (ГФ XI, вып. 1, с. 159).
Катион натрия обнаруживают по окрашиванию бесцветного пламени горелки в желтый цвет и по образованию зеленовато-желтого кристаллического осадка с цинкуранилацетатом в уксуснокислой среде. Соли калия окрашивают бесцветное пламя горелки в фиолетовый цвет; катион калия можно также обнаружить реакцией с винной кислотой по образованию белого кристаллического осадка.
Галогенид-ионы также обнаруживают осадочной реакцией с раствором нитрата серебра в азотнокислой среде. При этом образуются труднорастворимые соли галогенидов серебра, которые отличаются по окраске и растворимости в растворе аммиака. Бромиды и йодиды также обнаруживают с помощью реакций окисления до свободных галогенов, используя различные окислители. Существуют и другие качественные реакции.
При испытании на чистоту следует контролировать допустимые пределы примесей бромат-, йодат-, цианид-, тиосульфат-, сульфит-и нитрат-ионов. Примесь броматов обнаруживают добавлением серной кислоты (желтое окрашивание). Аналогично устанавливают примесь йодатов. Примесь тиосульфат- и сульфит-ионов обнаруживают реакцией с раствором йода (в присутствии крахмала — синее окрашивание). Нитрат-ионы регистрируют по реакции образования аммиака с цинковыми или железными опилками в щелочной среде (аммиак окрашивает влажную красную лакмусовую бумагу в синий цвет).
Количественное определение препаратов галогенидов по ГФ выполняют аргентометрическим методом, титруя в нейтральной среде (индикатор хромат калия) хлориды и бромиды. Йодиды определяют методом фаянса в уксуснокислой среде, используя титрант 0,1 М раствор нитрата серебра и адсорбционный индикатор эозинат натрия.
Галогениды широко используют в лечебной практике. Натрия' хлорид — основная часть солевых и коллоидно-солевых растворов, применяемых в качестве плазмозамещающих жидкостей; препарат применяют наружно и внутривенно при различных патологиях. Калия хлорид — антиаритмическое средство и источник ионов калия (при гипокалиемии). Он также входит в состав плазмозамещающих жидкостей. Натрия и калия бромиды назначают в качестве седатив-ных средств. Йодиды применяют при недостатке йода в организме (эндемическом зобе) и некоторых воспалительных патологиях.
Препараты кислорода, водорода и серы. Кислород. В промышленности его получают путем фракционного разделения предварительно сжиженного воздуха и электролизом воды. Как лекарственное средство кислород включен в ГФ. Представляет собой газ. Перед использованием с лечебной целью его подвергают очистке, пропуская через раствор щелочи, а затем через воду.
Для отличия кислорода от других газов, например азота закиси, его смешивают с оксидом азота. Смесь газов окрашивается в оранжево-красный цвет (азота закись окраски не дает).
Все способы количественного определения кислорода основаны на взаимодействии с легко окисляющимися веществами. ГФ рекомендует для этого медь (ГФ XI, с. 350), которая, окисляясь кислородом, образует оксид меди, реагирующий с содержащимися в растворе хлоридом аммония и аммиаком.
В аптеках кислород хранят в баллонах объемом 27—50 л, вмещающих 4-7,5 м3 газа под давлением 10-15 МПа (100-150 ат). Баллоны, содержащие кислород, окрашены в синий цвет. Резьбу редуктора баллона нельзя смазывать жиром или органическими маслами (возможна вспышка от воздействия струи кислорода с органическим веществом). Смазкой служит тальк. Из аптек кислород отпускают в специальных подушках. Применяют для вдыхания при болезнях, сопровождающихся кислородной недостаточностью, однако используют в виде карбогена — смесь 95 % кислорода и 5 % диоксида углерода.
Вода. В фармацевтической практике используют: воду очищенную, воду для инъекций и воду для инъекций в ампулах (рН 5,0 — 7,0).
Воду очищенную получают дистилляцией, ионным обменом, обратным осмосом и другими способами. Ее испытывают на чистоту в соответствии с требованиями ФС; рН определяют потенциометрическим методом. Сухой остаток не должен превышать 0,001 %. Его устанавливают выпариванием досуха 100 мл воды. Затем высушивают при 100—150 "С до постоянной массы, взвешивают и рассчитывают его массовую долю (% ). Испытание на восстанавливающие вещества выполняют путем кипячения в течение 10 мин смеси, состоящей из 100 мл воды, 2 мл разведенной серной кислоты и 1 мл 0,01 М свежеприготовленного раствора перманганата калия. Должно сохраняться розовое окрашивание.
Содержание нитратов и нитритов регистрируют по отрицательной реакции с 1 мл дифениламина в концентрированной серной кислоте (не должно появляться голубое окрашивание). При проведении испытания к 5 мл воды осторожно прибавляют указанный объем реактива!
Испытания на хлориды, сульфаты, соли кальция и тяжелые металлы проводят в соответствии с требованиями ГФ XI, вып. 1, с. 165 «Испытания на чистоту и допустимые пределы примесей».
Воду очищенную применяют для приготовления неинъекционных лекарственных средств. Используют свежеприготовленной или хранят в закрытых емкостях, не изменяющих свойств воды и защищающих от микробного загрязнения. Согласно инструкции МЗ СССР № 96, 03.04.1991 вода очищенная, простерилизованная в течение 8 мин при 120 °С, имеет срок годности при 25 "С 30 сут.
Вода для инъекций должна выдержать испытания для воды очищенной и быть апирогенной, не содержать антимикробных веществ и других добавок. Ее подвергают испытанию на пирогенность (ГФ XI, вып. 2, с. 183) и на механические включения (инструкция И 42-3—85). Срок хранения не более 24 ч.
Воду для инъекций выпускают в емкостях (ампулах) из нейтрального стекла по 1, 2, 3, 5, 10, 20 мл, которые стерилизуют при 120 °С 20 мин. НТД предъявляют самые высокие требования к ее качеству. Она не должна давать положительных реакций на хлориды, сульфаты, кальций, тяжелые металлы. Требования к рН среды, содержанию сухого остатка, восстанавливающих веществ, диоксида углерода, нитратов и нитритов, аммиака такие же, как для воды очищенной. Испытания на пирогенность и механические включения выполняют по аналогии с водой для инъекций. Кроме того, устанавливают стерильность и соблюдают другие требования к ампулированным инъекционным растворам (ГФ XI, вып. 2, с. 140). Используют для тех же целей, что и воду для инъекций. Срок годности 4 года.
В ряде случаев, в том числе при получении воды очищенной, определяют не каждую из органических примесей, а используют унифицированный показатель чистоты в отношении органических растворителей, названный «общий органический углерод». Для этого применяют специальные анализаторы углерода, принцип работы которых основан на высокотемпературном каталитическом окислении пробы до диоксида углерода и последующего его восстановления до метана, количество которого измеряют на пламенно-ионизационном детекторе (используют в Японии).
Препараты пероксида водорода. Различают жидкие (3%-ный раствор) и твердые (магния пероксид, гидроперит) препараты пероксида водорода. В ГФ включены: раствор водорода пероксида и магния пероксид, применяют и гидроперит. Магния пероксид выделяет пероксид водорода при растворении в растворах минеральных кислот: MgO2+2HCl=MgCl2+H2O2; гидроперит образует водорода пероксид в воде. Производство водорода пероксида осуществляют электролизом
40—68%-ных растворов серной кислоты при 5—8 °С. Таким образом, получают разбавленные растворы препарата, которые при перегонке в вакууме при 70 °С доводят до концентрации 30—60%. Мировое промышленное производство (до 80 % ) водорода пероксида осуществляют путем автоокисления воздухом производных алкилантра-гидрохинонов — 2-этил-, 2-третбутил- и 2-пентилантрагидрохинов. Магния пероксид получают при взаимодействии оксида магния с водорода пероксидом, а гидроперит при взаимодействии эквимолекулярных количеств мочевины и водорода пероксидом с добавлением 0,08%-ного раствора лимонной кислоты (консервант).
Водорода пероксид — очень слабая кислота, проявляющая как окислительные, так и восстановительные свойства. Устойчива в чистом виде в водных растворах, однако присутствие солей тяжелых металлов, диоксида марганца, следов щелочей, окислителей и восстановителей, даже попадание пылинок и соприкосновение с шероховатой поверхностью резко ускоряют процесс ее разложения и, если растворы имеют высокую концентрацию, может произойти взрыв.
Для установления подлинности препаратов водорода пероксида используют реакцию образования окрашенных в синий цвет перекисных соединений (смеси надхромовых кислот и пероксида хрома), растворимых в эфире. Количественную оценку твердых и жидких препаратов проводят, используя либо восстановительные, либо окислительные свойства водорода пероксида.
Количественное определение водорода пероксида выполняют пер-манганатометрическим методом в кислой среде или йодометрическим методом. Препарат должен содержать 2,7—3,3 % водорода пероксида. Для количественного определения магния пероксида проводят пер-манганатометрическое титрование. Препарат должен содержать 25 % магния пероксида. Содержание водорода пероксида в таблетках гидроперита устанавливают йодометрическим титрованием. Таблетка массой 1,5 г должна содержать не менее 0,48 г водорода пероксида.
Хранят препараты водорода пероксида в хорошо укупоренной таре в защищенном от света месте. Раствор водорода пероксида и гидроперит используют как антисептики, а магния пероксид — при желудочно-кишечных заболеваниях.
Натрия тиосульфат. Источник получения натрия тиосульфата — сульфиды и полусульфиды, которые подвергают окислению диоксидом серы или кислородом. Получают и путем сплавления его кальциевой соли с сульфатом натрия.
Фармакопейный натрия тиосульфат представляет собой кристаллогидрат. Он очень легко растворим в воде, практически нерастворим в этаноле. Препарат дает характерные реакции на натрий-ион, его обнаруживают по образованию опалесценции (вследствие выделения серы) и появлению запаха (диоксида серы) при добавлении к раствору препарата соляной кислоты. Для испытания подлинности и количественного определения используют окислительно-восстановительную реакцию натрия тиосульфата с йодом.
Поскольку препарат назначают, в том числе внутривенно, в высоких дозах, его тщательно проверяют на чистоту. В соответствии с требованиями ГФ и ФС устанавливают прозрачность и цветность 30%-ного раствора, щелочность 10%-ного раствора, допустимое количество примесей хлоридов, сульфидов, сульфитов и сульфатов, кальция, тяжелых металлов, железа, мышьяка и селена.
Хранят в хорошо укупоренной таре, учитывая, что в сухом тяжелом воздухе он выветривается, а во влажном слегка расплывается, при 50 °С плавится в кристаллизационной воде.
Препарат используют как противотоксическое (антидотное) и десенсибилизирующее средство при отравлениях цианидами, ртутью, мышьяком, таллием, свинцом и при аллергических состояниях.
Сера. Встречается в свободном состоянии (самородная сера) и в виде минералов, содержащих помимо серы и другие элементы. В лечебной практике применяют серу очищенную и серу осажденную.
Серу очищенную получают из серного цвета (самородная руда) путем тщательной очистки от примесей, особенно от токсичных — сульфида мышьяка, сернистой и серной кислот. Серу осажденную получают путем тщательного размалывания очищенной серы или кипячением в присутствии гидроксидов. Сера очищенная нерастворима в воде, мало растворима в эфире, а сера осажденная нерастворима в воде, растворима в жирных маслах (при нагревании на водяной бане) и при кипячении в смеси с раствором гидроксида натрия и этанола.
Установить подлинность серы можно по запаху оксида серы, образующегося при горении, и характерной (синей) окраски пламени. Раствор серы в горячем пиридине от добавления нескольких капель раствора гидрокарбоната натрия после кипячения окрашивается в голубой или зеленый цвет. Препарат подвергают испытанию на наличие мышьяка, селена, сульфидов и др.
Количественное определение серы основано на растворении навески в избытке 0,5 М спиртового раствора гидроксида калия (образуется полисульфид калия). При добавлении пергидроля последний окисляется до сульфата, который затем титруется 0,5 М раствором соляной кислоты.
Хранят в хорошо укупоренной таре в сухом месте. Используют наружно в виде мазей, присыпок при лечении различных кожных заболеваний. Действие серы основано на взаимодействии с органическими веществами. Образующиеся при этом сульфиды и пентати-новая кислота проявляют противомикробную и противопаразитарную активность. Внутрь назначают в качестве противоглистного средства при энтеробиозе и как легкое слабительное.
Препараты натрия и висмута. Натрия нитрит. Промышленный способ получения натрия нитрита основан на использовании отходов азотной кислоты, а также восстановлением расплавленного нитрата натрия свинцом.
Препарат легко растворим в воде, трудно — в этаноле. Водные растворы слабощелочной реакции (рН 9,0) проявляют как окислительные, так и восстановительные свойства. Препарат дает положительные реакции на натрий-ион, для этого используют дифениламин в кислой среде. От действия разведенной серной кислоты растворы препарата разлагаются с выделением красно-бурых паров диоксида азота.
Количественное определение основано на восстановительных свойствах препарата при взаимодействии с избытком титрованного раствора перманганата калия в кислой среде.
Препарат гигроскопичен, легко окисляется на воздухе, поэтому требует соответствующих условий хранения.
Назначают внутрь, подкожно, внутривенно как коронарорасширяющее средство при стенокардии.
Препараты соединений висмута. Висмута нитрат основной получают окислением свободного от примесей металлического висмута концентрированной азотной кислотой. Фармакопейный препарат практически нерастворим в воде и этаноле, окрашивает синюю лакмусовую бумагу в красный цвет вследствие гидролиза с образованием азотной кислоты и гидроксида висмута. Растворим в кислотах (азотной, соляной).
Подлинность препарата устанавливают прокаливанием, которое приводит к разложению с образованием желто-бурых паров (диоксида азота) и желтого остатка (оксида висмута).
Количественное определение выполняют комплексонометрическим методом в нагретой азотной кислоте, титруя 0,05 М раствором трилона Б в присутствии индикатора пирокатехи нового фиолетового.
Учитывая непостоянство состава препарата, расчет содержания проводят по оксиду висмута, которого должно быть 79—82 %.
Хранят в хорошо укупоренной таре, в темном месте. При доступе влаги и света он постепенно гидролизуется с образованием азотной кислоты и оксидов азота.
Применяют как вяжущее и частично антисептическое средство при желудочно-кишечных заболеваниях.
Уголь, карбонаты и гидрокарбонаты. Уголь активированный. Уголь получают сжиганием органических веществ при слабом доступе воздуха. При сжигании дерева получают древесный, а при сжигании животных тканей (костей и др.) — животный уголь. Первый содержит до 90% углерода, второй — 7—10% углерода и до 80% золы (в основном фосфата кальция). Для получения угля активированного, применяемого для лечения, его обрабатывают перегретым паром (при 900 °С). Высокая адсорбционная способность угля активированного обусловлена наличием пор, которые классифицируют на супермикропоры (0,6—0,7 нм), микропоры (0,8—1,6 нм), мезопоры (1,7—200 нм) и макропоры (более 200 нм). В микропорах и супермикропорах, соизмеримых с размерами адсорбируемых молекул, механизм адсорбции сводится к объемному заполнению. В ме-зопорах происходит последовательное образование адсорбционных слоев, которое завершается заполнением пор по типу капиллярной конденсации. Макропоры служат транспортными каналами, подводящими молекулы поглощаемых веществ к адсорбционному пространству зерен угля. В целом адсорбционная поверхность 1 г угля активированного высокого качества достигает 1000 м2.
К препарату предъявляют высокие требования по чистоте. Устанавливают нейтральность водного извлечения из препарата, допустимое содержание необуглившихся веществ: растворимых в воде — не более 1 %, растворимых в разведенной соляной кислоте — не более 3 %. Не допускается содержание сульфидов и цианидов. Нормируют допустимое содержание примесей хлоридов (0,008% ), сульфатов (0,02 % ), тяжелых металлов (0,001 % ), железа (0,01 % ), мышьяка (0,0001 % ), а также степень измельчения, потерю массы при высушивании (не более 10% ), остаток после прокаливания (не более 4 %).
Качество угля активированного обусловлено его адсорбционной способностью, которую по ГФ устанавливают с помощью 0,15%-ного раствора метиленового синего. Этот раствор (16 мл) смешивают с 0,1 г высушенного при 120 "С до постоянной массы угля, взбалтывают в течение 5 мин и фильтруют. Фильтрат должен быть бесцветным или почти бесцветным.
Карбонаты и гидрокарбонаты. В лечебной практике нашли применение калиевые, натриевые и литиевые соли угольной кислоты.
Угольная кислота образует два ряда солей: средние (карбонаты) и кислые (гидрокарбонаты). В ГФ включен натрия гидрокарбонат.
Испытания этих солей на подлинность основаны на химической реакции разложения минеральной кислотой (например, соляной). Бывает важно в условиях аптеки отличить натрия карбонат от натрия гидрокарбоната, учитывая сходство физических и химических свойств. Для этого к раствору соли добавляют индикатор фенолфталеин. При этом 0,1 М раствор карбонатов приобретает красное окрашивание, а аналогичный раствор натрия гидрокарбоната остается бесцветным или становится слабо-розовым.
Получают гидрокарбонат при насыщении очищенного кристаллического карбоната натрия диоксидом углерода.
Подлинность натрия гидрокарбоната устанавливают по наличию иона натрия и гидрокарбонат-иона. Последний обнаруживают по реакции разложения разведенной кислотой и выделением пузырьков газа.
Количественное определение проводят титрованием (предварительно прокипяченного раствора препарата) 0,1 М раствором соляной кислоты (индикатор метиловый оранжевый). Аналогичные способы используют для испытания на подлинность и для количественного определения карбонатов (калия, лития).
Натрия гидрокарбонат хранят в хорошо укупоренных банках. Во влажном воздухе он медленно теряет диоксид углерода и переходит в карбонат натрия.
Применяют как антацидное средство и наружно для полосканий и ингаляций (0,5—2%-ные растворы).
Используют и лития карбонат. Способы его испытаний аналогичны гидрокарбонатам.
Применяют для лечения подагры и для растворения почечных камней, а также как нейролептическое средство.
Препараты бора. В качестве лечебных средств из этих эле -ментов применяют соединения бора: кислоту борную и натрия тетраборат. Источник их получения — природные минералы, которые либо сами содержат борную кислоту (сассолин) и натрия тетраборат (бура, кернит), либо разрушаются с их образованием. Лекарственный препарат кислоты борной обычно получают разложением буры или борокальцита горячим раствором соляной кислоты. Натрия тетраборат получают действием раствора карбоната натрия (при нагревании) на кислоту борную или минерал борокальцит.
Оба препарата растворимы в воде, кислота борная еще и в этаноле.
Подлинность препаратов бора устанавливают по реакции образования в присутствии этанола борноэтилового эфира. Если смесь поджечь, этанол горит пламенем, окаймленным зеленым цветом.
Для количественного определения используют кислотные свойства растворов кислоты борной в глицерине и щелочные свойства водных растворов натрия тетрабората, применяя методы титрования.
Препараты назначают в качестве антисептических средств.
Препараты кальция, магния, бария, цинка и ртути. Препараты соединений магния. Применяют в лечебной практике в виде магния оксида, магния карбоната основного, магния сульфата и др.
Для получения препаратов магния используют минералы (магнезит, эпсомит, кизерит, доломит), а также природные и искусственные рассолы, содержащие соли магния. В земной коре содержится 2,1% магния (по массе).
Магния сульфат легко растворим в воде, нерастворим в спирте, а магния оксид и магния карбонат основной практически нерастворимы в воде и в этаноле, но растворимы в разведенных кислотах.
Испытания на подлинность магния оксида и магния карбоната основного проводят после предварительного растворения в разведенных кислотах (соляной) и добавлении к растворам гидрофосфата натрия и раствора аммиака (выпадает белый осадок фосфата магния-аммония, растворимый в уксусной кислоте). Эта реакция одновременно подтверждает наличие карбонат-иона.
Количественное определение проводят прямым комплексономет-рическим методом с использованием индикатора кислотного хром-черного специального и титранта — 0,05 М раствора трилона Б (красно-фиолетовая окраска раствора переходит в синюю).
Препараты хранят в хорошо укупоренной таре, поскольку они хорошо взаимодействуют с влагой воздуха.
Магния окись и магния карбонат основной применяют в качестве антацидных средств (при повышенной кислотности желудка), а магния сульфат как слабительное, желчегонное, седативное, противосу-дорожное и спазмолитическое средство.
Препараты соединений кальция. Фармакопейный кальция хлорид получают обработкой мела или мрамора соляной кислотой: СаСО3+2НС1=СаС12+СО2Т+Н2О. Препарат хорошо растворим в воде, растворы нейтральные; растворим в этаноле. Наличие иона кальция устанавливают по окрашиванию бесцветного пламени горелки в кир-пично-красный цвет и по образованию белого осадка при добавлении оксалат аммония к раствору препарата.
Количественное определение выполняют комплексонометричес-ким методом. В его основе — тот же процесс, что и при определении солей магния. Кроме того, препарат можно определять и по аниону аргентометрическим методом.
При хранении следует учитывать высокую гигроскопичность.
Применяют (внутрь и внутривенно) в качестве противоаллергического, противовоспалительного, кровоостанавливающего, детоксицирующего, диуретического средства.
Препараты солей бария. В лечебной практике используют два препарата: бария сульфат (для рентгеноскопии) и адсобар (антидот). Для получения препаратов минералы (барит — тяжелый шпат) превращают в растворимую соль — хлорид бария, на который действуют сульфатом натрия или магния.
Препараты практически нерастворимы в воде и ни в одном из общеизвестных растворителей.
На подлинность испытывают путем превращения в карбонаты кипячением в растворе карбоната натрия. Осадок отфильтровывают, промывают водой, и фильтрат испытывают на наличие сульфат-ионов (используя реактив — раствор хлорида бария), обрабатывая соляной, а затем разведенной серной кислотой.
При испытании на чистоту уделяют внимание обнаружению солей бария, растворимых в воде (хлориды) или в кислотах (сульфиды, карбонаты), поскольку при всасывании они могут вызвать тяжелое отравление организма.
Препараты соединений цинка. В ГФ включены два неорганических препарата цинка: цинка оксид и цинка сульфат. Основной источник их получения — очищенный от примесей металлический цинк. По физическим свойствам препараты отличаются друг от друга, поскольку один является оксидом, а другой солью.
Цинка оксид практически нерастворим в воде, растворим в растворах кислот, щелочей и аммиака. Цинка сульфат легко растворим в воде (кислая реакция раствора). Оба препарата практически нерастворимы в этаноле.
Перед испытанием на подлинность цинка оксид превращают в соль, растворяя в серной кислоте. Наличие иона цинка в обоих препаратах устанавливают по образованию белого осадка сульфида цинка, нерастворимого в уксусной кислоте и легко растворимого в разведенной соляной кислоте (реакцию проводят в нейтральной среде). Реакция позволяет отличать цинк от других тяжелых металлов, образующих сульфиды черного цвета.
Количественное определение препаратов проводят комплексоно-метрическим методом по аналогии определения магния и кальция.
Цинка оксид применяют наружно в качестве вяжущего, подсушивающего и антисептического средства. Растворы цинка сульфата (0,1— 0,25%-ные) используют в качестве вяжущего и антисептического средства в глазной, отоларингологической и урологической практике.
Препараты соединений ртути. Ртуть образует два ряда солей: соли ртути (I), имеющие катион (Hg2)2+, и соли ртути (II), имеющие катион Hg2+. Каждая из этих форм образует оксиды. В настоящее время сохранили свое значение три препарата ртути: ртути оксид желтый, ртути амидохлорид и ртути дихлорид. Ртути дихлорид получают при нагревании до 335—340 "С смеси паров ртути и газообразного хлора: Hg+2Cl=HgClr Из ртути дихлорида получают другие соединения ртути. Физические свойства препаратов отличаются друг от друга.
Ртути оксид желтый и ртути амидохлорид практически нерастворимы в воде, этаноле, эфире. В кислотах первый легко растворим, а второй растворим. Ртути дихлорид растворим в воде, кислотах, эфире, легко в этаноле.
Для идентификации солей ртути можно использовать различные химические реакции. ГФ рекомендует реакции осаждения растворами йодида калия, сероводорода или сульфида натрия и раствором гидроксида натрия. Для установления подлинности и количественной оценки наиболее часто применяют реакцию с йодидом калия (образуется ярко-красный осадок дийодида ртути). Подлинность ртути оксида желтого устанавливают после растворения в разведенной соляной кислоте, а ртути амидохлорида — после растворения в разведенной азотной кислоте.
Количественное определение ртути оксида желтого и ртути амидохлорида проводят методом нейтрализации, используя основные свойства этих препаратов, которые они проявляют при растворении в йодиде калия. Выделившиеся гидроксид калия и аммиак титруют раствором соляной кислоты. Для количественного определения дихлорида ртути ГФ рекомендует реакцию восстановления. В качестве восстановителя используют формальдегид в щелочной среде. Выделившуюся ртуть определяют, окисляя избытком йода в присутствии йодида калия.
Препараты ртути хранят в хорошо укупоренных банках оранжевого стекла, защищенных от света: по списку А — дихлорид (сулема); по списку Б — ртути оксид желтый и ртути амидохлорид. Все исследования и манипуляции с препаратами проводят под тягой.
Нерастворимые соли ртути используют в виде мазей в глазной практике (ртути оксид желтый 1—2%-ный) и при заболеваниях кожи (ртути амидохлорид 10%-ный) как антисептические и противовоспалительные средства. Растворы сулемы, ранее использовавшиеся в разведении 1:1000 для дезинфекции белья, одежды, инструментария, в настоящее время не применяют. В то же время раствор дихлорида ртути в органических лигандах под названием Витурид-В проявляет выраженное противоопухолевое и умеренное антивирусное и антимикробное действие. В этих целях его испытывают в ветеринарии для лечения плотоядных.
Препараты меди и серебра. Препараты соединений меди. В ГФ включен меди сульфат (II). Его получают действием серной кислоты на металлическую медь в присутствии окислителей. Этот способ лежит в основе промышленного получения препарата.
Для установления подлинности препарата используют свойство меди легко восстанавливаться из соединений. В качестве восстановителя используют железную пластинку, которая при соприкосновении с растворами меди сульфата покрывается красным налетом металлической меди.
Количественное определение основано на восстановлении катиона меди (II) до меди (I), или применяют комплексонометрический метод.
Меди сульфат применяют в качестве наружного антисептического вяжущего и прижигающего средства (0,25%-ный раствор) в глазной и урологической практике, а также как антигельминтное средство при мониезиозе.
Препараты соединений серебра. В практике используют серебра нитрат и коллоидные препараты: колларгол и протаргол. Применяют и ионное серебро.
Нитрат серебра получают воздействием на металлическое серебро избытка азотной кислоты. При этом серебро окисляется с образованием соли. Препарат легко растворяется в воде с образованием нейтральных растворов. Для испытания подлинности серебра нитрата используют те же методы, что и для меди сульфата: восстановление и способность к комплексообразованию. Серебро восстанавливается из аммиачного раствора серебра нитрата при нагревании с раствором формальдегида.
Количественно препарат определяют тиоцианатометрическим (ро-данометрическим) методом.
Хранят по списку А в хорошо укупоренной таре.
Назначают наружно как антисептик (1—2%-ные водные растворы).
Ионное серебро получают специальными ионаторами Кульского в водной среде. Препарат проявляет антимикробное, противовирусное действие. Назначают наружно или ингаляционно.
Препараты железа. Препараты железа и его соединений. В клинике применяют железа сульфат (II), который получают, растворяя избыток восстановленного железа в 25—30%-ном растворе серной кислоты при нагревании до 80 °С. Препарат легко растворим в воде (слабокислая реакция раствора). ГФ рекомендует для обнаружения катиона железа реакцию образования синего осадка турнбулевой сини при действии гексацианоферрата калия. Сульфат-ион обнаруживают по реакции с раствором хлорида бария.
Для количественного определения используют реакцию окисления ионов железа (II) в ионы железа (III) с помощью титрованного раствора перманганата калия. Простым методом определения железа (II) является цериметрия. Фотометрический метод основан на образовании окрашенного комплекса железа (II) с о-фенантролином. Оптическую плотность измеряют при 508 нм. Определение общего содержания железа в лекарственных средствах и установление его примеси проводят методом рентгенофлуоресцентной спектроскопии или мессбауэровской спектроскопией.
Препарат(ы) хранят в хорошо укупоренной таре в сухом месте.
Из препаратов железа известны его сочетания с сахаром — фер-румлек (железо с мальтозой) для внутривенного применения при гипохромных анемиях и целый ряд лекарственных форм, в которые входят железо (II) и железо-ионы (III): феррокомплекс (железо с аскорбиновой кислотой); таблетки феррокаль; ферроглюкин и др.
Препараты комплексных соединений. В медицинской практике используют некоторые комплексные соединения железа, платины, золота:
натрия нитропруссид (нанипрус), представляющий собой натрия нитрозилпентоцианоферрат, проявляющий гипотензивное действие. Выпускают в ампулах (сухой порошок для растворения в воде для инъекций). Вводят внутривенно;
платим — оказывает противоопухолевое действие. Хранят по списку А;
кризанол — смесь из 70 % ауротиопропанол сульфоната кальция и 30% глюконата кальция. Содержит 33,5% золота. Применяют внутримышечно 5%-ную взвесь в масле для инъекций при лечении ревматоидного артрита, красной волчанки.
Препараты, содержащие радиоактивные изотопы (радиофармацевтические препараты). Предпосылки применения радиоактивных препаратов в медицине. Действие радиоактивных изотопов на организм зависит от количества радиоактивного вещества, типа и энергии излучения, периода полураспада, физико-химических свойств, путей введения или проникновения в организм. Радиоактивные изотопы могут накапливаться в определённых органах (тканях) или равномерно распределяться по всему организму. Присутствие радиоактивного элемента в том или ином органе легко установить по интенсивности излучения с помощью счетчика (радиометра). Из организма эти препараты выводятся постепенно через желудочно-кишечный тракт (до 90%) или через почки до (10%), значительно реже — через слизистую оболочку рта, кожу, потовые и молочные железы. Эти свойства послужили основой для применения радиоактивных изотопов, обладающих бета- и альфа-излучением, в качестве диагностических (болезни сердечно-сосудистой системы, почек, печени и др.) и лечебных средств (злокачественные образования).
Единицы измерения и константы. Единицей измерения радиоактивности в единицах СИ является беккерель (Бк). 1 Бк равен одному распаду в секунду. В ГФ XI использованы единицы: милликюри (мкюри — мКи), составляющая 0,001 Ки, и микрокюри (мккюри — мкКи) - 0,000001 Ки; 1 Ки=3,71010 Бк; 1 Бк-2,7031011 Ки; 1 мКи=37 МБк (мегабеккерель); 1 МБк=106 Бк.
Единицей измерения энергии ионизирующих излучений в единицах СИ является джоуль (Дж). Энергию радиоактивного излучения отдельных частиц обычно измеряют в мегаэлектронвольтах (МэВ); 1 МэВ-1,6-10-13 Дж=0,16 пДж.
Для оценки качества радиофармацевтических препаратов устанавливают их подлинность и измеряют активность. С этой целью используют следующие параметры и константы: период полураспада; удельную активность — отношение активности радионуклида в препарате к массе препарата или к массе элемента; объемную активность — отношение активности радионуклида в препарате к объему препарата.
С помощью радионуклидного анализа проверяют радионуклидную чистоту — отношение активности основного радионуклида к общей активности препарата (%) и радиохимическую чистоту — отношение активности радионуклида в основном химическом веществе препарата к общей активности радионуклида в этом препарате (%). Устанавливают также наличие нуклидных примесей — примесей других радионуклидов как того же, так и других элементов (%) и радиохимических примесей — примесей других химических соединений, содержащих тот же радионуклид, что и основное вещество (%).
Особенности стандартизации радиоактивных препаратов. Особенности качественной и количественной оценки радиоактивных препаратов заключаются в использовании не только химических и физико-химических методов, но и радиометрического анализа. Расчет содержания радиоактивных элементов весьма сложен. Поэтому для качественного и количественного анализов радиофармацевтических препаратов используют сравнительный способ расчета активности испытуемого препарата и образца источника излучения (эталона) в идентичных условиях. Так определяют удельную и относительную активности по сравнению с эталоном.
Для выполнения испытаний берут обычно доли миллилитра радиофармацевтического препарата, учитывая высокую их стоимость, малый объем выпуска, необходимость специальных условий для выполнения анализа (радиоактивной защиты). Поэтому методы, рекомендуемые для контроля ГФ XI и другими фармакопеями мира, должны давать возможность получения надежных результатов при проведении испытаний малых количеств и в короткие сроки вследствие непродолжительных сроков годности.
В медицинской практике применяют около 50 радиофармацевтических препаратов, на которые имеются ФС и ВФС, в которых отражены особенности, предъявленные к качеству этих средств. В ГФ XI, вып. 1, с. 55 в общей статье «Радиоактивность» приведены термины и определения, единицы активности и энергии, основные ядерно-физические характеристики радионуклидов, особенности состава и свойств радиофармацевтических препаратов, а также методы их контроля и способы защиты от облучения.
Фармакопейные радиоактивные препараты. В ГФ включены инъекционные растворы радиоактивных препаратов: раствор натрия фосфата, меченного по фосфору 32, (Na2HPO432P) и раствор натрия" о-йодгиппурата, меченного по йоду 131. Их стандартизация осуществляется с требованиями общей статьи ГФ XI и частными ФС.
Эти и другие растворы применяют для диагностики и лечения в соответствующих дозах, соблюдая необходимую технику безопасности (в условиях, предохраняющих от излучения).
Растворы радиоактивных препаратов упаковывают и хранят согласно НТД и специальным правилам. Их выпускают не только во флаконах, закрытыми герметично, но и в специальных защитных контейнерах. Хранят такие растворы по списку А в специальных шкафах для радиоактивных веществ, строго соблюдая правила, изложенные в НТД.
1.2.2 ОРГАНИЧЕСКИЕ ЛЕКАРСТВЕННЫЕ СРЕДСТВА
1.2.2.1 АЛИФАТИЧЕСКИЕ СОЕДИНЕНИЯ (АЛКАНЫ)
Предельные углеводороды и их галогенопронзвод-н ы е. Препараты предельных углеводородов. Предельные (насыщенные) углеводороды, или алканы, представляют собой гомологический ряд соединений углерода с водородом с общей формулой CnHjn+r Эти соединения входят в состав природного газа, нефти и др. Их физические свойства зависят от числа атомов углерода в молекуле. Низшие члены этого ряда — метан, этан, пропан, бутан — газообразные вещества; от пентана С5Н12 до гептадекана С17Н36 — жидкости при (20 °С); при более высоких содержаниях углерода — твердые тела.
В лечебной практике применяют некоторые смеси жидких и твердых предельных углеводородов: масло вазелиновое, вазелин, парафин твердый. Источником их получения служит фракция нефти, содержащая смазочные (соляровые) масла. Перед использованием их подвергают очистке.
Свойства этих препаратов зависят от числа атомов углерода. Масло вазелиновое — бесцветная маслянистая жидкость, вазелин — мазеобразная масса белого или желтого цвета, парафин — плотная просвечивающаяся масса белого цвета. При температуре 20 "С не имеют запаха и вкуса. Растворимы в эфире, хлороформе, бензине. Смешиваются с жирами и жирными кислотами.
Подлинность подтверждают, проверяя физические константы (температуру плавления, плотность и др.). При испытании чистоты устанавливают отсутствие примесей.
В отличие от животных жиров препараты устойчивы при хранении: не окисляются, не прогоркают, не омыляются щелочами, стойки к воздействию кислот.
Используют в качестве индифферентной основы для приготовления различных лекарственных форм (мазей, паст, суспензий и др.), а парафин — в физиотерапии.
Препараты галогенопроизводных углеводородов. Это — углеводороды, в молекулах которых один или несколько атомов водорода замещены галогенами (фтором, хлором, бромом или йодом). Наиболее широко из них применяют хлорэтил, фторотан, хлороформ. Первый получают в промышленных условиях при введении галогена в молекулу углеводорода, спирта, альдегида, кетона или другого алифатического соединения. Фторотан получают путем бронирования 1,1,1-трифтор-2-хлорэтана (при 465 °С). Хлороформ получают электролизом хлорида натрия в присутствии этилового спирта или ацетона.
По физическим свойствам — это прозрачные, бесцветные, летучие жидкости с низкой температурой кипения (хлорэтил — 12— 13°С; фторотан — 49—51, хлороформ — 59,5—62 °С). Малорастворимы в воде, но смешиваются со спиртом и эфиром, а хлороформ и фторотан — со многими эфирными и жирными маслами.
Для открытия в них хлоридов используют раствор нитрата серебра, а также реакцию, основанную на образовании окрашенного в красно-фиолетовый цвет соединения после нагревания со смесью 10%-ного раствора гидроксида натрия и пиридина.
Количественное определение выполняют с помощью дегалогенирования при нагревании со спиртовым раствором щелочи и последующей аргентометрией образовавшегося галогенид-иона (хлорэтил, хлороформ).
Хранят в склянках оранжевого стекла, тщательно укупоренными.
Используют для ингаляционного наркоза и местно (хлороформ).
С п и р т ы. В фармацевтической практике важное значение имеют одноатомный спирт — этиловый и трехатомный — глицерин. Спирт этиловый получают брожением, а глицерин — омылением жиров.
В ГФ включены статьи на спирт этиловый 95, 90, 70, 40%-ный и глицерин.
Спирт этиловый смешивается во всех соотношениях с водой и большинством органических растворителей, глицерин — с водой и этанолом, но практически нерастворим в эфире и жирных маслах.
Для испытания на подлинность спирта этилового используют реакцию образования сложного эфира с уксусной кислотой. Образующийся этилацетат имеет своеобразный фруктовый запах. Идентифицировать спирт этиловый можно также по реакции образования йодоформа.
Подлинность глицерина устанавливают по образованию непредельного альдегида — акролеина под действием водоотнимающих веществ (например, калия гидросульфата).
Количественное определение спирта этилового в жидких лекарственных формах по требованиям ГФ XI, вып. 1, с. 26 устанавливают по плотности отгонов или температуре кипения водно-спиртовых примесей. Для количественного определения глицерина можно использовать реакцию образования сложного эфира.
Спирт этиловый используют наружно как антисептик, для получения лекарственных растворов и в качестве наркотического средства для крупного рогатого скота и овец.
Альдегиды и их производные. Препараты альдегидов. В фармацевтической практике используют 40%-ный раствор формальдегида (формалин) и хлоралгидрат. Синтезируют препараты альдегидов окислением первичных спиртов. Формальдегид получают окислением метилового спирта кислородом воздуха и окислением метана. Хлоралгидрат можно получить электрохимическим окислением этилового спирта в присутствии хлоридов натрия и калия.
Идентифицировать формальдегид можно с помощью реакций образования окрашенных продуктов взаимодействия с хромотропо-вой или салициловой кислотами в присутствии концентрированной серной кислоты. ГФ рекомендует использовать салициловую кислоту (красное окрашивание). Подлинность хлоралгидрата устанавливают по образованию хлороформа под действием гидроксида натрия; выделившийся при этом хлороформ обнаруживают по запаху, помутнению жидкости или цветным реакциям.
Количественное определение формальдегида и хлоралгидрата можно провести, используя реакцию окисления альдегидов йодом в щелочной среде. Йод при этом образует гипойодит (сильный окислитель). Известен также сульфитный метод определения формальдегида, основанный на его взаимодействии с раствором сульфита натрия.
При определении степени чистоты формалина устанавливают предельное содержание в нем муравьиной кислоты (метод нейтрализации). По ГФ допускается ее содержание не более 0,2% .
Раствор формальдегида используют как дезинфицирующее, а хлоралгидрат — как снотворное, противосудорожное и наркотическое средство.
Гексаметилентетрамин. Это — гетероциклическое соединение, производное 1,3,5-триазина. Источник его получения — раствор формальдегида. По фармакопее его подвергают очистке активированным углем. Препарат хорошо растворим в воде, очень мало в эфире. Характерное свойство — способность возгоняться без плавления. В воде имеет щелочную реакцию.
Идентифицируют препарат по запаху выделяющегося формальдегида при нагревании с разведенной серной кислотой. Если затем добавить избыток щелочи и вновь нагреть, то появляется запах аммиака. Количественно определяют йодометрическим методом — образует с йодом малорастворимый полийодид.
Хранят в хорошо укупоренной таре при температуре не выше 20 "С. Нельзя стерилизовать в растворах.
Применяют внутрь и внутривенно (в форме 40%-ного раствора) как химиотерапевтическое средство.
Карбоновые кислоты и их соли. Общая характеристика. Карбоновые кислоты алифатического ряда представляют собой производные углеводородов, у которых один атом водорода замещен карбоксильной группой. Эту группу соединений можно также рассматривать как конечный продукт окисления спиртов, не связанный с разрушением углеродной цепи.
Препараты солей карбоновых кислот. В фармации используют калия ацетат, натрия оксибутират, натрия цитрат для инъекций, кальция лактат, кальция глюконат.
Калия ацетат получают нейтрализацией уксусной кислоты эквивалентным количеством карбоната калия. Источником синтеза натрия оксибутирата является у-бутиролактон, который в промышленности синтезируется из 1,4-бутандиола. Для получения натрия цитрата нейтрализуют (до слабощелочной реакции) раствор лимонной кислоты (очистка от примесей — перекристаллизация из спирта). Кальциевые соли молочной и глюкуроновой кислот получают окислением глюкозы в присутствии соединений кальция. Кальция глюконат получают электрохимическим окислением глюкозы в присутствии бромида кальция и карбоната кальция.
Соли щелочных металлов (калия ацетат, натрия оксибутират, натрия цитрат) легко растворимы в воде; кальциевые соли медленно растворимы в холодной воде, но в кипящей воде их растворимость улучшается.
Для испытания подлинности с помощью соответствующих аналитических реакций обнаруживают в растворах препаратов наличие ионов калия, натрия и кальция.
Ацетат-ион в калия ацетате обнаруживают реакцией образования сложного эфира при взаимодействии препарата со спиртом этиловым и серной кислотой. Наличие оксибутират-иона подтверждают реакцией образования у-бутиролактона под действием соляной кислоты. Лактат-ион идентифицируют разложением перманганата калия в кислой среде (образуется ацетальдегид, имеющий характерный запах).
Препараты солей щелочных металлов количественно можно определить методом нейтрализации. Кальциевые соли карбоновых кислот определяют комплексонометрическим методом. Методика идентична определению неорганических препаратов кальция.
Препараты карбоновых кислот хранят в хорошо укупоренной таре, учитывая их гигроскопичность (калия ацетат) или возможность потери кристаллизационной воды (кальция лактат, кальция глюконат, натрия цитрат), натрия оксибутират — по списку Б в банках оранжевого стекла.
Калия ацетат применяют как источник ионов калия (при гипока-лиемии) и диуретическое средство, натрия оксибутират — в качестве наркотического средства, натрия цитрат для предупреждения свертываемости крови, препараты кальция — как источник ионов кальция и в качестве антиаллергических средств.
Простые эфиры. Препараты простых алифатических эфиров. Простые эфиры (этеры) представляют собой кислородсодержащие органические соединения с общей формулой R—О—R,.
В фармации используют препараты диэтилового эфира: эфир медицинский и эфир для наркоза. Промышленный синтез диэтилового эфира проводят при нагревании до 135 °С смеси спирта этилового и концентрированной серной кислоты в специальных аппаратах — эфиризаторах. Для медицинских целей эфир очищают от кислот и других примесей; дополнительную очистку проводят гидросульфитом натрия и щелочным раствором перманганата калия.
Подлинность фармакопейных эфиров подтверждают по физическим константам: температуре кипения и плотности.
Эфир для наркоза ввиду высокой степени чистоты должен иметь более узкие интервалы значений плотности и температуры кипения. Для этого проводят дополнительные испытания на пероксиды и альдегиды. Кроме того, в эфире для наркоза устанавливают наличие примеси воды, используя в качестве реактива пикриновую кислоту. Последняя растворяется в воде, содержащейся в эфире, окрашивая ее в желтый цвет.
Оба препарата относятся к списку Б. Эфир медицинский хранят в хорошо укупоренных склянках оранжевого стекла в защищенном от света месте, вдали от огня. Склянки закупоривают корковыми пробками с пергаментной прокладкой и заливают специальной цинк-желатиновой массой, нерастворимой в эфире. Эфир для наркоза укупоривают еще более тщательно: под корковую пробку подкладывают металлическую фольгу, а поверх заливают специальной мастикой. По истечении каждых 6 мес хранения эфир для наркоза подвергают контролю в соответствии с требованиями НТД. В последнее время выпускают эфир для наркоза, стабилизированный антиоксидантом в количестве 0,0001 %. Срок годности его 3 года.
Препараты простых арилалифатических эфиров. Арилалифатичес-кие соединения характеризуются наличием ароматических радикалов в молекулах алифатических соединений. К этой группе относится фармакопейный препарат димедрол, который получают из бензгид-рола. Препарат очень легко растворим в воде, легко — в этаноле и хлороформе, очень мало — в эфире.
Для испытания на подлинность используют УФ-спектроскопию 0,05%-ного раствора в этаноле (область от 240 до 280 нм). Под действием концентрированной серной кислоты димедрол образует оксониевую соль, окраска которой из ярко-желтой постепенно переходит в кирпично-красную. При добавлении воды окраска исчезает.
Количественное определение димедрола, подобно другим гипо-хлоридам органических оснований, выполняют методом неводного титрования. Титруют 0,1 М раствором хлорной кислоты в среде безводной уксусной кислоты после добавления ацетата ртути (II) (индикатор кристаллический фиолетовый). Кроме того, димедрол можно определять алкалиметрическим, йодхлорометрическим и аргентомет-рическим методом.
Хранят по списку Б в хорошо укупоренной таре, предохраняющей его от действия света, влаги. При хранении препарат постепенно слеживается. Применяют в качестве противогистаминного (антиаллергического) средства.
Сложные эфиры. Препараты сложных эфиров арилалифати-ческих кислот. Из многочисленных препаратов сложных эфиров этой группы лечебное значение имеют апрофен и метацин. Первый легко, а второй умеренно и медленно растворимы в воде. Апрофен легко растворим в этаноле и хлороформе, метацин — мало в этаноле, практически нерастворим в хлороформе.
Подлинность препаратов устанавливают цветной реакцией с концентрированной серной кислотой. Продукты реакций апрофена — зеленовато-желтые, метацина — пурпурно-красные.
Количественно определение выполняют по УФ спектрам поглощения, а также аргентометрическим методом по хлорид- (апрофен) или йодид-иону (метацин). ГФ рекомендует обратное аргентометри-ческое титрование по йодид-иону для определения метацина.
Хранят в хорошо укупоренной таре: апрофен — по списку Б, а" метацин — по списку А.
Проявляют холино-, спазмолитическое и сосудорасширяющее действие. Назначают при спастических состояниях органов брюшной полости и спазмах кровеносных сосудов (стенокардия).
Препараты сложных эфиров азотной кислоты. В ГФ включены нитроглицерин и эринит. Исходными продуктами их получения служат соответствующие спирты, азотная кислота и концентрированная серная кислота. При получении используют реакцию этерификации.
Нитроглицерин представляет собой маслянистую жидкость, эринит — кристаллическое вещество. Оба препарата растворимы в этаноле и других органических растворителях. В воде нитроглицерин мало растворим, эринит практически нерастворим.
Подлинность устанавливают по нитрат-ионам, которые образуются при гидролизе. Реактив — дифениламин, дающий голубую окраску.
Спиртовой компонент молекул обоих препаратов можно обнаружить реакцией бензоилирования (образование эфиров бензойной кислоты после обработки хлористым бензолом). Количественное содержание нитроглицерина можно определить реакцией окисления в присутствии окислителя (пероксид водорода), атакже фотометрически.
Хранят по списку Б в хорошо укупоренной таре. Особую осторожность соблюдают при хранении нитроглицерина, так как от удара или нагревания до 180 °С он взрывается из-за образования большого количества газа.
Используют в качестве коронорасширяющих средств.
Производные бис -(β-x лорэтил)-амина. В онкологии широко применяют сарколизин и хлорбутин. Оба — белые порошки. Способы их синтеза основаны на введении в аминопроизводное кольцо (алифатического, ароматического или гетероциклического ряда) оксиэтильной группы с помощью р-хлорэтанола или этиленоксида.
Сарколизин легко растворим (при нагревании) в воде, хлорбутин — практически нерастворим.
Для испытания подлинности используют различные химические реакции, с помощью которых обнаруживают алифатическую или ароматическую части молекулы, несущие бис-ф-хлорэтил)-амин.
ГФ для испытаний на подлинность и количественное определение рекомендует использовать реакции на органически связанный хлор. Возможно и фотометрическое определение всех препаратов данной группы по окрашенному продукту реакции с диэтиламидом р-пиридинкарбоновой кислоты.
Аминокислоты алифатического ряда. Аминокислоты представляют собой производные карбоновых кислот, содержащие в молекуле одну или несколько аминогрупп. Из белковых гидролиза-тов получено более 20 а-аминокислот. Наиболее часто в качестве лекарств используют следующие аминокислоты, их производные или синтетические аналоги: аминалон, кислоту аминокапроновую, фени-бут, кислоту глутаминовую, цистеин, ацетилцистеин, метионин.
В промышленных условиях аминалон получают расщеплением а-пирролидона гидроксидом калия в присутствии воды при 100—110 "С в течение 2—3 ч; аминокапроновую кислоту синтезируют из циклогексанона; кислоту глутаминовую и метионин получают гидролизом белковых веществ; цистеин синтезируют, восстанавливая водородом цистин (из рогов или волос), а получение ацетилцистеина основано на способности аминокислот ацетилироваться по аминогруппе.
Это белые кристаллические вещества. Аминалон, кислота амино-капроновая, фенибут, ацетилцистеин легко растворимы, а цистеин растворим в воде. Метионин и кислота глутаминовая растворимы в горячей воде. В этаноле легко растворим ацетилцистеин и растворим фенибут. В других органических растворителях эти препараты практически нерастворимы или мало растворимы.
Для испытания препаратов на подлинность используют общую цветную реакцию с нингидрином. При взаимодействии с солями меди аминокислоты образуют комплексные соединения с темно-синей окраской. Подлинность аминалона устанавливают по образованию ярко-малинового окрашивания при нагревании смеси препарата и аллоксана в среде диметилформамида на кипящей водяной бане. Кислоту аминокапроновую открывают нагреванием на водяной бане смеси раствора препарата с 5%-ным раствором хлорамина в присутствии 1%-ного раствора фенола — синее окрашивание, которого не образуют аминалон, кислота глутаминовая, метионин, цистеин. Подлинность кислоты глутаминовой подтверждают цветной реакцией с резорцином в присутствии концентрированной серной кислоты. Образуется продукт красного цвета, который при растворении в растворе аммиака приобретает красно-фиолетовое окрашивание. Реакцию образования этилацетата используют для обнаружения ацетильной группы в ацетилцистеине.
Количественное определение аминалона, кислоты аминокапроно-вой и фенибута выполняют методом неводного титрования. Кислоту глутаминовую количественно определяют методом нейтрализации 0,1 М раствором гидроксида натрия с индикатором бромтимоловым синим. Метионин определяют в водноспиртовой среде, титруя этим же титрантом. Цистеин и ацетилцистеин титруют в кислой среде 0,1 М раствором йода.
Хранят в хорошо укупоренной таре; кислоту аминокапроновую, фенибут и ацетилцистеин — по списку Б.
Кислоту глутаминовую применяют при психических расстройствах; аминалон — при ослаблении памяти, атеросклерозе; фенибут — при неврозах; кислота аминокапроновая проявляет кровоостанавливающее действие; цистеин эффективен при начальных формах катаракты; ацетилцистеин оказывает муколитическое действие; метионин используют при заболеваниях печени. Производным метионина является витамин U (применяют при язве желудка). Диме-тильное производное цистеина — пеницилламин, или купренил, — антидот при отравлениях железом, ртутью, свинцом, медью и кальцием (обладает высокой комплексообразующей активностью с ионами этих элементов).
Углеводы. Большинство углеводов представляет собой полиок-сикарбонильные соединения, т. е. полиоксиальдегиды или полиок-сикетоны. При лечении наиболее широко используют глюкозу, сахар молочный и сахарозу. Сахарозу получают из сахарной свеклы или сахарного тростника; глюкозу — из крахмала путем его гидролиза; сахар молочный — из молочной сыворотки выпариванием с последующей перекристаллизацией из воды. Препараты легко растворимы в воде, трудно — в этаноле, практически не растворимы в эфире и хлороформе. Для качественного и количественного анализа углеводов используют главным образом их восстановительные свойства и физические свойства их растворов.
Подлинность глюкозы и лактозы устанавливают, нагревая до кипения растворы препаратов с реактивом Фелинга. При этом за счет восстановления меди образуется кирпично-красный (глюкоза) или желтый, переходящий в буровато-красный (лактоза), осадок. Сахароза не восстанавливает реактив Фелинга. При испытаниях к раствору сахарозы (1:2) последовательно добавляют растворы нитрата кобальта и гидроксида натрия, появляется фиолетовое окрашивание.
Количественное определение глюкозы, лактозы и сахарозы НТД не предусмотрено, но его можно провести различными методами: титрометрическим, поляриметрическим и др.
Хранят в хорошо укупоренной таре. В практике наиболее широко используют глюкозу как источник энергетического питания и деток-сикант. В лечебной практике широко используют в форме слизей крахмал, представляющий собой смесь полисахаридов.
Производные полноксикарбоновых и полиамино-поликарбо новых кислот. Производные ненасыщенных поли -окси-у-лактонов. Основной представитель группы — кислота аскорбиновая, являющаяся у-лактоном. Промышленный способ получения основан на синтезе из Д-глюкозы, которую восстанавливают в Д-сорбит каталитическим гидрированием. В небольших количествах можно получать из шиповника.
Идентифицируют фармакопейную кислоту аскорбиновую по температуре плавления, удельному вращению. Она легко растворима в воде, растворима в этаноле и практически нерастворима в эфире, бензоле, хлороформе.
Кислотные свойства препарата используют для определения подлинности. После добавления карбоната натрия в водном растворе происходит образование ионизированной формы. К полученной натриевой соли добавляют сульфат железа (II). Появляется темно-фиолетовое окрашивание, обусловленное образованием аскорбината железа, исчезающее после добавления разведенной серной кислоты.
Количественно определяют, используя в качестве титранта-окис-лителя 0,1 М раствор йодата калия в присутствии йодида калия и крахмала. Избыток йода окрашивает крахмал в синий цвет.
Хранят в хорошо укупоренной таре. Применяют при многих патологиях инфекционной и неинфекционной природы.
Препараты полиаминополикарбоновых кислот. К этой группе препаратов относят некоторые комплексообразующие соединения (комплексоны)- Комплексообразующий анион этилендиаминтетрауксус-ной кислоты (ЭДТА) входит в состав применяемых в лечебной практике динатриевой соли этилендиаминтетрауксусной кислоты и ди-натриево-калъциевой соли ЭДТА, являющейся частью тетацина кальция. Этилендиаминтетрауксусную кислоту в виде тетранатриевой соли получают путем добавления цианида натрия и формальдегида к раствору этилендиамина.
В ГФ включен раствор тетацина кальция 10%-ный для инъекций. Его получают, растворяя в воде для инъекций 100 г высушенной динатриевой соли этилендиаминтетрауксусной кислоты, 34 г кальция карбоната и 8 мл разведенной соляной кислоты (общий объем 1 л). При этом в нем должно содержаться не более 0,05 % свободных ионов кальция, а рН находиться в пределах 5,0—7,0.
Подлинность препарата устанавливают реакциями на ионы натрия, кальция и ЭДТА. Ион натрия обнаруживают по окраске бесцветного пламени горелки в желтый цвет; ион кальция — по реакции с оксалатом аммония после подщелачивания раствором аммиака. Для идентификации ЭДТА-иона к препарату добавляют раствор соли свинца и раствор йодида калия (не должно быть желтой окраски йодида свинца). Затем нейтрализуют раствором аммиака и устанавливают наличие иона кальция. Для этого используют реакцию с I оксалатом аммония в аммиачной среде (выпадает белый осадок окса-лата кальция).
Количественно тетацина кальция определяют, титруя 0,05 М раствором нитрата свинца в присутствии гексаметилентетрамина и разведенной соляной кислоты, которые выполняют роль буферного раствора. Индикатором служит ксиленоловый оранжевый.
Применяют тетацин -кальций в качестве детоксицирующего средства при отравлениях свинцом, ртутью, кобальтом, кадмием, иттрием, церием и др. Как и другие препараты этой группы он взаимодействует с ионами металлов, которые довольно быстро выводятся из организма с мочой. Вводят внутрь и внутривенно.
1.2.2.2 АРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ (АРЕНЫ)
Фенолы и их производные. Фенолы представляют собой производные ароматических углеводородов, которые содержат в молекуле (бензольное кольцо) одну или несколько гидроксильных групп (ОН). По числу этих групп различают одноатомные, двухатомные и трехатомные фенолы. В лечебной практике используют фенол чистый, тимол, резорцин. Исходный продукт синтеза фенолов — бензол.
Фенолы — бесцветные или белые кристаллические вещества. Под влиянием света и кислорода воздуха фенол и резорцин легко окисляются и приобретают розовое окрашивание. Фенол и тимол имеют характерный запах, который у резорцина выражен слабее. Фенол и резорцин хорошо, а тимол мало растворимы в воде. Отличаются друг от друга температурой плавления.
Подлинность препаратов устанавливают с помощью цветных и осадочных реакций (цветной с хлоридом железа, образования окси-азосоединений, Либермана, окисления, конденсации, нитрозирова-ния и нитрования). По ГФ для выявления фенола используют цветную реакцию с хлоридом железа: одноатомные фенолы (фенол) окрашиваются в синий или фиолетовый цвет, двухатомные (резоцин) — в синий цвет.
Для количественного определения применяют реакцию галогени-рования, в частности бромидброматометрическое определение препаратов выполняют обратным титрованием 0,1 М раствором бромата калия в присутствии бромида калия.
Хранят в хорошо укупоренной таре.
Применяют в основном в качестве антисептических средств. Фенол используют в качестве эталона при определении активности дезинфицирующих и антисептических средств (фенольный коэффициент — отношение концентрации фенола к концентрации испытуемого препарата, губительно действующего на тот или иной микроорганизм). Кроме того, фенол и крезол применяют в качестве консервантов биологических препаратов.
Производные и афтохин о на. Природные витамины группы К. К-витаминной активностью обладают несколько веществ. Они являются производными 2-метил-1,4-нафтохинона. В зависимости от химической структуры их условно делят на две группы: филлохиноны и менахиноны. Филлохинон (витамин К,) содержится главным образом в зеленых частях растений — люцерне, капусте, хвое и др. Менахиноны (витамин К2) —продукты жизнедеятельности бактерий.
Синтетическим аналогом витаминов К является викасол, который получают из р-метил нафталина (продукт производства коксохимической промышленности).
Подлинность викасола по ГФ устанавливают, обнаруживая ион натрия (по окрашиванию бесцветного пламени в желтый цвет) и оксид серы при действии концентрированной серной кислотой.
Количественное определение викасола основано на восстановлении цинковой пылью извлеченного из навески 2-метил-1,4-нафто-хинона в присутствии соляной кислоты. Полученный продукт титруют 0,1 М раствором сульфата церия с индикатором о-фенантроли-ном (зеленое окрашивание).
Хранят по списку Б в хорошо укупоренной таре. Используют как кровоостанавливающее средство при капиллярных и других кровотечениях, а также в предоперационном периоде.
Полиоксиполикарбонильные производные ароматического ряда. Антибиотики тетрацикл и нового ряда и их полусинтетические аналоги. Тетрациклины входят в группу полиоксипо-ликарбонильных соединений, основной химической структурой которых является частично гидрированный цикл тетрацена (нафтаце-на) — четыре бензольных кольца. В лечебной практике используют тетрациклин, тетрациклина гидрохлорид, окситетрациклина дигид-рат, окситетрациклина гидрохлорид, морфоциклин, метациклин, док-сициклин и другие препараты. Их получают биосинтетическим и полусинтетическим путем. В воде растворимы соли тетрациклинов.
Подлинность тетрациклинов устанавливают с помощью цветных реакций. Реактивом, позволяющим отличить тетрациклины друг от друга, является концентрированная серная кислота, под действием которой образуются ангидропроизводные. При этом производные тетрациклина окрашиваются в фиолетовый цвет, а окситетрациклина — в пурпурно-красный.
Подлинность природных препаратов по НТД и МФ подтверждают, используя метод ТСХ, а полусинтетических тетрациклинов по ИК-спектрам.
Биологическую активность тетрациклинов определяют способом диффузии в агар с тест-микробом (ГФ XI, вып. 2, с. 210).
Хранят по списку Б. Назначают при инфекционных заболеваниях, вызываемых чувствительной к антибиотикам микрофлорой.
Антибиотики полиоксикарбонилъной и хиноидной структуры (противоопухолевые препараты). Противоопухолевые антибиотики можно классифицировать на производные ауреловой кислоты, антрацикли-новые, производные хинолин-5,8-диона, актиномицины.
Первый противоопухолевый антибиотик — актиномицт был выделен Ваксманом еще в 1940 г. Противоопухолевая активность его установлена в 1952 г.
Оливомицин — производный ауреловой кислоты; представляет собой смесь натриевых солей оливомицина А и оливомицина В, различающихся структурой одного из сахарных компонентов.
Подлинность оливомицина устанавливают по образованию красного окрашивания после прибавления нескольких капель 5%-ных растворов натрия гидроксида и водорода пероксида.
Биологическую активность определяют методом диффузии в агар с тест-микробом.
Хранят по списку А.
Из антрациклиновых противоопухолевых антибиотиков в лечебной практике применяют рубомицина гидрохлорид и карминомицина гидрохлорид, из производных хинолин-5,8-диона — стрептонигрин, брунеомицин и др., а из актиномицинов — хризомалин, аурантин, дактиномицин и ряд других препаратов.
Антибиотики — анзамицины. Наибольший практический интерес из этого класса представляет группа рифамицинов, и в частности природный рифамицин. В практике используют рифампицин. Препарат мало растворим в воде и этаноле и легко в хлороформе, растворим в метаноле.
Подлинность рифампицина устанавливают по идентичности ИК-спектров 4%-ного хлороформенного раствора антибиотика и стандартного образца в области от 4000 до 700 см*1. В этих же целях используют УФ-спектрофотометрию. Активность определяют методом диффузии в агар с тест-культурой.
Применяют для лечения всех форм туберкулеза и других инфекций легких, желудочно-кишечного тракта и при гнойных патологиях.
Ароматические кислоты и их соли. Ароматические кислоты —производные ароматических углеводородов, у которых в бензольном ядре один или несколько атомов водорода замещены карбоксильными группами (—СООН). В качестве лекарственных веществ и исходных продуктов синтеза наибольшее значение имеют кислоты бензойная и салициловая (фенолокислота). Наличие ароматического ядра в молекуле усиливает кислые свойства вещества. В лечебной практике применяют также натрия бензоат и натрия салицилат.
Кислоту бензойную синтезируют, окисляя толуол различными окислителями (кислоты азотная или хромовая, калия дихромат, марганца диоксид), а кислоту салициловую получают карбоксилирова-нием фенола по реакции Кольбе—Шмидта (механизм реакции заключается во внедрении диоксида углерода в бензольное ядро). Натрия бензоат и натрия салицилат получают, выпаривая досуха раствор соответствующей кислоты.
Кислоты мало растворимы в воде (в кипящей воде растворимы), легко — в этаноле и эфире. Кислота салициловая умеренно растворима в хлороформе. Соли кислот легко растворимы в воде, натрия салицилат растворим, а бензоат натрия умеренно растворим в этаноле.
Идентифицировать кислоту бензойную можно, превращая ее в кислоту салициловую, путем нагревания раствора кислоты бензойной с избытком карбоната натрия и последующей фильтрации. К фильтрату добавляют 0,3%-ный раствор пероксида водорода и 1%-ный раствор железоаммониевых квасцов. После нагревания в течение 5 мин на кипящей водяной бане появляется фиолетовое окрашивание. Для испытания подлинности кислоты салициловой и натрия салицилата используют раствор хлорида железа (III). При рН 2—3 образуется окрашенный в красный цвет моносалицилат железа (III), при рН 3—8 — красного цвета дисалицилат, а при рН 8—10 — желтого цвета трисалицилат (рН раствора зависит от соотношения препарата и реактива). Кроме того, подлинность натрия бензоата и натрия салицилата устанавливают по иону натрия (окраска бесцветного пламени горелки в желтый цвет) и по выделению соответствующих кислот после нейтрализации растворов препаратов разведенной азотной кислотой.
Количественное определение бензойной и салициловой кислот по ГФ основано на использовании метода нейтрализации. Препараты растворяют в этаноле и титруют (индикатор — фенолфталеин). Натрия бензоат и натрия салицилат количественно определяют методом нейтрализации титрованным раствором соляной кислоты, используя смешанный индикатор (смесь равных количеств метилового оранжевого и метиленового синего).
Хранят в хорошо укупоренной таре. Кислоты используют как антисептические средства (салициловая кислота проявляет еще противовоспалительное и анальгетическое действие), натрия бензоат назначают как отхаркивающее средство, а натрия салицилат проявляет противоревматическое, противовоспалительное, анальгетическое и жаропонижающее действие.
Производные фенолокислот.К этой группе относят препараты сложных эфиров салициловой кислоты и производные амида салициловой кислоты.
Препараты сложных эфиров салициловой кислоты. В ГФ включены три препарата из сложных эфиров салициловой кислоты: кислота ацетилсалициловая, метилсалицилат и фенилсалицилат. Для их получения используют общие способы синтеза сложных эфиров. Промышленный способ получения кислоты ацетилсалициловой основан на нагревании смеси салициловой кислоты, уксусного ангидрида и концентрированной серной кислоты. Сложные эфиры — метилсалицилат и фенилсалицилат образуются при взаимодействии карбоксильной группы салициловой кислоты с метиловым спиртом и фенолом. Метилсалицилат получают нагреванием смеси салициловой кислоты с избытком метанола в присутствии концентрированной серной кислоты. Фенилсалицилат получают, нагревая смесь са-лицилата натрия, фенолята натрия и трихлороксида фосфора (V).
Кислота ацетилсалициловая и фенилсалицилат — твердые кристаллические вещества, метилсалицилат — жидкость с характерным запахом. Препараты фактически не растворимы или мало растворимы в воде, но легко или растворимы в растворах гидроксидов щелочных металлов, этаноле и других органических растворителях.
Подлинность устанавливают реакцией гидролиза в кислой или щелочной среде с последующей идентификацией продуктов гидролиза (салициловая кислота, фенол).
Количественное определение всех трех препаратов проводят с помощью реакций щелочного гидролиза (нагревание с гидроксидом натрия и титрация с фенолфталеином).
Препарат хранят в хорошо укупоренной таре. Назначают, используя их фармакологические качества: противовоспалительное, обезболивающее и жаропонижающее. Выраженными вышеперечисленными свойствами обладает комплексный препарат ацелизин — смесь D, L-лизина ацетилсалицилата и глицина (9:1), который обладает антитромбическим действием (как и ацетилсалициловая кислота в сублечебных дозах).
Препараты, производные амида салициловой кислоты. К данной группе относятся салициламид, оксафенамид, фенасал. Исходные продукты их синтеза — сложные эфиры салициловой кислоты (метилсалицилат, фенилсалицилат).
Подлинность устанавливают с помощью общей реакции на фенольный гидроксил, действуя раствором хлорида железа (III), учитывая их растворимость (салициламид — водный раствор, оксафена-мид и фенасал — спиртовые растворы). Салициламид и оксафенамид приобретают красно-фиолетовое окрашивание, фенасал выпадает в желтый осадок.
Количественное определение двух препаратов проводят, устанавливая содержание образующегося при щелочном гидролизе аммиака (салициламид) или определяя содержание азота (оксафенамид). Фенасал определяют по содержанию органически связанного хлора методом титрования. Кроме того, для количественного определения всех трех препаратов может быть использован спектрофотометрический метод (оптимальный растворитель — 0,1 М раствор гидроксида натрия).
Хранят в хорошо укупоренной таре (фенасал по списку Б). Фенасал используют как антигельминтик, оксафенамид в качестве желчегонного средства, а салициамид в тех же случаях, что и ацетилсалициловую кислоту.
Ацетаминопроизводные ароматического ряда.По химической структуре и фармакологическим свойствам препараты этого ряда можно разделить на производные л-аминофенола и диал-киламиноацетанилида. Первые обладают жаропонижающим и болеутоляющим, а вторые — местноанестезирующим действием.
Производные л-аминофенола. Эти препараты в основе своей химической структуры содержат молекулу анилина. В лечебной практике используют фенацетин и парацетамол. Препараты представляют собой кристаллические вещества, мало растворимые в воде (парацетамол растворим несколько лучше), растворимы в этаноле. Фенацетин мало растворим, а парацетамол практически не растворим в эфире и хлороформе.
Оба препарата образуют окрашенные соединения с раствором дихромата калия и разведенной соляной кислоты. Появляется неизменяющееся фиолетовое окрашивание (парацетамол) или фиолетовое окрашивание, переходящее в вишнево-красное (фенацетин). Кроме того, подлинность парацетамола подтверждают по УФ-спектру.
Для количественного определения парацетамола используют нит-ритометрический метод (по продукту кислотного гидролиза — я-ами-нофенолу). Фенацетин количественно определить трудно, поэтому ограничиваются испытанием на подлинность и чистоту, обнаруживая допустимое содержание примеси ацетанилида, и-хлорацетанили-да и л-фенетидина.
Хранят в хорошо укупоренной таре по списку Б. Применяют в качестве жаропонижающих и болеутоляющих средств (фенацетин более токсичен).
Производные диалкиламиноацетанилида. В анестезиологии применяют тримекаин и лидокаин (ксикаин). Представляют собой белые или с желтоватым оттенком порошки, легко растворимые в воде, этаноле и хлороформе.
Подлинность устанавливают по ИК-спектру, снятому в вазелиновом масле. Он должен лежать в области от 4000 до 700 см"1, иметь те же полосы поглощения, что и спектр стандартного образца. Кроме того, подлинность тримекаина подтверждают цветной реакцией с раствором ацетата меди (зеленое окрашивание). Лидокаин переводят в основание, растворяют в этаноле и испытывают на подлинность с помощью цветной реакции с раствором хлорида кобальта (синевато-зеленый осадок).
Количественно препараты определяют методом неводного титрования, используя в качестве растворителя смесь муравьиной кислоты и уксусного ангидрида (1:20). Титрантом служит 0,1 М раствор хлорной кислоты, индикатором — кристаллический фиолетовый или судан (III).
Хранят в хорошо укупоренной таре по списку Б. Используют в качестве анестетиков для всех видов анестезии. Кроме того, они обладают антиаритмическим действием.
Аминокислоты ароматического ряда и их производные. Производные л-аминобензойной кислоты. Сложные эфиры л-аминобензойной кислоты — анестезин, новокаин, дикаин — применяют как анестетики, а новокаинамид — в качестве антиаритмического средства.
Исходным продуктом всех этих препаратов служит л-нитробен-зойная кислота. При производстве анестезина используют метод, основанный на ацилировании этанола с помощью л-нитробензойной кислоты с последующим восстановлением полученного этилового эфира л-нитробензойной кислоты до анестезина. Способ получения новокаина основан на переэтерификации анестезина Э-диэтилами-ноэтанолом в присутствии алкоголята натрия.
Препараты представляют собой белые или бесцветные кристаллические вещества без запаха, легко, за исключением анестезина, растворимы в воде, все легко растворимы в этаноле.
Идентификацию производных л-аминобензойной кислоты можно провести с помощью общих реакций на первичные ароматические амиды. Анестезин открывают реакцией омыления в растворе гидроксида щелочного металла (например, натрия). Подлинность новокаина устанавливают реакцией с пергидролем и концентрированной серной кислотой — появляется сиреневое окрашивание. Новока-инамид открывают цветной реакцией с гексацианоферратом (II) калия. В присутствии соляной кислоты после нагревания образуется светло-зеленый осадок. Дикаин при взаимодействии с йодатом калия в фосфорнокислой среде при нагревании образует фиолетового цвета продукт.
Для количественного определения производных л-аминобензойной кислоты ГФ рекомендует нитритометрический метод. При этом происходит образование солей диазония. Имеются и другие методы, например спектрометрический, неводного титрования, броматомет-рический и др.
Хранят в хорошо укупоренной таре, дикаин по списку А, остальные по списку Б. Используют как анестетики, за исключением но-вокаинамида (антиаритмическое средство).
Производные о-аминобензойной (антраниловой) кислоты. К числу этих соединений относится кислота мефенаминовая и мефенамина натриевая соль. Первая практически не растворима в воде, мало растворима в этаноле, ацетоне и хлороформе, растворима в диметилформамиде. Соль легко растворима в воде, растворима в этаноле и дает положительную реакцию на ион натрия.
Подлинность препаратов подтверждают по характеру УФ-спектров растворов в смеси этанола и 1 М раствора соляной кислоты (99:1). Максимумы светопоглощения у обоих препаратов должны быть в области 279 и 350 нм.
Количественное определение выполняют методом нейтрализации, титруя раствор кислоты мефенаминовой в диметилформамиде 0,1 М. раствором гидроксида натрия и смеси метанола и бензола до синего окрашивания (индикатор — тимоловый синий). Натриевую соль кислоты мефенаминовой количественно определяют гравиметрическим методом. Можно использовать и потенциометрию.
Хранят по списку Б в сухом, защищенном от света месте. Назначают в качестве анальгезирующих, противовоспалительных и жаропонижающих средств.
Из других лекарственных средств, содержащих в молекуле остаток дифениламина (как кислота мефенаминовая), следует отметить ортофен (вольтарен), обладающий выраженным анальгетическим, противовоспалительным, антиревматическим и жаропонижающим действием.
Производные n-аминосалициловой кислоты. и-Аминосалициловая кислота (ПАСК) и ее производные обладают бактериостатической активностью в отношении микобактерий туберкулеза.
В ГФ включены два производных ПАСК: натрия парааминосалицилат и бепаск, исходным продуктом синтеза которых может служить .«-нитрофенол. Представляют собой белые порошки, иногда с желтым, розовым или кремовым оттенком. Натриевая соль ПАСК легко растворима в воде, а бепаск, являющийся кальциевой солью, практически нерастворим. В этаноле препараты трудно растворимы.
При установлении подлинности препаратов обнаруживают наличие иона натрия у натрия /ш/ш-аминосалицилата и иона кальция у бепаска (после предварительного нагревания препарата в разведенной соляной кислоте). Присутствие в молекулах препаратов феноль-ных гидроксилов позволяет применять для их идентификации реакции на фенолы.
Для количественного определения натрия иорд-аминосалицилата ГФ рекомендует нитритометрию с внешним индикатором (йодкрах-мальной бумагой). Определение можно также выполнить бромато-метрическим и йодхлорометрическим методами подобно определению п-аминобензойной кислоты. Имеются и другие способы. Бепаск количественно определяют по иону кальция трилонометрическим методом. Препарат предварительно сжигают и прокаливают в муфеле.
Хранят в хорошо укупоренной таре. Используют в качестве противотуберкулезных средств.
Амидированные производные сульфокислот. Для синтеза амидированных производных сульфокислот (а также сульфаниламидов) используют общий принцип, основанный на взаимодействии ароматических углеводородов с хлорангидридом серной кислоты. Полученное производное амида бензолсульфокислоты — промежуточный продукт синтеза всех амидированных производных сульфокислот.
Препараты хлорпроизводных амидов сульфокислот. К данной группе относятся моно- и дихлорзамещенные препараты амидов сульфокислот: хлорамин Б и дихлорамин Б. Они обладают способностью легко отщеплять атомы «активного хлора», который проявляет окислительные свойства. Буквенные обозначения указывают на то, что для их получения используют бензол. Различают их по содержанию активного хлора.
В практике используют хлорамин Б и пантоцид (производное ди-хлорамина Б). Для их синтеза используют общий принцип, основанный на получении амида бензолсульфокислоты, который затем хлорируют с помощью гипохлорита натрия.
Хлорамин Б растворим в воде, очень мало — в эфире и хлороформе. Пантоцид очень мало растворим в воде и разделенных кислотах, но легко в растворах щелочей ввиду наличия в молекуле карбоксильной группы.
При испытании на подлинность используют способность растворов препаратов изменять окраску индикаторов, а затем постепенно обесцвечивать их. Водный раствор хлорамина Б окрашивает красную лакмусовую бумагу в синий цвет (ввиду образования щелочи при гидролизе). Пантоцид окрашивает в красный цвет щелочной раствор метилового красного (за счет кислой реакции раствора препарата).
Наличие активного хлора в препаратах устанавливают по реакции с йодидом калия в присутствии хлороформа, слой которого окрашивается в фиолетовый цвет. На этой же реакции основано количественное определение препаратов йодометрическим методом. Выделившийся йод титруют тиосульфатом натрия.
Хлорамин Б должен содержать 25-29%, а пантоцид не менее 50 % активного хлора.
Хранят в хорошо укупоренной таре. Используют в качестве антисептиков и дезинфицирующих средств (хлорамин Б).
Производные алкилуреидов сульфокислот. Из многочисленных производных алкилуреидов сульфокислот используют: бутамид, хлор-пропамид, букарбан, глибенкламид.
Подлинность препаратов можно установить методом спектрофо-тометрии в УФ-области по расположению максимумов поглощения или по удельному показателю поглощения. Так, 0,001%-ный раствор бутамида в 0,01 М растворе гидроксида натрия имеет максимум поглощения при 227 нм. Удельный показатель поглощения в этой области должен быть от 405 до 435.
Количественное определение бутамида, хлорпропамида и глибен-кламида выполняют методом кислотно-основного титрования, используя кислые свойства препаратов, обусловленные наличием сульфамидной группы. Количественное определение букарбана проводят по функциональной группе (первичная ароматическая группа) нит-ритометрическим методом, устанавливая точку эквивалентности с помощью потенциометра.
Хранят по списку Б в сухом, защищенном от света месте. Применяют в качестве противодиабетических средств, стимулирующих р-клетки поджелудочной железы.
Производные амидов сульфаниловой кислоты.Сульфаниламиды являются производными л-амидобензолсульфамида (амида сульфаниловой кислоты). Их классифицируют по характеру радикалов. Первый амид сульфаниловой кислоты был синтезирован в 1908 г. (Гельмо), но только в 1935 г. Домагк установил антимикробные свойства пронтозила (красителя, полученного из амида сульфаниловой кислоты). Сульфаниламиды обладают не только структурным, но и геометрическим сходством с л-аминобензойной кислотой.
Синтез сульфаниламидных препаратов осуществляют по обшей схеме получения амидов сульфокислот. Исходные продукты синтеза должны содержать ацилированную первичную ароматическую аминогруппу. Это позволяет предохранить ее от изменений в процессе синтеза. На последнем этапе синтеза ацилированный амин гидроли-зуют, получая первичный амин. Наиболее рациональным и экономичным является синтез сульфаниламидных препаратов из ЛГ-карбо-метоксисульфанилхлорида (фенилуретилансульфохлорида), который получают действием избытка хлорсульфоновой кислоты на iV-фе-нилметилуретан. При последующем синтезе сульфаниламидов действуют аммиаком (при получении стрептоцида) либо замещают атом хлора алифатическим или гетероциклическим амином, после чего уретановую группировку подвергают гидролизу. Так получают большинство сульфаниламидов.
Сульфаниламиды — белые или белые с желтоватым оттенком кристаллические вещества без запаха. Исключения: сульфапиридазин (желтая окраска), салазопиридазин (оранжевый цвет), салазодиме-токсин (буровато-оранжевый порошок). Они мало или практически нерастворимы в воде, этаноле, эфире, хлороформе. Некоторые из них растворимы в ацетоне, а уросульфан — легко растворим. Натриевые соли (сульфацил-натрий, норсульфазол-натрий, сульфапири-дазин-натрий и др.) легко растворимы в воде и практически не растворимы в органических растворителях. Кислотные свойства у сульфаниламидов выражены сильнее, чем основные за счет наличия в молекуле группы —SO2—NH-—, содержащей подвижный атом водорода, благодаря чему они образуют с щелочами соли. Поэтому почти все сульфаниламиды растворяются в растворах щелочей (исключение сульгин) с образованием натриевых солей.
Для испытаний на подлинность используют общие и частные реакции, обусловленные наличием тех или иных функциональных групп в молекулах препаратов. Например, образование азокрасителя является общей реакцией не только на сульфаниламиды, но и на все соединения, содержащие в молекуле незамещенную первичную ароматическую аминогруппу. Химизм реакции основан на образовании хлорида диазония в результате действия раствором нитрата натрия и разведенной соляной кислотой. Последующее сочетание хлорида диазония с фенолами приводит к образованию азокрасителя. ГФ рекомендует для выполнения этой реакции щелочной раствор р-нафтола (появляется вишнево-красное окрашивание или образуется осадок оранжево-красного цвета). Кроме того, в этих целях можно использовать реакции конденсации, галогенирования, обнаружения серы, лигниновую пробу, пиролиз сульфаниламидных препаратов, реакцию с растворами солей тяжелых металлов, реакции с нитропруссидом, окисления, а также ряд частных реакций — образования аммиака при пиролизе уросульфана и сульгина, сероводорода при пиролизе норсульфазола и его натриевой соли, обнаружение (по запаху) уксусной кислоты при гидролизе сульфацил-натрия, выделение при гидролизе фталазола и фтазина фталевой кислоты, которую затем идентифицируют по реакции образования флуоресцеина. Некоторые 13 этих реакций используют и для количественного определения.
При испытании на чистоту определяют отсутствие или предель-юе содержание допустимых количеств органических примесей, сульфатов, хлоридов, тяжелых металлов, контролируют кислотность (или (елочность), цветность растворов. Для некоторых сульфаниламидов ^Ф рекомендует дополнительные тесты.
Для количественного определения применяют ряд методов, из соторых ГФ рекомендует нитритометрию для препаратов, являю-дохся производными первичных ароматических аминов. Определение основано на способности первичных ароматических аминов образовывать в кислой среде диазосоединения. В качестве титранта используют нитрит натрия (0,1 М раствор). Метод нейтрализации также можно использовать для количественного определения суль-)аниламидов и их солей. Он основан на способности сульфаниламидов образовывать с щелочами соли. Метод броматометрии осно-на реакции галогенирования сульфаниламидов. Титруют раство->ами бромата калия в кислой среде в присутствии бромида. Конец прования устанавливают либо по обесцвечиванию (бромом) индикатоpa метилового оранжевого, либо йодометрически.
На подобной реакции основан и метод йодохлорометрии. Йодирование осуществляют с помощью титрованного хлористоводородного раствора хлорида йода, избыток которого устанавливают йодометрически. Метод аргентометрии может быть применен для количественного определения препаратов, образующих серебряные соли, например норсульфазола (индикатор — хромат калия). Реакцию проводят в присутствии буры (для снижения концентрации водородных ионов). Метод окисления и определения по сульфат-иону основан на реакции озоления сульфаниламидов при осторожном нагревании с не содержащими примеси сульфатов 30%-ным раствором перокси-да водорода в присутствии следов хлорида железа (III). Получается светлая, совершенно прозрачная жидкость, содержащая эквивалентное препарату количество сульфат-ионов, которые определяют либо гравиметрическим, либо титрическим методом, используя в обоих случаях раствор хлорида бария.
Для идентификации и количественного определения сульфаниламидов используют физико-химические методы. В НТД включены методы идентификации сульфаниламидов по УФ-спектрам поглощения с использованием растворов гидроксида натрия и соляной кислоты, устанавливая максимумы и минимумы поглощения. В этих целях можно использовать и ИК-спектроскопию с растворителем диметилсульфоксидом. Весьма информативной является спектроскопия ПМВ для сульфаниламидов, имеющих гетероциклическую и ароматическую структуру. Для сульфаниламидов, имеющих в молекуле первичную ароматическую аминогруппу, приемлем потенциометри-ческий метод. Титрантом служит 0,1 М раствор сульфата церия (IV) в присутствии серной кислоты (рН 1,5). Эквивалентный объем тит-ранта находят графически по способу тангенсов; титруют с каломельным и платиновым электродами. Количественное определение препаратов, являющихся азосоединениями (салазопиридазин и салазодиметоксин), можно выполнить полярографическим методом. По-лярографируют растворы в диметилформамиде, снимая полярограмму в токе азота в интервале 0,2—0,4 В относительно насыщенного каломельного электрода. Расчет ведут по калибровочному графику.
Все сульфаниламиды хранят по списку Б в хорошо укупоренной таре (стеклянных банках с притертыми крышками). При хранении препаратов происходит их разложение под действием света и кислорода воздуха.
Назначают в качестве химиотерапевтических средств при бактериальных инфекциях, вызываемых чувствительными к сульфаниламидам микроорганизмами.
Ари л а л к и л а мины и их произвол н ые. Алкалоиды, производные фенил ал кил аминов. К производным алкиламинов относятся как природные БАВ (алкалоиды, гормоны, антибиотики), так и их синтетические аналоги. Из алкалоидов фен ил ал килам инн ой природы лечебное значение имеют эфедрин (содержится в забайкальской эфедре) и дэфедрин, содержащийся в эфедре хвощовой (горной).
Эфедрина гидрохлорид и дэфедрин (фармакопейные препараты) — белые или бесцветные кристаллические вещества, легко растворимые в воде, умеренно (эфедрина гидрохлорид) и легко (дэфедрин) — в этаноле и практически не растворимые в эфире. Отличаются по температуре плавления. Дают положительную реакцию на хлориды.
Обнаружить основание эфедрина можно с помощью двух испытаний (по ГФ). Одно заключается в разрушении препарата до образования бензальдегида при нагревании гексацианоферратом (III) калия. Бензальдегид имеет запах горького миндаля. Другой способ основан на образовании соединения синего цвета при взаимодействии препарата с раствором сульфата меди. При взбалтывании реакционной смеси с эфиром последний приобретает фиолетово-красный цвет, а водный слой сохраняет синее окрашивание. Этой же реакцией можно установить подлинность дэфедрина, у которого в тех же условиях появляется сине-фиолетовое окрашивание. Кроме того, подлинность обоих препаратов можно определить спектрофо-тометрическим методом.
НТД рекомендует определение препаратов в неводной среде, которое основано на использовании в качестве растворителей муравьиной кислоты и уксусного ангидрида. Титрантом служит хлорная кислота. Количественное определение препаратов можно также выполнить методом нейтрализации (по связанной соляной кислотой) или аргентометрически (по хлорид-иону). Для количественного определения эфедрина гидрохлорида в лекарственных формах используют УФ-спектрометрию или фотоколориметрию.
Хранят препараты по списку Б в хорошо укупоренной таре. Применяют в качестве адреномиметических средств.
Гормоны надпочечников, производные фепилалкиламинов и их синтетические аналоги. Мозговой слой надпочечников вырабатывает гормон адреналин, а корковый — около 40 различных гормонов, известных под названием кортикостероиды. Получают эти препараты из надпочечников скота. Применяют адреналина гидротартрат, норад-реналина гидротартрат и их синтетические аналоги ~ мезатон и изадрин.
Препараты представляют собой белые кристаллические вещества. Иногда с сероватым или желтоватым оттенком. Легко растворимы в воде и практически нерастворимы в эфире. В этаноле адреналина и норадреналина тартраты мало растворимы, изадрин умеренно, а ме-затон легко растворим.
Имеется много цветных реакций на адреналин и его аналоги. НТД рекомендует общую цветную реакцию с раствором хлорида железа (III). Адреналин, норадреналин, изадрин образуют с этим реактивом изумрудно-зеленое окрашивание, переходящее от капли раствора аммиака в вишнево-красное, а затем в оранжево-красное. Раствор мезатона приобретает фиолетовый цвет.
Основное испытание на чистоту — обнаружение допустимых пределов примесей промежуточных продуктов синтеза. В адреналине обнаруживают адреналон, а в норадреналине — норадреналон, используя различия в УФ-спектрах поглощения этих веществ.
Количественное определение адреналина и норадреналина гидро-тартратов по ГФ выполняют методом неводного титрования в среде ледяной уксусной кислоты, титруя 0,1 М раствором хлорной кислоты (индикатор — метиловый фиолетовый или кристаллический фиолетовый). Мезатон определяют броматометрическим методом. Изадрин, а также мезатон количественно определяют методом неводного титрования, но в присутствии ацетата ртути (II) с индикатором кристаллическим фиолетовым.
Препараты хранят по списку Б в хорошо укупоренной таре из оранжевого стекла. К инъекционным растворам адреналина и норадреналина для стабилизации добавляют 0,1 % натрия метабисульфита (пентаоксодисульфата натрия), обладающего восстановительными свойствами. Применяют препараты в качестве адреномиметических средств.
Производные окси фенил алифатических аминокислот. Эта группа веществ, относящихся к катехоламинам, очень сходна с адреналином и норадреналином. В качестве лекарственных веществ используют леводопу и метилдопу. Леводопа растворима в воде (1:300) и мало в этаноле, вторая — мало растворима в воде и этаноле. Отличить препараты друг от друга можно по величине удельного оптического вращения. Подлинность препаратов можно подтвердить ИК-спект-ром с соответствующим стандартным образцом или спектром сравнения. Количественно определяют методом неводного титрования, используя в качестве растворителя смесь ледяной уксусной кислоты и диоксана.
Хранят препараты по списку Б в хорошо укупоренной таре. Используют в медицине. Леводопу применяют при болезни Паркинсо-на, а метилдопу — в качестве гипотензивного средства.
Антибиотики, производные нитрофенилалкиламинов. К этой группе соединений относят хаорамфеникол, или левомщетин (отечественное название), — производное нитробензола, который был первым синтезирован в промышленном масштабе. В лечебной практике используют левомицетин, левомицетина стеарат, левомицетина сукцинат (растворимый). Это — белые с желтовато-зеленым оттенком кристаллические вещества без запаха. Левомицетина стеарат отличается от левомицетина отсутствием горького вкуса. Подлинность препарата можно установить по удельному вращению растворов.
Левомицетин мало растворим в воде, эфире, хлороформе, легко — в этаноле, в котором его эфиры трудно растворимы. Левомицетина сукцинат практически не растворим в хлороформе, а левомицетина стеарат — легко (растворы мутные).
Для качественного и количественного определения препаратов используют спектрофотометрию в УФ-области. По ГФ подлинность левомицетина устанавливают по удельному показателю поглощения 0,002%-ного водного раствора при длине волны 278 нм. Левомицетина стеарат определяют эти же методом в спиртовых растворах при длине волны 272 нм; препарат должен содержать 51—55% левомицетина. Левомицетина сукцинат определяют этим же методом, измеряя оптическую плотность 0,002%-ного раствора при длине волны 275 нм. Содержание левомицетина в препарате должно быть не менее 67 %. Кроме того, количественное определение левомицетина по ГФ выполняют нитритометрическим методом после предварительного восстановления в кислой среде цинковой пылью. В этих целях можно использовать и броматометрический метод с предварительным гидрированием нитрогруппы в аминогруппу с помощью цинковой пыли и соляной кислоты при нагревании на кипящей водяной бане.
Препараты хранят по списку Б в хорошо укупоренной таре. Назначают при инфекционных заболеваниях, вызываемых чувствительной к препаратам микрофлорой. Левомицетина сукцинат, кроме орального применения, вводят внутримышечно, подкожно и внутривенно.
Производные арилоксипронаноламинов. Представитель этой группы анаприлин растворим в воде и этаноле, мало — в хлороформе, практически не растворим в эфире. Растворы в воде дают опалес-ценцию, исчезающую при подкислении 2—3 каплями минеральной кислоты.
Подлинность анаприлина подтверждают путем сравнения ИК-спектра со спектром стандартного образца. Спектр поглощения раствора препарата в метаноле (20 мкг/мл) имеет в УФ-области максимум при 209, 306 и 319 нм.
Количественное определение проводят при помощи неводного титрования в среде ледяной уксусной кислоты раствора ацетата ртути в том же растворителе. Титрантом служит 0,1 М раствор хлорной кислоты, индикатором — кристаллический фиолетовый.
Хранят препарат по списку Б в хорошо укупоренной таре.
Используют как антиаритмическое средство, а также при стенокардии и гипертонии.
Йодированные производные арилалифатических и ароматических аминокислот. К этой группе относится гормон тироксин, выделенный из щитовидной железы животных. Фармакопейный препарат тиреоидин получают измельчением обезжиренных и высушенных щитовидных желез убойного скота. Препарат содержит в основном гормоны 1-тироксини 1-3,5,3'-трийодтиронин (активнее в 3-5 раз).
Для установления подлинности тиреоидин по ФС сжигают в колбе с кислородом и в качестве поглощающей смеси используют раствор крахмала, содержащего 0,2 % сульфаминовой кислоты. Затем содержимое колбы охлаждают (энергично встряхивая); поглощающийся слой окрашивается в синий цвет.
Из примесей определяют жир (не более 2 %) и йодиды. Содержание йода определяют, как и при испытании подлинности, — методом сжигания в кислороде (ГФ XI, вып. 1, с. 181). Препарат должен содержать 0,17—0,23% органически связанного йода.
Препарат хранят по списку Б в хорошо укупоренных банках темного стекла.
Используют для лечения гипофункции щитовидной железы.
1.2.2.3 АЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ (ЦИКЛОАЛКАНЫ)
Терпены. Это — углеводороды и их кислородсодержащие производные, входящие в состав эфирных масел и смол хвойных растений. Общая суммарная формула всех терпенов является кратной от С5Н8, т. е. (CsH8)n. Они имеют ациклическую и циклическую структуру, которые могут, в свою очередь, иметь моно- и бициклы. В лечебной практике используют моноциклические и бициклические терпены (так классифицируют лекарственные вещества этого класса).
Препараты моноциклических терпенов. К данной группе препаратов относятся ментол, валидол и терпингидрат, которые по химическому строению представляют производные гидроароматического углеводорода — ментана.
Ментол получают из мятного масла и синтетически. Валидол — это 25%-ный раствор ментола в метиловом эфире изовалериановой кислоты. Терпингидрат получают из скипидара, основным компонентом которого является пинен.
Ментол и терпингидрат — бесцветные кристаллические вещества, валидол — жидкость. Ментол и терпингидрат мало растворимы в воде, валидол — не растворим. В этаноле ментол и валидол легко растворимы, терпингидрат растворим. В отличие от терпин-гидрата ментол легко растворим в эфире, жирных маслах, вазелиновом масле.
Для идентификации ментола и валидола НТД рекомендует цветную реакцию с концентрированной серной кислотой в присутствии ванилина. Появляется желтое окрашивание, которое при добавлении воды переходит вмалиново-красное. Терпингидрат при добавлении концентрированной серной кислоты образует мутный осадок и приобретает характерный запах. Он может образовывать окрашенные продукты после выпаривания его смеси со спиртовым раствором хлорида железа (III). При растворении остатка в бензоле он окрашивается в синий цвет.
Количественное определение ментола основано на ацетилирова-нии уксусным ангидридом в среде безводного пиридина (при нагревании с обратным холодильником). Избыток уксусного ангидрида разлагают водой до уксусной кислоты и титруют ее 0,5 М раствором гидроксида натрия (индикатор — фенолфталеин).
В валидоле количественно определяют содержание метилового эфира изовалериановой кислоты, омыляя его 1 М спиртовым раствором гидроксида калия (кипятят 5 ч с обратным холодильником). Избыток гидроксида калия оттитровывают 0,5 М раствором соляной кислоты (индикатор фенолфталеин). Для определения терпингидра-та в таблетках рекомендован гравиметрический метод, основанный на извлечении его этанолом, удалении последнего при нагревании на водяной бане, высушивании остатка до постоянной массы в эксикаторе и взвешивании.
Препараты хранят в хорошо укупоренной таре при температуре не выше 15 "С.
Ментол применяют наружно и внутрь при воспалении верхних дыхательных путей, терпингидрат — как отхаркивающее, а валидол — как спазмолитическое средство.
Препараты бициклических терпенов. Природный бициклический терпен — камфору и ее производные — бромкамфору и кислоту сулъ-фокамфорную применяют в лечебной практике. Вещества представляют собой производные углеводорода камфана (борнилана). Камфора — кетопроизводное камфана. Ввиду наличия в молекуле двух асимметрических атомов углерода существует ^/-камфора (правовращающийся изомер), /-камфора (левовращающийся изомер) и рацемическая камфора. Природную ^/-камфору получают из камфорного дерева, произрастающего в Японии и Китае (в основном на Тайване), путем отгонки водяным паром из измельченной древесины. Затем подвергают очистке возгонкой и отжимают на прессах. Синтетическую /-камфору получают из пихтового масла, а рацемическую — из пинена, содержащегося в скипидаре. Бромкамфору получают действием брома на камфору.
Камфора почти нерастворима, а бромкамфора мало растворима в воде, обе легко растворимы в этаноле, эфире, хлороформе, жирных маслах. Кислота сульфокамфорная легко растворима в воде и этаноле, но мало — в эфире.
Для идентификации препаратов применяют реакции образования оксимов, фенилгидразонов, семикарбазонов благодаря наличию ке-тогруппы. Подлинность камфоры можно подтвердить по температурам плавления производных: я-нитрофенилгидразона (244 °С), 2,4-динитрофенилгидразона (162 °С), оксима (129 °С), семикарбазона (236 °С). Имеются способы идентификации спиртовых растворов камфоры и бромкамфоры методом УФ-спектрометрии, Камфора имеет максимум светопоглощения при 290 нм с незначительным удельным показателем поглощения (около 2), бромкамфора — при 306 нм (удельный показатель поглощения 4,34). Испытание на подлинность и количественное определение бромкамфоры основано на отщеплении атома брома от органической части молекулы. Подлинность кислоты сульфокамфорной подтверждают наличие сульфо- и кетогрупп. Испытание на подлинность и количественное определение камфоры рацемической для инъекций по ФС выполняют методом ГЖХ. Кроме того, для количественного определения используют метод нейтрализации в водной среде (индикатор фенолфталеин). Способ количественного определения камфоры основан на ее взаимодействии с определенным количеством гидроксиламина.
Препараты хранят в хорошо укупоренных банках в прохладном месте (учитывая их летучесть). Применяют в качестве стимуляторов ЦНС (аналептики) и кардиотонических средств.
Производные циклогексана. Циклогексенилизопреноидные витамины (ретинолы). Содержат триметилциклогексеновый цикл, связанный с тетраенольной цепью, которая имеет спиртовую или альдегидную группы. Основной представитель — ретинол (аксерофтол, витамин А). Природный ретинол — транс-изомер; известны также ^нс-изомеры, обладающие А-витаминной активностью.
Основной источник получения витаминов комплекса А - печень рыб, которую после измельчения обрабатывают 25%-ным раствором натрия гидроксида при 82—85 "С и рН 9,0—10,0. В результате гидролиза разрушается связь ретинола с белками и он извлекается печеночным жиром. Полученный концентрат очищают хроматографи-ческим методом, и извлекают ретинол дихлорэтаном. Растворитель отгоняют, а ретинол подвергают перекристаллизации. В ГФ включен препарат ретинола ацетат, который практически не растворим в воде, растворим в органических растворителях и жидких маслах. Это — белые или бледно-желтые кристаллы с температурой плавления 53-57 "С.
Подлинность ретинола ацетата устанавливают цветной реакцией с хлоридом сурьмы (III) в хлороформном растворе. Образуется межмолекулярный комплекс, окрашенный в интенсивно-синий цвет с максимумом светопоглощения в области 620 нм. С помощью этой реакции проводят и его количественное определение спектрофото-метрическим или фотоколориметрическим методом в абсолютном спирте.
Препарат хранят в запаянных ампулах, в темном месте, при температуре не выше 5 °С (ввиду легкой окисляемости). Растворы ретинола в масле хранят по списку Б в заполненных доверху, хорошо укупоренных склянках оранжевого цвета, при температуре не выше 10 "С. Применяют при гипо- и авитаминозах.
Циклогексанолэтиленгидриндановые витамины (кальциферолы). Имеется несколько витаминов группы D: D3, D3, D4, Ds, D6, D7. Природные витамины D2 и D3, как и ретинолы, содержатся в печени и жировой ткани рыб и в небольшом количестве в яичном желтке, икре, сливочном масле, молоке.
Провитамином эргокальциферола служит эргостерин, который получают экстракцией из дрожжей. При УФ-облучении эргостерина получают ряд препаратов, в т. ч. эргокальциферол. В лечебной практике получают производные эргокальциферолов: эргокальциферол, дигидротахистерол, оксидевит.
Эти препараты практически нерастворимы в воде, легко растворимы или растворимы (дигидротахистерол) в этаноле. Трудно и медленно (эргокальциферол умеренно) — в растительных маслах.
Испытание на подлинность препаратов по МФ и ФС выполняют, измеряя спектр УФ-поглощения этанольных растворов в области 240— 280 нм. Эргокальциферол и оксидевит имеют максимумы поглощения при 265 нм, а дигидротахистерол — при 242,5; 251 и 260,5 нм. УФ-спектрофотометрию используют для количественного определения эргокальциферола и оксидевита (при 265 нм), дигидротахистерола (251 нм). Растворитель — этанол. Расчет содержания препаратов выполняют относительно ГСО.
Реактивом для определения эргокальциферола, как и ретинола, служит раствор хлорида сурьмы (III), но образуется не синее (у ретинола), а оранжево-желтое окрашивание. ГФ рекомендует при выполнении реакции на эргокальциферол добавлять к реактиву 2 % аце-тилхлорида (появляется оранжево-желтое окрашивание).
Препараты хранят по списку Б в герметически укупоренных, доверху заполненных склянках оранжевого стекла, в сухом, защищенном от света месте, при температуре не выше 10 °С. Используют при нарушении D-витаминного обмена.
Стероидные гормоны и их полусинтетические аналоги. Кортикостероиды и их полусинтетические аналоги. По действию на организм кортикостероиды условно делят на две группы: минерало-кортикостероиды и глюкокортикостероиды. Первая группа активно регулирует минеральный обмен и слабо — углеводный и белковый обмены. Вторая группа активно регулирует углеводный и белковый обмены и слабо — минеральный. Наиболее широко из минералокор-тикостероидов применяют дезоксикортикостерона ацетат, а из глю-кокортикостероидов — кортизона ацетат, гидрокортизона ацетату его полусинтетический аналог преднизалон и галогенопроизводные пред-низолона. Источники получения препаратов — либо надпочечники убойного скота, либо природные вещества стероидной структуры, например холестерин, который считают предшественником кортико-стероидов в организме.
Структурная основа стероидных гормонов — гидрированный скелет углеводорода циклопентанофенантрена.
Кортикостероидные препараты представляют собой белые кристаллические вещества с желтоватым или кремоватым оттенком, без запаха, практически нерастворимы в воде, трудно или мало — в большинстве органических растворителей. Дезоксикортикостерона ацетат и кортизона ацетат легко растворимы в хлороформе. Кортикостероиды и их аналоги правовращающиеся оптические изомеры.
В испытаниях (ГФ) кортикостероидов имеется много общего. При нагревании на водяной бане смеси спиртового раствора препаратов и реактива Фелинга выпадает красно-оранжевый осадок. Реакция обусловлена восстановительными свойствами а-кетольной группировки, которая легко окисляется до карбоксильной. Кортикостероиды можно отличить друг от друга по реакции с концентрированной серной кислотой по окраске продукта. Дезоксикортикостерона ацетат дает красную окраску (после нагревания до 80—90 °С), кортизона ацетат — вначале бесцветную, переходящую в желтую, гидрокортизон — желтую и преднизолон — зеленую, переходящую в красную. Имеются и другие реакции, отличающие препараты.
Для качественного и количественного анализа препаратов используют спектрофотометрию в УФ-области. Для установления подлинности и проведения испытаний на посторонние примеси МФ рекомендована также ИК-спектроскопия и метод ТСХ. Имеются и другие методики.
Препараты хранят по списку Б в хорошо укупоренной таре, предохраняя от света. Используют при многих патологиях, особенно воспалительного характера.
Получен ряд галогенокортикостероидов, обладающих большой противовоспалительной активностью. Например, дексаметазон фтором) в 7 раз активнее преднизолона и в 35 раз — кортизона. Гестагенные гормоны и их полусинтетические аналоги. В ГФ вклю-1ены препараты естественного гормона — прогестерон и его полу-жнтетического аналога — прегнин, оба являются производными пре-гана. Прогестерон можно получить из гормонов желтого тела яич-[иков свиней и полусинтетическим способом из соласодина как про-1ежуточный продукт синтеза кортизона.
Это — белые кристаллические вещества (у прегнина ГФ допускает-;я желтоватый оттенок), в воде практически не растворимы, в этаноле эфире прогестерон растворим, а прегнин очень мало растворим. В юроформе прогестерон очень мало, а прегнин мало растворим.
Для испытания подлинности и отличия препаратов НТД реко-1ендует цветную реакцию с концентрированной серной кислотой. )бразуются окрашенные в желтый (прогестерон) или малиновый (прегнин) цвета флуоресцирующие растворы. Спиртовой раствор югестерона образует с л*-динитробензолом в щелочной среде окра-1енное в красный цвет соединение. Подлинность можно установить помощью ИК-спектров, сравнивая их со спектром стандарта. По НТД прогестерон идентифицируют с помощью ИК-спектра, снятого в вазелиновом масле в области 3700—400 СМ"1.
Прегнин можно количественно определять методом косвенной нейтрализации, при растворении препарата в тетрагидрофуране с добавлением избытка (10 мл) 10%-ного раствора нитрата серебра и потенциометрического титрования выделившейся азотной кислоты титрованным раствором гидроксида натрия.
Препараты хранят по списку Б в хорошо укупоренной таре, предохраняющей от действия света. Используют в качестве гестагенных средств.
Андрогенныс гормоны и полусинтетические анаболические препараты. Эти гормоны вырабатываются мужскими половыми железами (тестикулами) в период половой зрелости. В химическом отношении они являются производными андростана. В 1936 г. было установлено, что действие тестостерона становится более длительным после этери-фикации жирными кислотами. Эфиры создают своеобразное депо в месте введения, из которого они постепенно всасываются. На основании этих исследований был разработан тестостерона пропионат, наиболее активный из исследованных эфиров и устойчивый при хранении. Его получают этерификацией тестостерона пропионовым ангидридом при 110—114 "С. Полусинтетическим аналогом тестостерона является метилтестостерощ который можно синтезировать из дегидро-эпиандростерона. Промежуточным продуктом синтеза метилтестосте-рона является метиландростендиол, проявляющий слабую андроген-ную и высокую анаболическую (синтез белков в организме) активность. Анаболическим действием обладает и метандростенолон.
Препараты представляют собой белые кристаллические вещества, некоторые со слабым желтоватым оттенком, практически не растворимы в воде, легко растворимы или растворимы (метиландростендиол) в этаноле, очень легко (тестостерона пропионат) или легко растворимы в хлороформе, умеренно (метандростенолон, метилтесто-стерон) или легко (тестостерона пропионат) растворимы в эфире.
Наиболее достоверно подлинность препаратов можно подтвердить рекомендуемым ФС- и МФ-методом ИК-спектроскопии. Одновременно имеется много цветных и физико-химических реакций для идентификации препаратов (НТД, ГФ). Например, метод УФ-спек-трофотометрии рекомендован для испытания подлинности и количественного определения андрогенных и анаболических препаратов. Растворы препаратов в этаноле имеют максимумы поглощения у тестостерона пропионата при длине волны 240 нм, метилтестостерона — при 241 нм, метандростенолона — при 245 нм. В 1%-ных и 5%-ных масляных растворах тестостерона пропионат определяют фотоколориметрическим методом, основанным на использовании цветной реакции с изониазидом (гидразидом изоникотиновой кислоты). Образуется изоникотиноилгидразон, имеющий желтое окрашивание.
Препараты хранят по списку Б в хорошо укупоренной таре, предохраняя от действия света и влаги. Применяют в качестве андрогенных и анаболических средств.
Достаточно активным анаболиком является препарат стероидной структуры — феноболин, который практически нерастворим в воде, трудно — в спирте, легко — в хлороформе и ацетоне.
Препараты эстрогенных гормонов. Эстрогенные гормоны, являясь производными эстрона, вырабатываются в фолликулах яичников. Известны три природных гормона: эстрон, эстрадиол и эстриол. Эти гормоны содержатся в моче беременных женщин, жеребцов и беременных кобыл. Содержание эстрона в моче жеребцов и беременных кобыл —10—25 мг в 1 л. Это позволяет использовать мочу в качестве источника получения эстрогенных гормонов. Эфиры эстрогенов, содержащиеся в моче, гидролизуют соляной кислотой, а затем свободные эстрогены извлекают органическими растворителями. При дальнейшей очистке используют способность эстрогенов растворяться в щелочах с образованием фенолятов (феноксидов). Синтез эстради-ола и эстрадиола пропионата осуществляют из эстрона путем гидрирования кетогруппы в положении 17 до эстрадиола с последующим ацилированием 3- и 17 р-оксигрупп.
Из полусинтетических аналогов эстрадиола применяют этинилэс-традиол, местранол и эстрадиола дипропионат.
Препараты представляют собой белые или со слабым кремоватым оттенком кристаллические вещества, практически не растворимые в воде, легко — в хлороформе, умеренно, трудно или растворимы (эти-нилэстрадиол) — в этаноле.
Для установления подлинности используют цветную реакцию с концентрированной серной кислотой. В присутствии этинилэстра-диола появляется оранжево-красная окраска с желтовато-зеленой флуоресценцией; в присутствии местранола — кроваво-красная; эстрадиола дипропионат гидролизуется с образованием пропионовой кислоты, при последующем нагревании с этанолом образуется этиловый эфир пропионовой кислоты, имеющий характерный запах. Подлинность этинилэстрадиола, местранола и эстрадиола дипропио-ната подтверждают по ИК-спектрам, снятым в вазелиновом масле в области от 4000 до 200 см:1.
Этинилэстрадиол количественно определяют методом косвенной нейтрализации, так же как и прегнин. По МФ определение этинилэстрадиола выполняют спектрофотометрическим методом в среде безводного этанола при длине волны 281 нм. Для количественного определения эстрадиола дипропионата применяют реакцию омыления 0,1 М спиртового раствора гидроксида калия, избыток которого титруют 0,1 М раствором соляной кислоты (индикатор фенолфталеин).
Препараты хранят по списку Б в хорошо укупоренных банках (этинилэстрадиол в склянках оранжевого стекла). Назначают в качестве эстрогенных средств. Местранол — один из компонентов таблеток инфекундина, а этинилэстрадиол входит в состав противозачаточных средств — марвелона, нон-овлона, овидона.
Синтетические препараты эстрогенного действия. Вещества эстро-генного действия имеются не только среди стероидных, но и в ряду ароматических соединений, например производных фенанатрена, ди-фенильных и др. Так были синтезированы синэстрол (производное дифенилэтана) и диэтилстильбэстрол (производное стильбена).
Это — белые кристаллические порошки (синэстрол иногда с желтоватым оттенком), без запаха, практически не растворимы или очень мало растворимы в воде. Синэстрол легко растворим в этаноле, а диэтилстильбэстрол мало растворим в хлороформе, что можно использовать для их отличия друг от друга.
Для испытания подлинности ГФ рекомендует ряд цветных реакций, например с концентрированной серной кислотой. При действии концентрированной серной кислоты на хлороформенный раствор синэстрола (в присутствии формалина) слой хлороформа окрашивается в вишнево-красный цвет, а раствор диэтилстильбэстрола приобретает оранжевое окрашивание, постепенно исчезающее после разбавления водой. При действии бромной воды на раствор синэстрола в ледяной уксусной кислоте появляется осадок желтого цвета. Диэтилстильбэстрол при той же реакции в присутствии жидкого фенола образует появляющееся при нагревании изумрудно-зеленое окрашивание.
Для идентификации и количественного определения используют УФ-спектрофотометрию. Растворы препаратов в 0,1 М растворе гид-роксида натрия имеют максимумы светопоглощения в области 241 (синэстрол) и 260 нм (диэтилстильбэстрол), в этаноле раствор синэстрола имеет два максимума (229 и 778 нм), а диэтилстильбэстрол один — 242 нм.
Кроме того, количественное определение препаратов основано на получении сложных эфиров (диацетильных производных) при нагревании с точно отмеренным количеством уксусного ангидрида, избыток которого, превратившегося в уксусную кислоту, оттитровыва-ют 0,5 М раствором гидроксида натрия. Параллельно выполняют контрольный опыт с тем же количеством уксусного ангидрида.
Хранят препараты по списку Б в хорошо укупоренной таре, предохраняя от действия света. По фармакологическому действию близки к природным гормонам. При пероральном применении не разрушаются в пищеварительном тракте и быстро всасываются.
Гликозиды. Гликозиды широко распространены в растительном мире. Это вещества, в которых гликозильная часть молекулы (циклическая форма Сахаров) связана через атом кислорода, серы или азота с радикалом органического соединения, не являющегося сахаром {агликон, или гении). По природе сахарной части гликозиды делят на две группы: пиранозиды (гликозиды с шестичленным циклом сахарного компонента) и фуранозиды (гликозиды с пяшчленным циклом сахарного компонента). Агликон связан в молекуле гликози-да с сахарным компонентом по типу эфирной связи через полуаце-тальный гидроксил. Процесс гидролиза большинства гликозидов происходит очень легко под действием ферментов — глюкозидаз, а также под влиянием кислот, щелочей и при нагревании.
Имеется несколько классификаций гликозидов — ботаническая, фармакологическая и др. Исходя из химического строения гликозиды делят на три группы в зависимости от атома, связывающего сахар и агликон. Различают О-, S- (тиогликозиды) и N-гликозиды. Каждую из этих групп классифицируют по химической группе агликона.
Стероидные, или сердечные, гликозиды — это О-гликозиды, аг-ликоны которых имеют стероидную структуру и отличаются выраженным действием на сердечную мышцу.
Строение сердечных гликозидов. Источники получения сердечных гликозидов — различные виды наперстянки (крупноцветковая, пурпурная, ржавая, шерстистая), горицвет весенний, олеандр, ландыш майский, обвойник, различные виды желтушника, строфанта, морозника и другие растения, в которых обычно содержатся первичные (генуинные) гликозиды. Это очень лабильные вещества, легко разлагающиеся (под действием энзимов, кислот, щелочей, при нагревании) с образованием вторичных гликозидов, которые также легко могут гидролизироваться на агликоны и остатки моно-, ди-, три- или тетрасахаридов. У некоторых первичных гликозидов к сахарному компоненту присоединен остаток уксусной кислоты. Сахара, входящие в состав сердечных гликозидов, за исключением глюкозы и рамнозы, специфичны для данной группы веществ и представляют собой 6-дезоксогексозы или их 3-о-метиловые эфи-ры. Важнейшими моносахаридами, входящими в состав сердечных гликозидов, являются: D-глюкоза, L-рамноза, D-дигитоксоза, D-цимароза и L-олеандроза.
Агликоны сердечных гликозидов имеют стероидную структуру, являются производными циклопентанофенантрена. По химическому строению агликоны можно разделить на две группы, отличающиеся структурой присоединенного в положении 17 лактонного цикла. Пя-тичленный лактонный цикл входит в структуру агликонов кардеио-лидов, а шестичленный ~ буфадиенолидов. Карденолиды содержатся в различных видах наперстянки, строфанта, ландыша, желтушника, олеандра, горицвета весеннего и др. Буфадиенолиды входят в состав морозника, морского лука, а также найдены у жаб.
Носителем биологической активности является агликон, сахарный компонент влияет на скорость всасывания и продолжительность действия. Чем больше остатков моносахаридов в молекуле гли-козида, тем активнее он действует.
Специфическое действие гликозида на сердце обусловлено наличием в молекуле агликона пяти- или шестичленного лактонного цикла, присоединенного в положении 17, и гидроксила — в положении 14. На кардиотоническое действие большое влияние оказывает заместитель в положении 10. Большая часть агликонов в этом положении имеет ме-тильную или альдегидную группу. Окисление альдегидной группы до карбоксильной значительно снижает активность препарата. К потере фармакологической активности приводит и замена стероидного цикла агликона различными производными (бензола, нафталина и др.).
Наиболее сложная химическая структура у гликозидов наперстянки. При гидролитическом расщеплении, а также при хранении и высушивании сырья первичные гликозиды превращаются во вторичные и другие продукты. К вторичным гликозидам наперстянки относятся дигитоксин, гитоксин (наперстянка пурпурная). Эти же вторичные гликозиды выделены и из наперстянки шерстистой (в ней содержится также дигоксин).
Первичный гликозид наперстянки шерстистой — дигиланид С под названием целанид и вторичный гликозид наперстянки пурпурной — дигитоксин включены в ГФ. В ГФ включен также строфантин ^(получают из семян строфанта Комбе).
В растении обычно содержится несколько сердечных гликозидов и целый ряд сопутствующих веществ. Общая схема получения сердечных гликозидов заключается в предварительном обезжиривании растительного сырья эфиром или лигроином. Затем сырье настаивают в 70%-ном этаноле, который отгоняют под вакуумом и из остатка извлекают первичные гликозиды теплой водой, настаивая несколько дней. Из полученной смеси эфиром удаляют смолы и раствором ацетата свинца — сапонины. Гликозиды осаждают, насыщая смесь водным раствором сульфата аммония. Разделение смеси гликозидов основано на различии их растворимости в органических растворителях, для чего используют хроматографические методы.
Свойства и испытания препаратов сердечных гликозмдов. Целанид, дигитоксин, дигоксин и строфантин К представляют собой белые или бесцветные кристаллические вещества, мало или практически не растворимые в воде и в органических растворителях.
Для установления их подлинности могут быть использованы общие реакции. Первая группа цветных реакций позволяет обнаружить наличие стероидного цикла в молекуле, например реакция Либермана-Бурхардта, основанная на способности стероидов к дегидратации под действием уксусного ангидрида и концентрированной серной кислоты. В результате чего слой уксусного ангидрида окрашивается в зеленый цвет. ГФ рекомендует эту реакцию для установления подлинности строфантина К. Вторая группа цветных реакций основана на обнаружении пятичленного лактонного цикла в молекуле карденолидов. Например, реакция Легаля, суть которой заключается в образовании окрашенного в красный цвет продукта при взаимодействии препарата с раствором нитропрус-сида натрия в щелочной среде. Эту реакцию используют для испытания подлинности всех фармакопейных препаратов сердечных гликозидов. Третья группа реакций основана на обнаружении сахарного компонента в препаратах сердечных гликозидов. Для этого используют свойственные сахарам реакции, основанные на их восстановительных свойствах (реакция с реактивом Фелинга, реакция «серебряного зеркала» и др.)- Чаще используют специфическую на 2-дезоксисахара (содержащиеся в молекулах большинства сердечных гликозидов) реакцию Келлера—Килиани, заключающуюся в предварительном растворении 1—2 мг препарата в ледяной уксусной кислоте, содержащей 0,05% хлорида железа (III). Раствор осторожно вливают в пробирку с концентрированной серной кислотой и наблюдают окраску верхнего слоя (синий или сине-зеленый цвет) и на границе двух слоев (лилово-красный или бурый цвет). Этим способом устанавливают подлинность целани-да и дигитоксина.
При испытании на чистоту используют метод ТСХ.
Качественную и количественную оценку сердечных гликозидов определяют методами спектрофотометрии, в ЭЖХ и некоторыми другими.
Биологическим методом устанавливают активность препаратов, сравнивая с препаратами-стандартами. Ее выражают в ЛЕД (лягушачьих), КЕД (кошачьих) или ГЕД (голубиных) единицах действия. 1 ЕД — наименьшее количество препарата, которое вызывает систолическую остановку сердца подопытного животного.
Препараты хранят по списку А в хорошо укупоренной таре, предохраняя от действия света и влаги. Применяют в качестве кардио-тонических средств.
Лнти б котики-гликоз иды. Стрептомицины. В 1944 г. Вакс-ман получил стрептомицин, являющийся гликозидом. Его агликон представляет собой спирт инозит, в котором две оксигруппы заменены остатками гуанидина. Сахарная часть представляет дисахарид стреп-тобиозамин. Промышленным продуцентом антибиотика является штамм актиномицета.
Препарат легко образует соли. В ГФ включен стрептомицина сульфат — белое вещество, легко растворимое в воде и практически не растворимое в органических растворителях.
Стрептомицин можно идентифицировать по образованию пикрата стрептидина сульфата (температура плавления 283—284 °С). Для установления подлинности препарата, примененного в качестве стандарта при биологическом контроле, используют ПМР-спектроскопию.
Количественно определяют фотоколориметрическим методом, используя реакцию образования мальтола. Светопоглощение его измеряют в максимуме при 525 нм относительно смеси реактивов. Биологическую активность устанавливают методом диффузии в агар с тест-микробом. Препарат должен содержать не менее 730 мкг/мл (ЕД/мл) в пересчете на сухое вещество (I мкг = 1 ЕД).
Хранят препарат по списку Б, во флаконах с резиновыми пробками, обжатыми алюминиевыми колпачками. Применяют как химио-терапевтическое средство, в том числе при туберкулезе.
Антибиотики-аминогликозиды. Близкими по химической структуре со стрептомицином являются канамицин, неомицин, мономицин и их соли — сульфаты, в молекулах которых дополнительно входят аминогруппы. К этим антибиотикам относят еще гентамицина сульфат, амикацина сульфат, сизомицина сульфат, тобрамицин. Характерный структурный элемент антибиотиков-аминогликозидов — 2-дезокси-D-стрептамин.
Препараты легко растворимы в воде, практически не растворимы или очень мало в этаноле и других органических растворителях.
Подлинность канамицина моносульфата и неомицина сульфата определяют цветной реакцией со спиртовым раствором орцина и концентрированной соляной кислотой в присутствии хлорида железа (III). Образуются окрашенные в зеленый цвет вещества при нагревании в кипящей водяной бане. Амикацина сульфат можно обнаружить в реакции с антроном (голубовато-фиолетовое окрашивание). Подлинность мономицина и гентамицина сульфатов определяют методом ТСХ.
ПМР-спектроскопию применяют для идентификации неомици-на В, мономицина А, канамицина А, тобрамицина, гентамицина и сизомицина. Препараты дают положительную реакцию на сульфат-ион. Спектроскопию ЯМР13С используют для идентификации стрептомицина, неомицина, мономицина, тобрамицина, канамицина А и его полусинтетического аналога — амикацина. Количественное определение гентамицина сульфата можно провести нингидриновым и поляриметрическим методом, а также фотометрически. Биологическую активность устанавливают методом диффузии в агар с тест-культурами. 1 мкг антибиотиков соответствует 1 ЕД.
Препараты хранят по списку Б. Применяют при многих бактериальных инфекциях, так как они широкого спектра антимикробного действия.
1.2.2.4 ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ
К гетероциклическим относят органические соединения, циклы которых кроме атомов углерода включают другие элементы, чаще всего кислород, азот и серу. Эти соединения широко распространены в природе, многие из которых являются БАВ (алкалоиды, витамины, ферменты, антибиотики). Источниками получения лекарственных веществ этой группы служат продукты растительного и животного происхождения. По химическому строению эти соединения весьма разнообразны, различаются числом атомов в цикле, природой гете-роатомов и их количеством в цикле. По размерам циклов их делят на трех-, четырех-, пяти-, шести- и семичленные, а по характеру гете-роатомов — на азот-, кислород- и серосодержащие. Наличие гетероа-томов в молекуле обеспечивает значительную их лабильность по сравнению с другими органическими соединениями. Это особенно проявляется у гетероциклов с несколькими гетероатомами и при наличии различных заместителей в молекуле. Такие соединения имеют наибольшую тенденцию к раскрытию цикла и рециклизации, а также к различного рода таутомерным превращениям. Некоторые гетероциклические соединения характеризуются наличием двух видов таутометрии — кетоенольной и лактамлактимной (производные ура-цила, барбитуровой кислоты и др.). Это имеет важное значение для синтеза и анализа. Предполагают, что с этим связана и биологическая активность этих соединений (возможность в широких пределах перемещения электронов).
Большинство методов синтеза этих веществ основано на так называемой гетециклизации, т. е. на образовании гетероцикла в результате замыкания в цикл одного или двух алифатических соедине- ний. Такие реакции основаны главным образом на конденсации дикар-бонильных соединений (альдегидов, карбоновых кислот) с аммиаком или алифатическими и ароматическими соединениями, содержащими в молекуле первичную ароматическую аминогруппу. Так получают различные азотсодержащие гетероциклы, являющиеся структурной основой многих синтетических и природных лекарственных веществ.
Производные этиленимина. Предпосылкой для использования этих препаратов в медицине является цитостатическое (угнетающее рост клеток) действие. Этот эффект объясняется алкилирую-щим действием этиленимина на клеточные элементы злокачественной ткани, вследствие чего приостанавливается ее развитие. Наибольшее число применяемых препаратов этой группы — производные фосфорной или тиофосфорной кислот. В практике используют тиофосфамид, бензотэф, имифос и др.
Это — белые кристаллические вещества. Бензотэф растворим, тиофосфамид легко растворим, а имифос очень легко растворим в воде, этаноле, хлороформе. Имифос умеренно растворим в эфире, а бензотэф — в ацетоне.
Для испытания подлинности используют реакции на имминную группировку, фосфор, серу и соответствующее ароматическое или гетероциклическое ядро. Общая реакция основана на окислении эти-лениминной группы дихроматом калия в присутствии серной кислоты до ацетальдегида. Последний возгоняется и взаимодействует с нитропруссидом натрия (в присутствии пиперидина), образуя окрашенное в синий цвет соединение. Этилениминную группу можно определить и по изменению окраски метилового оранжевого (из красной в желтую) после добавления йодита калия к водному раствору тиофосфамида, подкисленному серной кислотой. Подтверждение иминогруппы в имифосе основано на обнаружении аммиака (по запаху или посинению влажной лакмусовой бумаги) при нагревании смеси препарата с раствором гидроксида натрия. Бензотэф дает положительную реакцию с реактивом Драгендорфа (светло-коричневый осадок) за счет наличия в молекуле имидных групп.
Количественное определение проводят методом неводного титрования. В зависимости от химических свойств препарата его титруют либо хлорной кислотой, либо раствором гидроксида натрия (бензотэф). Применяют также косвенное кислотно-основное титрование, основанное на выделение гидроксида натрия при взаимодействии с тиосульфатом натрия или тиоцианатом калия.
Препараты хранят по списку А в сухом, защищенном от света месте; бензотэф и имифос при температуре не выше 5 °С, тиофосфамид 10 "С. Используют в качестве противоопухолевых средств.
Производные фурана. В лечебной практике применяют производные 5-нитрофурана: фурацилин фурадонин, фуразолидон. Исходный продукт синтеза — фурфурол (а-фурилальдегид), который получают из отходов деревообрабатывающей промышленности, а также смол, шелухи подсолнечника путем обработки разведенной серной кислотой и отгонки водяным паром. Из фурфурола получают 5-нитро-фурфурол.
Препараты представляют собой желтые кристаллические вещества, без запаха, мало растворимы или практически нерастворимы в воде и этаноле (фурацилин очень мало растворим), мало растворимы в диметилформамиде. Из-за наличия нитро- и амидной групп фурацилин проявляет в растворах кислотные свойства и лучше других препаратов растворяется в щелочах.
Подлинность препаратов устанавливают по цветной реакции с водным раствором гидроксида натрия. Фурацилин образует соль, окрашенную в оранжево-красный цвет, фурадонин — темно-красного, фуразолидон — красно-бурого цвета. Для отличия препаратов друг от друга используют спиртовой раствор гидроксида калия в сочетании с ацетоном: фурацилин приобретает темно-красное окрашивание, фурадонин — зеленовато-желтое, переходящее в бурое с выпадением белого осадка, фуразолидон — постепенно появляющееся красное окрашивание, переходящее в бурое. При испытании на чистоту фурацилина ГФ рекомендует устанавливать отсутствие примеси семикарбазида с помощью реактива Фелинга.
Количественное определение фурацилина (по ГФ) выполняют йо-дометрическим методом, основанном на окислении препарата йодом в щелочной среде (для улучшения растворимости к навеске добавляют хлорид натрия и смесь нагревают), после окончания процесса окисления раствор подкисляют и смесь титруют тиосульфатом натрия. Фурадонин количественно определяют методом неводного титрования, 0,1 М раствором метилата натрия в смеси диметилформамида и диок-сана (индикатор тимоловый синий). Количественное определение фу-разолидона, как и других нитрофуранов, можно проводить фотоколо-жметрическим методом, основанным на использовании цветных реши препаратов с едкой щелочью. Существуют и другие методы (ентификации и количественного определения нитрофуранов.
Кроме перечисленных препаратов в практике применяют фурагин и его растворимую калиевую соль, способы испытания которых аналогичны другим препаратом этой группы.
Препараты хранят по списку Б в хорошо укупоренной таре, предохраняя от действия света и влаги. Применяют при различных бактериальных инфекциях (фурацилин чаще используют как антисептик).
Производные пирролидина. Препарат пирацетам. В результате поиска структурных аналогов у~аминомасляной кислоты (ГАМК), обладающих психотропным действием, получен препарат пирацетам (ноотропил), являющийся циклическим аналогом ГАМК-2-оксо-1 -пирролидинилацетамида и родоначальником новой группы психотропных средств.
Подлинность препарата подтверждают по отсутствию выраженных максимумов поглощения в УФ-спектре 1%-ного водного раствора (легко растворим в воде) в интервале 230—350 нм. При нагревании препарата с раствором гидроксида натрия выделяется аммиак, который обнаруживают по запаху и посинению красной лакмусовой бумаги. Эта же химическая реакция лежит в основе количественного определения пирацетама по методу Кьельдаля.
Применяют препарат при различных расстройствах нервной системы.
Лекарственные средства, содержащие поливинилпирролидон. Поли винилпирролидон (ПВП) — полимер N-винилпирролидона. Вначале получают изу-бутиролактона и аммиака пирролидон, который ви-нилируют ацетилином до ПВП. В практике используют ПВП (средне-молекулярный 35 000+5000), гемодез (6%-ный ПВП с натрия, калия, и кальция хлоридом) и энтеродез (для внутреннего применения), представляющие низкомолекулярные (12 600+2700) соединения ПВП.
Наличие ПВП устанавливают с помощью 0,1 М раствора йода, который с растворами этих трех препаратов образует осадки красно-коричневого цвета.
Количественное определение ПВП в препаратах можно установить рефрактометрическим или йодометрическим методами.
Хранят препараты в зависимости от форм выпуска. Лекарственную форму 15%-ного ПВП для инъекций выпускают в ампулах и хранят по списку Б, при температуре не выше 20 °С. В таких же условиях хранят гемодез, который выпускают в стеклянных флаконах. Энтеродез выпускают в полиэтиленовых пакетах.
Применяют препараты как кровезаменители и заменители синовиальной жидкости (ПВП), в качестве дезинтоксицирующих средств внутривенно (гемодез) и внутрь (энтеродез).
Производные пиразола. Применяют препараты антипирин, амидопирин и анальгин, структура которых содержит молекулу пиразо-лона-5, а также бутадион — производное пиразолидиндиола.
Антипирин синтезируют из дикетена, который является продуктом пиролиза ацетона (при 500—600 °С над оксидом аммония). Ди-кетен конденсируют с фенилгидразином. Образовавшийся продукт метилируют метиловым эфиром бензолсульфокислоты, который увеличивает выход антипирина (до 90 %). Антипирин является исходным продуктом для получения амидопирина, который отличается наличием в молекуле диметиламиновой группировки. Синтез анальгина осуществляют из монометиламиноантипирина и формальдегид-гидросульфита натрия.
Это — белые или бесцветные кристаллические вещества (анальгин и бутадион могут иметь желтоватый оттенок), без запаха, горького вкуса. Антипирин очень легко, анальгин легко растворимы в воде, амидопирин растворим (медленно), а бутадион не растворим в воде. В этаноле амидопирин и антипирин легко растворимы, а анальгин и бутадион трудно растворимы. Анальгин практически не растворим в эфире и хлороформе, остальные препараты растворимы в хлороформе (амидопирин — очень легко).
Подлинность амидопирина подтверждают реакцией образования окрашенной в красный цвет комплексной соли — феррипирина. Анальгин дает положительную реакцию на ион натрия, а при нагревании с минеральными кислотами выделяет диоксид серы и формальдегид, которые регистрируют по запаху. Бутадион можно идентифицировать реакциями осаждения солями меди (осадок бледно-голубого цвета), серебра (белого цвета) и др. Для выполнения реакций сначала получают натриевую соль бутадиона, действуя раствором гидро-ксида натрия. Амидопирин и анальгин ввиду наличия основных свойств дают характерные реакции с осадительными (общеалкалоидными) реактивами на органические основания. При нагревании анальгина с реактивом Миллона (раствор ртути в азотной кислоте) возникает темно-синее окрашивание.
Количественное определение антипирина проводят йодометри-ческим методом, основанном на его способности вступать с йодом в реакцию замещения. Образующийся осадок 4-йодопирина может, адсорбировать некоторые количества йода, поэтому его растворяют в хлороформе. Образование 4-йодопирина лежит в основе йодхло-рометрического определения антипирина при титровании 0,1 М раствором йодмонохлорида (индикатор — крахмал). Выделившийся при этом йод титруют 0,1 М раствором тиосульфата натрия (индикатор крахмал). Эту же реакцию можно использовать для определения бутадиона.
Амидопирин определяют перманганатометрическим методом, а анальгин можно определить по сульфат-иону, который образуется в результате окисления препарата 3%-ным раствором пероксида водорода. Затем титруют раствором хлорида бария. Имеются также методики косвенного комплексонометрического и ацидометрического определения анальгина. Существуют и другие реакции выявления этих препаратов (см. ГФ).
Препараты хранят в хорошо укупоренной таре по списку Б, предохраняя от действия света и влаги. Применяют в качестве болеутоляющих (ненаркотические анальгетики), жаропонижающих и противовоспалительных средств.
Производные имидазола. Производныеимидазолаиими-дазолина. К этой группе относят мерказолил, метронидазол, этимизол, клофелин. Мерказолил синтезируют из этанола, исходный продукт синтеза метронидазола — этилендиамин. Это — белые кристаллические вещества, которые могут иметь зеленовато-желтый оттенок, а мерказолил и метронидазол — желтоватую окраску.
Мерказолил легко растворим в воде, этаноле, хлороформе, мало ~ в эфире. Метронидазол мало растворим в воде, трудно — в этаноле, очень мало — в хлороформе. Этимизол мало растворим в воде, растворим в этаноле и ацетоне, легко растворим в хлороформе. Клофелин растворим в воде, этаноле, практически не растворим в хлороформе и эфире.
Для испытания подлинности используют УФ-спектрофотометрию, а также химические реакции на различные функциональные группы. Меркаптогруппу в молекуле мерказолила устанавливают по образованию меркагггидов с солями тяжелых металлов. Карбамидную группу в молекуле этимизола определяют путем образования комплексов с ионами тяжелых металлов (меди, кобальта, реактивом Несслера и др.)- Клофелин положительно реагирует на хлориды. Нитрогруппу в метронидазоле можно обнаружить (после восстановления до аминогруппы) с помощью реакции азосочетания.
Содержание метронидазола, этимизола и клофелина определяют методом неводного титрования (титрант — 0,1 М раствор хлорной кислоты, индикатор — кристаллический фиолетовый). Клофелин можно определить и меркуриметрическим методом.
Препараты хранят в хорошо укупоренной таре, в защищенном от света месте, мерказолил, этимизол по списку Б, клофелин по списку А
Мерказолил применяют как антитиреоидное средство; метронидазол — как противоалкогольное и трихомонацидное средство; этимизол — аналептик, а клофелин — гипотензивное средство.
Производное бензимидазола. Фармакопейным препаратом является дибазол. Получают из о-фенилендиамина, фенилуксусной кислоты и ее производных.
Препарат умеренно растворим в воде, легко — в этаноле, трудно и практически нерастворим в других растворителях.
Подлинность по ГФ устанавливают, действуя на слабокислый раствор препарата ОД М раствором йода; образуется красновато-сереб-шстый осадок.
Количественно по ГФ определяют методом неводного титрования. Метод аргентометрии позволяет определить препарат по хлорид-иону. Имеются и другие методы идентификации и определения.
Дибазол хранят по списку Б в хорошо укупоренной таре, учитывая его гигроскопичность. Используют в качестве спазмолитика (это — синтетический аналог папаверина) при спазмах кровеносных сосудов и гладких мышц. Кроме того, дибазол проявляет адаптогенные свойства.
Алкалоиды, производные имидазола. К этой группе относится алкалоид пилокарпин, содержащийся в листьях африканского растения. Содержит в молекуле имидазольный и фурановый циклы. Фармакопейный препарат — пилокарпина гидрохлорид.
Схему синтеза пилокарпина можно условно разделить на три стадии. В первой стадии получают пилоповую кислоту, во вторую стадию — гомопилоповую кислоту и в третью — пилокарпин.
Препарат легко растворим в воде, этаноле, практически не растворим в эфире и хлороформе.
Подлинность по ГФ устанавливают по хлорид-иону. Более специфична цветная реакция с нитропруссидом натрия. Количественно определяют методом титрования в неводных растворителях или методом УФ-спектрометрии.
Хранят по списку А в хорошо укупоренной таре. Применяют в качестве холиномиметического средства.
Производные пиридина. В лечебной практике применяют ;интетические препараты ~ производные никотиновой (р-пиридин-1рбоновой) и изоникотиновой (у-пиридинкарбоновой) кислот, 2-6-щметилпиридина (2,6-лутидина). Основу их химической структуры составляет пиридин. Исходные продукты синтеза пиридинкарбоно-вых кислот — содержащиеся в каменноугольной смоле жидкие вещества — пиколины. Окислением р-пиколина получают никотиновую, а у-пиколина — изоникотиновую кислоты.
Препараты, производные никотиновой кислоты. В эту группу входят кислота никотиновая, никотинамид, никодин, диэтиламид никотиновой кислоты.
Экономичный способ синтеза никотинамида основан на пропускании газообразного аммиака через смесь никотиновой кислоты и водного раствора аммиака при 180—185 "С. Из этой же смеси можно получить никодин, действуя на никотинамид параформом. Диэтиламид никотиновой кислоты получают, действуя на никотиновую кислоту диэтиламином в присутствии трихлороксида фосфора (V).
Кислота никотиновая, ее амид и никодин — белые кристаллические вещества, а диэтиламид никотиновой кислоты — жидкость, смешивающаяся во всех соотношениях с водой, этанолом, эфиром, хлороформом. Никотинамид легко растворим в воде и умеренно — в этаноле. Кислота никотиновая трудно растворима в воде, мало — в этаноле. В эфире и хлороформе эти препараты практически не растворимы или очень мало растворимы.
Для испытания подлинности препаратов НТД рекомендуются реакции разложения и цветные реакции. Реакция разложения кислоты никотиновой и никотинамида происходит при нагревании с кристаллическим карбонатом натрия. Образуется пиридин, который легко обнаружить по характерному запаху. К этой же группе относятся реакции разложения препаратов при нагревании в растворах гидро-ксидов щелочных металлов. Никотинамид и никодин разлагаются с образованием аммиака, который можно обнаружить по запаху или посинению влажной лакмусовой бумаги. Диэтиламид никотиновой кислоты в этих условиях разлагается с образованием диэтиламина, который имеет характерный запах. По продуктам разложения в сильнощелочной среде можно отличить кислоту никотиновую от ее производных. Кислота никотиновая ввиду кислотных свойств ее растворов образует окрашенные нерастворимые соли. Например, с ионами меди (II) — осадок синего цвета (никотинат меди).
Соли пиридиновых оснований образуются при использовании таких реагентов, как тиоцианат брома (бромродан), тиоцианат хлора (хлорродан), цианид брома, хлороформ, хлоралгидрат. Тиоцианат брома получают при добавлении к бромной воде тиоцианата аммония до обесцвечивания. В присутствии указанных реагентов при нагревании в щелочной среде происходит размыкание пиридиниево-го цикла. При последующем добавлении первичных ароматических аминов (анилин, новокаин, сульфацил-натрий) происходит их конденсация с образовавшимся глутаконовым альдегидом и получаются шиффовы основания, окрашенные в желтый, оранжевый или красный цвет. Эта цветная реакция может быть использована для идентификации кислоты никотиновой, никотинамида, никодина и других производных пиридина. Общей на производные пиридина (и другие третичные амины) является реакция с лимонной кислотой и уксусным ангидридом — при нагревании появляется красное или фиолетовое окрашивание. Для отличия препаратов друг от друга рекомендуют специальные цветные реакции.
При испытании на чистоту устанавливают допустимое содержание примесей исходных продуктов синтеза или разложения препаратов: гидразина (не более 0,02 %) — в изониазиде, гидразида изоникотиновой кислоты и ванилина —в фгивазиде, формальдегида — в метазиде.
Для количественного определения кислоты никотиновой используют кислотные свойства ее водных растворов. После растворения в горячей воде титруют 0,1 М раствором гидроксида натрия до образования натриевой соли (индикатор — фенолфталеин). Ее можно определить и иодометрическим методом после осаждения никотината меди. Количественную оценку никотинамида и диэтиламида никотиновой кислоты проводят определением азота в органических соединениях двумя методами:
реакцией разложения (как и при испытании подлинности препаратов) с отгонкой аммиака в приемник с борной кислотой. Образуется смесь метабората и тетрабората аммония, которую титруют 0,1 М раствором соляной кислоты;
после разложения препаратов кипячением в 50%-ном растворе серной кислоты. На образовавшийся сульфат аммония действуют гидроксидом натрия и отгоняют образовавшийся аммиак в приемник с борной кислотой и т. д.
Существуют методы неводного титрования с использованием безводной уксусной кислоты, 0,1 М раствора хлорной кислоты (тит-рант) и индикатора кристаллического фиолетового (никотинамид и никодин). Никодин можно определять и иодометрическим методом. Хранят препараты в хорошо укупоренной таре, предохраняя от света. Используют как витаминные препараты (кислоту никотиновую и никотинамид); как желчегонные и антисептические (никодин), в качестве стимулятора ЦНС (диэтиламид никотиновой кислоты в форме 25%-ного водного раствора — кордиамин).
На основе никотинамида получены внутрикомплексные соединения и антианимические средства — коамид, ферамид, препарат пика-милон (комплекс из ГАМК и кислоты никотиновой) — вазоактивное и ноотропное средство.
Производные изоникотиновой кислоты, У гидразида изоникотиновой кислоты и его производных была обнаружена высокая противотуберкулезная активность. Из многих синтезированных веществ [взаимодействие гидразинов (гидразидов) с альдегидами (кетонами)] используют изониазид, фтивазид, метазид и др.
Это — кристаллические порошки белого цвета или с желтоватым кремовым оттенком. Фтивазид отличается выраженной желтой окраской и запахом ванилина. Изониазид легко растворим в воде, умеренно в этаноле. Метазид, фтивазид мало растворимы или практически не растворимы в воде и этаноле. В эфире и хлороформе все препараты практически не растворимы или очень мало растворимы. Метазид и фтивазид обладают основными свойствами, поэтому растворимы в минеральных кислотах. Производные изоникотиновой кислоты обладают способностью к таутомерным превращениям, при этом могут проявлять в растворах как кислотные, так и основные свойства, которые характеризуются константами ионизации.
НТД рекомендует способы идентификации по УФ-спектрам поглощения. Раствор изониазида в 0,01 М соляной кислоте имеет максимум поглощения при 266 нм и минимум поглощения — при 234 нм, раствор метазида в 1 М соляной кислоте — один максимум поглощения при 267 нм. Кроме того, подлинность препаратов устанавливают с помощью цветных реакций.
Применяемые методы количественного определения препаратов основаны на окислении продуктов гидролиза, для чего используют различные окислительно-восстановительные методы, например йодометрию. Окисление йодом проводят в слабощелочной среде. Изо-ниазид определяют также броматометрическим методом в солянокислой среде. Избыток брома устанавливают йодометрией. Определение метазида основано на окислении йодом гидразида изоникотиновой кислоты и формальдегида, выделяющихся при гидролизе препарата в щелочной среде. Фтивазид находят йодометрическим методом после предварительного гидролиза в солянокислой среде. Из других химических методов для количественного определения изониазида используют нитритометрию. Фотометрические методы установления препаратов основаны на образовании окрашенных продуктов с ванадатом аммония, 2,3-дихлор-1,4-нафтохиноном, 1,2-нафто-хинон-4-сульфонатом натрия.
Хранят препараты по списку Б в хорошо укупоренной таре, в защищенном от света месте. Применяют в качестве противотуберкулезных средств.
Карбамоилпроизводные гидразцда изоникотиновой кислоты. Карба-моилпроизводное гидразида — ниаламид — не обладает противотуберкулезным действием, а является ингибитором моноаминооксидазы. Препарат мало и медленно растворим в воде, трудно — в этаноле, очень мало — в хлороформе, легко растворим в разведенной соляной кислоте.
Подлинность устанавливают по УФ-спектру 0,002%-ного раствора в 0,01 М растворе соляной кислоты, который должен иметь максимум светопоглощения в области 267 нм. Наличие гидразиновой группировки подтверждают реактивом Фелинга.
Количественно препарат определяют нитритометрическим методом, используя внутренний индикатор — смесь тропеолина ОО и метилового синего.
Хранят по списку Б в защищенном от света месте. Используют в психиатрической практике при депрессиях.
Производные 2,6-диметилпиридина. К этой группе относится парми-дин со структурной основой 2,6-бисоксиметилпиридина. Антиатероск-леротическое средство. По химическому строению — двойной эфир метилкарбами новой кислоты. Препарат мало растворим в воде, растворим в метиловом спирте и хлороформе. Трудно растворим в этаноле.
Наиболее объективно его подлинность подтверждают методами ИК- и УФ-спектрометрии, хотя существуют и цветные реакции.
Количественно определяют методом неводного титрования в среде ледяной уксусной кислоты с использованием в качестве титранта 0,1 М раствор хлорной кислоты (индикатор — кристаллический фиолетовый).
Хранят в защищенном от света месте. Применяют для лечения атеросклероза.
Производное дигидропиридина — фенигид или коринфар. Применяют как антиангинальное, гипотензивное средство и антагонист ионов кальция.
К этой же группе по химическому строению может быть отнесен эмоксипин, являющийся антиоксидантом. Его используют в основном в глазной практике, а также при заболеваниях, сопровождающихся гипоксией.
Оксиметилпиридиновые витамины и их производные. К производным пиридина относится группа витаминов В6, основной из которых — пиридоксина гидрохлорид, синтезируемый из алифатических соединений. Из пиридоксина гидрохлорида синтезированы пириди-тол и пиридоксальфосфат.
Пиридоксина гидрохлорид и пиридитол легко растворимы в воде, шридоксальфосфат — мало растворим. В органических растворите-шх препараты не растворимы или трудно растворимы. Пиридитол мало растворим в этаноле.
Подлинность пиридоксина гидрохлорида и пиридоксальфосфата подтверждают по УФ-спектрам. Растворы препаратов в фосфатном буферном растворе (рН 7,0) имеют максимум поглощения у первого — при 254 и 324 нм, у второго — при 330 и 388 нм.
Количественно пиридоксина гидрохлорид определяют двумя способами, один из которых основан на использовании неводного титрования, а второй заключается в нейтрализации связанной соляной кислоты в препарате 0,1 М раствором гидроксида натрия (индикатор — бромтимоловый синий). Содержание пиридоксальфосфата и пириди-тола определяют также методом неводного титрования, но без добавления ацетата ртути. При определении первого используют растворитель — смесь уксусного ангидрида и муравьиной кислоты (индикатор
—раствор Судана III), для второго растворителем служит смесь ледяной уксусной кислоты и уксусного ангидрида (1:30). Перед титрованием смесь нагревают до кипения, охлаждают и титруют (индикатор - кристаллический фиолетовый). Для пиридитола НТД рекомендует меркуриметрический метод, позволяющий установить количество хлора, которого в препарате должно быть 15,75—16,2 % (титрант — 0,1 М раствор нитрата ртути (II), индикатор — дифенилкарбазон).
Препараты хранят в хорошо укупоренной таре. Назначают при недостатке витаминов В6 (токсикоз у беременных, хорея, пелагра, острые и хронические гепатиты и т. д.).
Производные пиперидина и пиперазина. Производные пиперидина. Пиперидин (гидрированный пиридин) — структурная основа многих лекарственных веществ, отличающихся по фармакологическому действию. Наиболее широко применяют промедол и циклодол. Это — белые кристаллические вещества. Промедол легко растворим в воде, растворим в этаноле. Циклодол мало растворим в воде и медленно — в этаноле.
Подлинность препаратов подтверждают путем осаждения в виде пикратов (желтый осадок). Циклодол из водного раствора можно осадить хлорной кислотой. Температура плавления перекристаллизованного осадка 173—176 °С. Препараты могут быть идентифицированы и другими осадительными (общеалкалоидными) реактивами. Для идентификации могут быть применены цветные реакции.
Количественное определение препаратов выполняют методом неводного титрования, используя общий принцип определения гидрохлоридов органических оснований. Для определения препаратов в лекарственных формах рекомендована унифицированная экстракци-онно-фотометрическая методика (реактив — метиловый оранжевый).
Промедол и циклодол хранят по списку А в хорошо укупоренной таре. Промедол используют как заменитель морфина, циклодол применяют для лечения паркинсонизма.
Производное пиперазина. Пиперазин в виде гексагидрата используют для получения уродана, а пиперазина адипинат и дитразина цитрат — в качестве антигельминтиков.
Это — белые кристаллические вещества без запаха. Пиперазина адипинат растворим в воде, практически не растворим в этаноле, дитразина цитрат — очень легко растворим в воде и трудно — в этаноле. В других органических растворителях препараты практически не растворимы.
Подлинность пиперазина адипината устанавливают, идентифицируя наличие адипиновой кислоты и пиперазина. Адипиновая кислота выпадает в осадок после действия на 5%-ный раствор препарата концентрированной соляной кислотой. Температура плавления осадка 151—154 "С. Пиперазин обнаруживают, действуя на аналогичный раствор разведенной соляной кислоты и 30%-ным раствором нитрита натрия. При нагревании до удаления оксидов азота образовавшийся осадок (после промывания и высушивания) должен иметь температуру плавления 157—159°С. Подлинность дитразина цитрата устанавливают по ИК-спектру предварительно выделенного основания, а также по температуре плавления полученного из основания дитразина (около 152 °С).
Количественное определение пиперазина адипината выполняют гравиметрическим методом. Оно основано на осаждении его хромовой кислотой при охлаждении льдом. Дитразина цитрат определяют методом неводного титрования, растворяя ледяной уксусной кислотой (титрант — 0,1 М раствор хлорной кислоты, индикатор — кристаллический фиолетовый).
Хранят препараты в хорошо укупоренной таре, дитразина цитрат — по списку Б. Применяют в качестве антигельминтиков.
Производные пиримидина. Производные барбитуровой кислоты. Пиримидин (шестичленный гетероцикл с двумя атомами азота) составная часть структуры молекул синтетических и биологически активных природных веществ (алкалоидов, витаминов). Из его синтетических соединений широко применяют производные барбитуровой кислоты или циклические уреиды. В отличие от ациклических уреи-юв они представляют собой продукты конденсации полного амида угольной кислоты (мочевины) с производными малоновой кислоты. Применяемые в лечебной практике производные барбитуровой кисло-гы можно разделить на две группы: барбитураты (лактамная форма) и натриевые соли барбитуратов (лактимная форма).
Барбитураты (барбитал, фенобарбитал, бензонал) и их натриевые ;оли {барбитал-натрий, этаминал-натрий, гексенал, тиопенталчш-лрий) различаются по характеру радикалов.
Синтез этих препаратов состоит из двух этапов: вначале получают соответствующий эфир малоновой кислоты, затем осуществляют его конденсацию с мочевиной (в присутствии алкоголята натрия в среде абсолютного спирта).
Барбитураты представляют собой белые кристаллические порошки без запаха, практически не растворимы или очень мало растворимы (барбитал) в воде, растворимы или трудно растворимы в этаноле и эфире (фенобарбитал легко растворим в этаноле). Водные и спиртовые растворы имеют кислую реакцию. Барбитал и фенобарбитал трудно растворимы, а бензонал — легко в хлороформе. Натриевые соли — мелкокристаллические порошки или сухая пористая масса (тиопентал-нитрий — желтоватого цвета со слабым запахом серы). Они гигроскопичны, растворимы или очень легко растворимы в воде и этаноле (за исключением барбитал-натрия, который мало растворим в этаноле), практически не растворимы в эфире. Водные растворы имеют щелочную реакцию.
Для идентификации барбитуратов могут быть использованы образования моно- и дизамещенных комплексов с солями меди (II) в присутствии пиридина. Комплексы имеют лиловую окраску. Все барбитураты и их натриевые соли образуют с ионом кобальта комплексные соединения, окрашенные в сине-фиолетовый цвет (в присутствии хлорида кальция). Цветная реакция с раствором сульфата меди (II) позволяет отличать препараты друг от друга: барбитал дает синее окрашивание и осадок красно-сиреневого цвета; фенобарбитал — осадок бледно-сиреневого цвета; бензонал — серо-голубое окрашивание, переходящее в сиреневое; барбитал-натрий — синее окрашивание, затем выпадает осадок красно-сиреневого цвета; этаминал-натрий — осадок голубого цвета; гексенал — голубое окрашивание, переходящее в ярко-синее, затем выпадает белый осадок; тиопентал-натрий — желто-зеленое окрашивание со взвешенным осадком. Барбитураты могут быть обнаружены и с помощью общих цветных реакций.
Для натриевых солей ГФ рекомендует выполнять испытание, основанное на нейтрализации препаратов разведенной соляной кислотой. Выпавший осадок отфильтровывают, промывают водой, сушат и определяют его температуру плавления. Кроме того, обнаруживают ион натрия (по окраске натрия). Для отличия препаратов друг от друга можно использовать и реакции на функциональные группы.
Количественно по ГФ барбитураты определяют методом нейтрализации в среде неводных растворителей: растворяют в диметилфор-мамиде или смеси диметилформамида и бензола и титруют 0,1 М раствором гидроксида натрия (в смеси метанола и бензола, индикатор — тимоловый синий). Количественно определение барбитуратов и их солей можно выполнить и аргентометрическим методом, а также спектрофотометрией.
Препараты хранят по списку Б в хорошо укупоренной таре — в банках из темного стекла, в защищенном от света месте (фенобарбитал и бензонал). Применяют в качестве снотворных и наркотических средств, а бензонал — как противоэпилептическое средство.
Производные гексагидропиримидиндиона. К этой группе относится гексамидин, сходный по химической структуре с фенобарбиталом. Его синтезируют путем взаимодействия диамида фенилэтилмалоно-вой кислоты с муравьиной кислотой при нагревании. Практически не растворим в воде, мало растворим в этаноле и ацетоне.
Подлинность гексамидина устанавливают по УФ-спектру раствора в этаноле (растворяя при нагревании). Имеет три максимума поглощения ~ при 252, 258 и 264 нм. При его нагревании в пробирке с кристаллическим гидроксидом натрия образуется аммиак, карбонат натрия, натриевая соль фенилэтилуксусной кислоты и, в отличие от барбитуратов, формальдегид. Количественно препарат определяют методом Кьельдаля, устанавливая его содержание по азоту.
Хранят по списку Б в хорошо укупоренной таре. Применяют подобно бензоналу в качестве противосудорожного препарата. Выраженным снотворным действием не обладает.
Производные урацила. Изура1гдла(1,2,3,4-тетрагидропиримидинди-он) синтезируют фторурацил, фторафур, калия оротат, метилурацил. Синтез основан на циклизации алифатических соединений. Это — белые (фторурацил с желтоватым оттенком) кристаллические вещества без запаха, мало растворимы в воде и органических растворителях.
Объективными константами, подтверждающими подлинность препаратов, являются максимумы светопоглощения и значения удельных показателей поглощения в растворах кислот и щелочей при длине волны 285 нм (калия оротат), 265 (фторурацил), 270 (фторафур) и 275 нм (метилурацил).
Производные урацила в тех условиях, что и барбитураты, образуют окрашенные в фиолетовый цвет соединения с солями кобальта, а также белые осадки с растворами нитрата серебра и дихлорида ртути. Наличие урацила обнаруживают различными химическими реакциями: по обесцвечиванию бромной воды (метилурацил, фторурацил), образованию крас но-оранжевого осадка под действием раствора л-нитродиазобензола (метилурацил).
Для испытания подлинности фторафура применяют реакцию щелочного гидролиза. Фгорид-ионы во фторурациле обнаруживают после предварительной минерализации со смесью для спекания, после чего осадок растворяют и при рН 4,0-5,0 действуют раствором хлорида кальция (появляется белая опалесценция). Калия оротат подобно пуриновым соединениям дает положительную мурексидную пробу. Ее выполняют, выпаривая на водяной бане смесь препарата с пергидролем и соляной кислотой до образования малиново-красного окрашивания. Отличить калия оротат от пуринов можно по цветной реакции с хлоридом железа (III) — появляется красновато-коричневое окрашивание.
Существует ряд методов для количественного определения препаратов. Фторурацил можно определить косвенно титритометрическим методом, действуя 0,1 М раствором гидроксида натрия (индикатор — феноловый красный). Количественное определение фторафура выполняют бромидброматометрическим методом, основанным на способности производных урацила вступать в реакции галогенирования.
Калия оротат определяют после предварительного прокаливания точной навески в платиновом тигле при 600°С до получения белого осадка карбоната калия, который растворяют в воде и титруют 0,1 M раствором соляной кислоты (индикатор — бромфеноловый синий). Метилу-рацил, как и фторурацил, определяют подобно барбитуратам, используя в качестве растворителя диметилформамид (титрант — 0,1 М раствор гидроксида натрия в смеси метанола и бензола, индикатор — раствор тимолового синего в диметилформамиде). Кроме того, для определения производных урацила используют спектрофотометрию, ТСХ, ВЭЖХ и другие методы.
Фторурацил и фторафур хранят по списку А в защищенном от света месте, калия оротат — в обычных условиях, а метилурацил — по списку Б в сухом месте. Фторурацил и фторафур применяют как противоопухолевые средства, калия оротат — как анаболический препарат, а метилурацил — как стимулятор лейкопоэза.
Витамины пиримидинотиазолового ряда и их производные. Препараты тиамина. Основу химической структуры тиамина составляют два гетероцикла — пиримидин и тиазол, которые связаны между собой метиленовой группой, отсюда тиамин и относят к этой группе витаминов. В лечебной практике используют тиамина бромид и тиамина хлорид. Синтез тиамина состоит из трех этапов: синтез пиримидиновой части молекулы, синтез тиазолового цикла и связывания их между собой. Связывание циклов в одну молекулу осуществляют сплавлением при 100—120 °С либо нагреванием в органическом растворителе, например в бутиловом спирте.
Это — белые или с желтоватым оттенком кристаллические вещества со слабым характерным запахом, легко растворимы в воде, мало — в этиловом спирте, практически не растворимы в других органических растворителях.
Подлинность препаратов можно подтвердить по УФ-спектрам. Так, 0,0015 %-ный раствор тиамина бромида в 0,1 М растворе соляной кислоты имеет максимум поглощения в области 246 нм. Идентифицируют препараты с помощью реакции, основанной на окислении тиамина в щелочной среде (реакция тиохромной пробы). Тиохром из водных растворов извлекают бутиловым или изоамиловым спиртом. Эти растворы при УФ-облучении имеют характерную синюю флуоресценцию, исчезающую при подкислении и вновь возникающую при подщелачивании. Реакцию образования тиохрома используют и для количественного флуориметрического определения тиамина. Препараты тиамина из растворов количественно осаждаются некоторыми осадительными (общеалкалоидными) реактивами (кремневольф-рамовой, фосфорновольфрамовой, пикролоновой кислотами и др.). Реакция с кремневольфрамовой кислотой рекомендуется для гравиметрического и фотонефелометрического определения препаратов тиамина. Тиамина хлорид количественно определяют методом неводного титрования. Растворитель — безводная уксусная кислота, титрант — 0,1 М раствор хлорной кислоты, индикатор — кристаллический фиолетовый. Тиамина бромид количественно определяют способом, основанным на нейтрализации гидробромида с последующим аргентометрическим титрованием суммы бромид-ионов. Имеются и другие методы.
Препараты хранят в герметически закрытой таре без контакта с металлами, предохраняют от действия света и влаги. Назначают при нарушении функции нервной системы и других проявлениях гиповитаминоза.
Фосфорные эфиры тиамина и его производные. Наличие спиртового гидроксила в молекуле тиамина позволяет синтезировать его моно- и трифосфорные эфиры. В лечебной практике применяют фосфотиа-мин, кокарбоксилазы гидрохлорид для инъекций и бенфотиамин.
Бенфотиамин практически не растворим в воде и этаноле, растворим в 1%-ном растворе гидроксида натрия. Фосфотиамин и кокарбоксилазы гидрохлорид легко растворимы в воде, практически не растворимы в этаноле.
Наиболее объективная идентификация, позволяющая не только дать групповую оценку, но и отличить их друг от друга, может быть достигнута с помощью ИК-спектроскопии. ИК-спектры препаратов характеризуются наличием семи основных полос в области 3500— 1500 см"1, причем у тиамина хлорида и тиамина бромида они существенно различаются по интенсивности, а фосфорные эфиры имеют свои четкие характерные полосы. Общее испытание подлинности препаратов основано на обнаружении фосфора, содержащегося в их молекулах. Подлинность кокарбоксилазы гидрохлорида и фосфотиа-мина подтверждают также, обнаруживая тиамин по реакции образования тиохрома. Этой же реакцией подтверждают бенфотиамин, но выполняют после предварительного нагревания препаратов в течение 20 мин на кипящей водяной бане.
Количественное определение бенфотиамина и фосфотиамина выполняют спектрофотометрическим методом. Содержание кокарбоксилазы гидрохлорида устанавливают путем нейтрализации навески препарата ОД М раствором гидроксида натрия (индикатор — тимол-фталеин).
Хранят препараты в сухом, защищенном от света месте. Кокарбоксилазы гидрохлорид для инъекций хранят в ампулах при температуре не выше 5 °С. Применяют препараты, как аналоги препаратов тиамина, а кокарбоксилазу — для инъекций при нарушениях сердечно-сосудистой деятельности и коронарного кровообращения.
Производные бензофурана и бензопирана. Фурани у-пиран способны образовывать конденсированные системы с ядрами бензола, например бензофуран (кумарон) и 1,4-бензопиран. Ядра бензола а-пирана образуют конденсированную гетероциклическую систему — 1,2-бензопиран. Производные 1,4- и 1,2-бензопирана, содержащие кетонные группы, называют соответственно у-хромон и кумарин.
Производные 4-оксикумарина. Препараты содержат в молекуле одну или две гетероциклические системы кумарина с оксигруппой в положении 4. К ним относятся фепромарон и неодикумарин. Исходным продуктом синтеза неодикумарина служит 4-оксикумарин и этиловый эфир глиоксалевой кислоты, который получают из щавелевой кислоты. Это — белые или с кремовым оттенком кристаллические вещества. Очень мало (неодикумарин) или практически не растворимы (фепромарон) в воде, мало растворимы в этаноле, растворимы в растворах гидроксидов щелочных металлов (поскольку являются фенолами). Различаются по растворимости в ацетоне, в котором неодикумарин умеренно растворим, а фепромарон — растворим.
Подлинность препаратов можно установить по ИК-спектрам, а также с помощью УФ-спектрометрии. Испытание на подлинность и количественное определение основаны на использовании химических свойств, обусловленных наличием в их молекулах тех или иных функциональных групп (фенольного гидроксила, лакгонного цикла, этоксильной и кетонной групп), а также деструкцией молекул. При сплавлении препаратов щелочью происходит разрыв лакгонного кольца с образованием салицилат-иона, который обнаруживают по выпадению осадка салициловой кислоты после подкисления фильтрата соляной кислотой или цветной реакцией с хлоридом железа (III) (сине-фиолетовое окрашивание).
Для идентификации и количественного определения препаратов используют способность входящих в молекулы фенольных гидроксилов к этерификации.
Препараты хранят по списку А в хорошо укупоренной таре, предохраняющей от действия света и влаги. Применяют в качестве антикоагулянтов непрямого действия (антивитаминов группы К).
Препарат карбокромен. Карбокромен легко растворим в воде, этаноле и хлороформе. Подлинность устанавливают по УФ-спектру 0,001%-ного раствора в этаноле, который имеет максимум поглощения при 322 нм и оптическую плотность 0,41±0,02. Количественное определение выполняют в среде ледяной уксусной кислоты в присутствии ацетата ртути (II), используя в качестве титранта 0,1 М раствор хлорной кислоты (индикатор — кристаллический фиолетовый).
Хранят по списку Б в сухом, защищенном от света месте. Применяют при ишемической болезни сердца.
Производные хромана. Токоферолы (витамины группы Е). Источник получения их — масло зародышей пшеницы или кукурузы, которое подвергают гидролизу, а неомыляемый осадок (около 5 %) растворяют в спирте, хлороформе или дихлорэтане. Затем растворитель удаляют, остаток растворяют в ацетоне и метиленовом спирте и при —10 "С выкристаллизовывают стерины. Остаток стери-нов осаждают дигитонином. Смесь токоферолов осаждают и разделяют хроматографическим методом.
Выделены из природных источников или получены синтетически семь различных веществ, обладающих Е-витаминной активностью (токоферолов). По химическому строению они представляют собой производные хромана (бензо-у-дигидропирана), который включает ядро бензола, конденсированное с гидрированным ядром у-пирана. Основой химической структуры всех семи токоферолов является то-кол. Отличаются токоферолы числом метальных групп, существенно влияющих на биологическую активность.
Фармакопейным препаратом является <х-токоферола ацетат. Это — маслянистая жидкость (в отличие от ретинола, кальциферола), практически не растворима в воде, легко растворима в этаноле и очень легко — в других органических растворителях и растительных маслах.
Подлинность токоферола ацетата подтверждают УФ-спектрофо-тометрией. УФ-спектр раствора препарата в этаноле имеет максимум поглощения в области 285 нм и минимум поглощения при 254 нм. Наличие ацетильного радикала подтверждают образованием этила-цетата, имеющего характерный запах. Для идентификации и фотоколориметрического анализа используют реакцию окисления, сопровождающуюся образованием окрашенных веществ, зависящих от окислителя. Например, реакция с концентрированной азотной кислотой дает красно-оранжевый цвет. Эта реакция рекомендована ГФ для испытания подлинности. При окислении гексацианоферратом (III) калия в щелочной среде образуется окрашенный ди-а-токоферол. Под действием солей церия (IV), железа (III) токоферол окисляется до а-, n-токоферилхинона (желтое окрашивание). Эту химическую реакцию используют для количественного определения препарата по ГФ. Определение основано на кислотном гидролизе (кипячением с обратным холодильником в присутствии серной кислоты). Затем выделившийся токоферол титруют сульфатом церия (индикатор — дифениламин) до появления сине-фиолетового окрашивания. Этот метод используют и для определения примеси.
Хранят препарат в герметически закрытых банках темного стекла. Назначают при Е-витаминной недостаточности и других патологиях.
Флавоноиды (витамины группы Р). К группе витаминов Р относится большое количество веществ — флавоноидов, которые распространены в природе либо в свободном состоянии, либо в виде глико-зидов, главным образом в плодах шиповника, цитрусовых, незрельгх грецких орехах, ягодах черной смородины, рябины и др. По химическому строению — производные флавана (2-фенилхромана), содержащего в молекуле конденсированную систему хроман (дигидро-бензо-у-пиран) и связанное с ним бензольное ядро (в положении 2). Из индивидуальных веществ, обладающих Р-витаминной активностью, используют препарат рутин, относящийся по химической структуре к гликозидам.
Препарат растворим в разбавленных растворах едких щелочей. Наличие в молекуле фенольных гидроксилов легко установить цветной реакцией с хлоридом железа (III) — темно-зеленое окрашивание. ГФ рекомендует для испытания подлинности цветную реакцию с раствором гидроксида натрия (желто-оранжевое окрашивание). Подлинность рутина подтверждают и другими реакциями, например кислотным гидролизом с серной кислотой и др. Кроме того, используют УФ-спектрофотометрию (два максимума светопоглощения при длине волн 259+1 и 262,5±1). Этот метод используют для количественного определения, а также для определения чистоты.
Хранят препарат в хорошо укупоренной таре, предохраняя от све-I. Назначают при заболеваниях, связанных с нарушением проницаемости сосудов и поражением капилляров.
Сходен по свойствам с рутином препарат кверцетин, назначаемый в тех же случаях, что и рутин.
Производные индола. Молекула индола (бензипиррола) представляет собой конденсированную систему, состоящую из бензольного и пирролового циклов. Индол — структурная основа многих алкалоидов, в том числе физостигмина, резерпина и др.
Препараты физостигмина и его синтетических аналогов. Физостиг-мин (эзерин) был впервые выделен из калабарских бобов (1864 г.). Растительное сырье содержит около 0,1 % алкалоидов. Фармакопейный препарат физостигмина салицилат трудно растворим в воде, растворим в этаноле, мало — в эфире, легко —в хлороформе.
Для идентификации может быть использована цветная реакция при выпаривании препарата с аммиаком (осадок синего цвета, рекомендация ГФ). Используют и другие реакции: гидролиза в щелоч-юй среде, с концентрированной серной кислотой, с растворами хло-)ида железа (III). Количественно препарат определяют по ГФ мето- нейтрализации в смеси, состоящей из этанола и хлороформа (индикатор — фенолфталеин).
Хранят препарат по списку А в хорошо укупоренных банках оранжевого стекла в защищенном от света месте. Назначают в качестве антихолинэстеразного, миотического средства.
Из большого количества синтетических аналогов физостигмина в лечебной практике применяют прозерин. Препарат очень легко растворим в воде и хлороформе. Подлинность подтверждают по УФ-спектру 0,04%-ного раствора — имеет максимум светопоглощения при 260 и 266 нм. Количественное определение основано на реакции гидролиза. Выполняют ее в колбе Кьельдаля, отгоняя выделившийся диметиламин в приемник, содержащий раствор борной кислоты. Образующиеся метаборат и тетраборат диметиламина титруют 0,1 М раствором соляной кислоты. Кроме того, для определения можно использовать йодометрию (титрант — 0,1 М раствор йода).
Хранят прозерин по списку А. Применяют как синтетический аналог физостигмина.
Резерпин содержится вместе с другими алкалоидами в корнях индийского растения раувольфии. От других алкалоидов его вьщеляют с помощью адсорбционной хроматографии. Основу химической структуры резерпина составляют индол, дегидрохинолизидин или гидрированный карболин.
Фармакопейный препарат резерпин представляет собой левовра-щающий оптический изомер основания резерпина. Препарат очень мало растворим в воде и этаноле, но легко растворим в хлороформе и уксусной кислоте. Подлинность по ГФ устанавливают с помощью спектрофотометрии. Величина оптической плотности 0,002%-ного спиртового раствора в максимуме поглощения 268 им и в интервале длин волн 288—295 нм. Препарат дает окрашенные реакции с концентрированной серной кислотой (желтое), азотной (желтое, переходящее в кирпично-красное), со смесью этих кислот (желто-зеленое), с реактивом Фреде (синее, переходящее в зеленое). Ряд цветных реакций резерпин дает с концентрированной серной кислотой в присутствии других реактивов. При добавлении реактива из хлорида железа (III) и фосфорной кислоты желтая окраска переходит в ярко-синюю.
Количественное определение выполняют методом неводного титрования в ледяной уксусной кислоте. Препарат можно также оттитровать в спиртовой среде с помощью 0,1 М соляной кислоты (индикатор — метиловый красный).
Хранят препарат по списку А в хорошо укупоренных банках оранжевого стекла, в прохладном, защищенном от света месте. Назначают в качестве нейролептического и гипотензивного средства.
К числу производных индола можно отнести препарат адроксон. По химическому строению это семикарбазон. Вещество оранжевого цвета, очень мало и медленно растворимое в воде и этаноле. Оказывает гемостатическое действие при капиллярных кровотечениях.
Производные хинолина. Хинолин —конденсированная система, образованная ароматическим бензольным ядром и пирими-диновым циклом. Содержится в молекуле хинина. Разнообразными по действию оказались алкалоиды (хинин, хинидин) и синтетические производные 8-оксихинолина и 4-аминохинолина.
Производные 8-оксихинолина. В качестве антисептических средств применяют хинозол и хиниофон.
Синтез хинозола осуществляют из фенола. Производные 8-оксихинолина — кристаллические вещества желтого (лимонно-желтого — хинозол) цвета. Хинозол легко растворим в воде, легко растворим в этаноле, а хиниофон растворим в воде с выделением диоксида углерода. Оба практически не растворимы в эфире и хлороформе.
Для испытания подлинности ГФ рекомендует общую реакцию, основанную на наличии фенольных гидроксилов. При действии раствором хлорида железа (III) растворы препаратов приобретают зеленое или зеленовато-зеленое окрашивание.
Количественно хинозол определяют комплексонометрическим методом (после перевода в основании). Основание растворяют в этаноле при 60 "С, осаждают избытком 0,1 М раствора сульфата цинка и добавляют буферный раствор (рН 10,0). Осадок растворяют в хлороформе, прибавляют воду и оттитровывают избыток сульфата цинка 0,1 М раствором трилона Б (индикатор — эриохром черный Т). Можно хинозол определить и обратным броматометрическим методом.
При количественном определении хиниофона последовательно устанавливают содержание в препарате йода и гидрокарбоната натрия. Препарат должен содержать 24,5—27,0 % йода и 24—26 % гидрокарбоната натрия.
Препараты хранят в хорошо укупоренной таре — в банках оранжевого стекла, хиниофон — по списку Б. Используют в качестве антимикробных средств.
Хинозол входит в состав противозачаточных средств (контрацеп-тин Т и химоцептин). К этой группе препаратов относится также энтеросептол, 5-НОК (нитроксолин).
Производные 4-аминохинолина. Из этой группы применяют хин-гамин и трихомонацид. Принцип их синтеза основан на предварительном получении ядра хинолина, содержащего метоксигруппу или атом хлора. Затем к этому ядру присоединяют радикал диэтилами-ноалкиламин и превращают основание препарата в соль.
Трихомонацид — желтого, а хингамин — белого цвета. Хорошо растворимы в воде и очень мало или практически не растворимы в органических растворителях. Для идентификации используют спек-трофотометрию в УФ-области. Подлинность подтверждают реакциями осаждения (при действии растворами гидроксидов выпадают осадки оснований препаратов). ГФ при установлении подлинности рекомендует обнаруживать фосфат-ионы. Для этого используют реакцию с молибдатом аммония.
Количественно препараты определяют методом нейтрализации (растворы имеют кислую реакцию). ГФ рекомендует для этого метод неводного титрования. Титруют 0,1 М раствором хлорной кислоты в среде ледяной уксусной кислоты (индикатор — кристаллический фиолетовый).
Хранят препараты по списку Б в хорошо укупоренной таре из оранжевого стекла, в защищенном от света месте. Трихомонацид применяют при трихомонозе, а хингамин — для лечения и профилактики малярии.
Алкалоиды, производные хинолина. Важный природный источник получения производных хинолина — кора хинного дерева, содержащая алкалоиды (2~15 %). В 1814 г. из нее выделен хинин, а затем и другие 26 алкалоидов. Структурной основой большинства алкалоидов служат две гетероциклические системы: хинолин (конденсированное ядро пиридина и бензола) и хинуклидин (конденсированная система из двух пиперидиновых циклов).
В ГФ включены три препарата: хинина дигидрохлорид, хинина гидрохлорид и хинина сульфат. Это — бесцветные кристаллические вещества, без запаха, отличающиеся очень горьким вкусом. Под действием света постепенно желтеют. Являются левовращающими оптическими изомерами. Дигидрохлорид — очень легко растворим, гидрохлорид — растворим, а сульфат — мало растворим в воде. Хинина гидрохлорид лучше, чем сульфат и дигидрохлорид, растворим в спирте и хлороформе.
Общей реакцией на хинин является талейохинная проба, которая заключается в окислении хинина бромной водой до образования о-хинона. Действие аммиака приводит к образованию дииминопро-изводных о-хиноидной структуры, окрашенных в изумрудно-зеленый цвет. Другие алкалоиды, не содержащие в молекуле метоксиль-ной группы, этой реакции не дают. Характерная особенность хинина — наличие флуоресценции в растворе серной кислоты.
Для идентификации препаратов хинина можно использовать осадительные (общеалкалоидные) реактивы на органические основания: пикриновую кислоту, дихлорид ртути, танин, фосфорновольфрамо-вую кислоту.
Количественное определение препаратов хинина по ГФ выполняют гравиметрическим методом. Он основан на осаждении основания хинина из препаратов (раствором гидроксида натрия), четырехкратном извлечении его хлороформом и взвешивании его остатка, полученного после отгонки хлороформа. Международная фармакопея III издания рекомендует для определения препаратов хинина метод неводного титрования в смеси ледяной уксусной кислоты и уксусного ангидрида (5:2). При определении хинина гидрохлорида и дигидро-хлорида прибавляют раствор ацетата ртути в уксусной кислоте и титруют 0,1 М раствором хлорной кислоты (индикатор — кристаллический фиолетовый). Есть и другие методы.
Препараты хранят в хорошо укупоренной таре. Применяют в качестве противомалярийных средств.
Правовращающим оптическим изомером хинина является алкалоид хинидин, также содержащийся в хинной коре. В практике используют хинидина сульфат. Для идентификации препарата используют те же реакции, что и для оценки препаратов хинина. Назначают хинидин сульфат в качестве антиаритмического средства.
Производные изохинолина. Изохинолин отличается от хинолина расположением атома азота в гетероциклической системе: у хинолина — в положении 1, у изохинолина — в положении 2. Из многочисленных алкалоидов, производных изохинолина, в лечебной практике применяют в основном производные 1-бензилизохиноли-на, морфинана и апорфина. Источник получения алкалоидов, производных 1-бензилизохинолина и морфинана, — опий (млечный сок незрелых плодов мака снотворного — Papaver somniferum). В опии содержится 25 различных алкалоидов. Они составляют 20—25 % общей массы опия и находятся в основном в виде солей меконовой, молочной и серной кислот. Алкалоиды из опия извлекают теплой водой (50—55 °С), затем фильтрат концентрируют в вакууме при 60—70 "С. Смесь алкалоидов разделяют различными методами.
Алкалоиды, производные бензилизохинолина. Фармакопейным препаратом папаверина является папаверина гидрохлорид (выделен из опия еще в 1884 г.)- Он медленно растворим в воде, мало — в этаноле, растворим в хлороформе.
Подлинность препарата устанавливают по ИК-спектру, который должен соответствовать спектру-сравнению, а также по УФ-спект-рам растворов препарата в этаноле (280, 315, 325, 238 нм) и в 0,01 М растворе соляной кислоты (284 и 309 нм). Идентифицировать препарат (в 0,0025%-ном растворе) можно по второй производной УФ-спектра поглощения, найденной методом численного дифференцирования. Этот метод более объективен, чем анализ по положениям максимумов поглощения. Кроме того, используют специальные реактивы на алкалоиды. Применение некоторых из них основано на окислении папаверина. Под действием концентрированной азотной кислоты препарат приобретает желтое окрашивание, которое переходит в оранжевое при нагревании на водяной бане. При нагревании препарата в смеси с концентрированной серной кислотой появляется фиолетовое окрашивание. Окрашенные продукты образуются и при действии реактивом Марки. При последующем добавлении бромной воды и раствора аммиака появляется фиолетовый осадок, который после растворения в этаноле окрашивает раствор в фиолетово-красный цвет. Реакция является специфичной и ее используют при фотоколориметрическом определении папаверина.
Существуют и другие цветные реакции, а также некоторые осадочные реакции с использованием бромной воды (желтый осадок), спиртового раствора йода (темно-красные кристаллы), пикриновой кислоты (желтый пикрат) и др. По ГФ подлинность препарата устанавливают по хлорид-иону и выделению под действием ацетата натрия осадка основания папаверина, после очистки и высушивания которого температура плавления должна быть 145—147 °С.
Количественно препарат определяют подобно другим солям алкалоидов — методом неводного титрования или методом нейтрализации в спиртовой среде (индикатор — фенолфталеин).
Хранят препарат по списку Б в хорошо укупоренной таре, чтобы не допустить его окисления. Применяют при спазмах кровеносных сосудов, гладких мышц органов грудной полости, бронхиальной астме и т. д.
Очень сходен с папаверина гидрохлоридом по химическому строению и действию препарат дротаверина гидрохлорид, или но-шпа. Применяют в тех же случаях, что и папаверин.
Производным изохинолина является препарат изодибут, применяемый при сахарном диабете.
Алкалоиды, производные морфинана (фенантренизохинолина) и их синтетические аналоги. ./V-метил производные морфинана — алкалоиды морфин и кодеин. Кроме ядра морфинана они имеют фурановый цикл. Содержание кодеина в опии невелико (0,2—2 %), поэтому его получают методом метилирования морфина. Полусинтетический аналог морфина — этилморфин получают также из морфина, действуя на него этилирующими агентами (диэтилсульфатом или этилброми-дом). Фармакопейные препараты — морфина гидрохлорид, этилмор-фина гидрохлорид, кодеин, кодеина фосфат — белые кристаллические вещества без запаха, горького вкуса. Производные морфина и их синтетические аналоги могут существовать в виде оптических изомеров и рацематов. За исключением кодеина (медленно и мало растворимого в воде) препараты легко или растворимы в воде, морфина гидрохлорид медленно растворим. В этаноле и хлороформе легко растворимо только основание кодеина, остальные — трудно и мало растворимы. В качестве одной из характеристик морфина гидрохлорида ГФ рекомендует устанавливать удельное вращение в растворах.
Для идентификации препаратов, а также для количественного определения широко используют спектрофотометрию: для морфина гидрохлорида растворитель вода или 0,1 М раствор соляной кислоты при 285 нм, а также 0,1 М раствор гидроксида натрия при 297 нм; для кодеина растворитель этанол при 284 нм или 0,01 М раствор соляной кислоты при 285 нм; для кодеина фосфата растворитель этанол при 284 нм и вода при 285 нм; для этилморфина растворитель вода при 285 нм и этанол при 284 нм.
Для идентификации производных морфинана применяют реакцию образования апоморфина, происходящую в результате воздействия на них концентрированных серной или соляной кислот. Кроме того, для идентификации препаратов используют различные цветные реакции и осадителъные (общеалкалоидные) реактивы.
Количественное определение препаратов по ГФ выполняют методом неводного титрования. Гидрохлориды титруют 0,1 М раствором хлорной кислоты в среде безводной уксусной кислоты после добавления ацетата ртути (II) и индикатора — кристаллического фиолетового. Кодеина фосфат титруют в среде безводной уксусной кислоты 0,1 М раствором хлорной кислоты. Определять препараты можно также методом нейтрализации в водно-спиртовой среде (индикатор — фенолфталеин) с добавлением хлороформа. Существует способ обратного аргентометрического определения морфина гидрохлорида (по хлорид-иону).
Морфина и этилморфина гидрохлориды хранят по списку А, а кодеин и его фосфат — по списку Б в хорошо укупоренной таре, предохраняющей от действия света. Морфина гидрохлорид применяют как анальгетик, а кодеин, его фосфат и этилморфина гидрохлорид — в качестве средств, успокаивающих кашель.
Пролонгированной формой морфина является морфилонг, состоящий из морфина гидрохлорида (5,5 г) и поливинилпирролидона (330 г).
Препараты относятся к наркотическим средствам, поэтому их хранят и отпускают в строгом соответствии с существующими правилами.
Алкалоиды, производные апорфина и их синтетические аналога. Из производных апорфина в лечебной практике применяют апоморфина гидрохлорид и глауцина гидрохлорид. Апоморфин — синтетическое вещество, производное морфина, который получают путем нагревания (140—150 °С) с концентрированной соляной кислотой для расщепления фуранового цикла. Глауцин выделяют из травы мачка желтого (семейства маковых). Это — кристаллические вещества, на воздухе и свету окисляются. Апоморфина гидрохлорид трудно раствором в воде, а глауцина гидрохлорид — медленно растворим, с образованием слегка мутных растворов.
Подлинность апоморфина устанавливают реакциями окисления. Из окислителей используют, например, азотную кислоту, от одной капли которой кристаллы препарата окрашиваются в кроваво-красный цвет. При действии 0,1 М раствора йода в присутствии эфира и 5%-ного раствора гидрокарбоната натрия водный слой раствора препарата приобретает зеленое окрашивание, а эфирный — красно-фиолетовое. При действии раствором формальдегида в концентрированной серной кислоте на кристаллы глауцина гидрохлорида появляется интенсивное зеленое окрашивание, которое последовательно переходит в сине-зеленое, сиреневое, а затем в вишневое. Для подтверждения подлинности глауцина гидрохлорида используют осадительные реактивы. При растворении 0,002 г препарата на часовом стекле в трех каплях воды и добавлении двух капель реактива Драгендорфа образуется оранжево-красный осадок. Водный раствор препарата с реактивом Майера образует белый осадок. Выделенное из препарата основание глауцина должно иметь температуру плавления 115—119 "С. Препараты дают положительные реакции на хлориды.
Для испытания подлинности и количественного определения препарата используют метод УФ-спектрофотометрии. Апоморфина гидрохлорид идентифицируют по максимуму поглощения при 275 нм (растворитель —0,1 М раствор соляной кислоты), а определяют при длине волны 272 нм (растворитель — вода или 0,01 М раствор соляной кислоты). Глауцина гидрохлорид определяют при 300 нм (растворитель — вода). Фотометрическое определение глауцина выполняют, используя реакции с фосфорномолибденовой и азотной кислотами, а также с реактивом Марки.
Количественное определение препаратов проводят методом неводного титрования (индикатор — кристаллический фиолетовый), используя растворитель ледяную уксусную кислоту и титрант 0,1 М раствор хлорной кислоты. Титруют в присутствии ацетата ртути (II). Можно титровать и без ацетата ртути, но тогда в качестве растворителя используют смесь муравьиной кислоты и уксусного ангидрида (1:10). Количественное определение препаратов можно выполнять и другими методами.
Апоморфина гидрохлорид хранят по списку А, а глауцина гидрохлорид — по списку Б, в сухом, защищенном от света месте. Апоморфина гидрохлорид применяют как рвотное средство, а глауцина гидрохлорид — в качестве противокашлевого средства.
Производные хинуклидина. Хинуклидин представляет собой гетероциклическую систему, включающую два пиперидиновых цикла. Его производные оказались весьма активными по отношению к холино- и гнетам иноергическим системам организма. В лечебной практике используют ацеклидин, оксилидин, фенкарол, теме-хин, имехин, квалидил. Исходными продуктами синтеза этих производных являются хинуклидон-3 и 3-оксихинуклидин. Препараты представляют собой соли соляной (оксилидин, фенкарол), бромводо-родной (темехин), салициловой (ацеклидин) кислот. Это — белые кристаллические вещества без запаха, легко (темехин — очень легко) растворимы в воде, растворимы или легко растворимы в этаноле, за исключением фенкарола, который мало растворим в воде и этаноле. Ацеклидин, оксилидин и темехин практически не растворимы в эфире, а фенкарол — в хлороформе. Имехин и ацеклидин легко растворимы в хлороформе.
Подлинность препаратов устанавливают с помощью цветных или осадочных реакций на соответствующие циклы, функциональные группы или анионы связанных кислот. В качестве реактива, образующего окрашенное соединение с хинуклидиновым циклом, можно использовать 2,6-дихлорхинонхлоримин. Он образует продукты конденсации, которые представляют собой извлекаемые хлороформом индофеноль-ные красители. Наличие сложноэфирной группы в ацеклидине и ок-силидине подтверждают с помощью гидроксамовой реакции.
Ацеклидин образует окрашенные продукты взаимодействия с нитритом натрия в уксуснокислой среде при нагревании. При этом происходит окисление как 3-ацетоксихинуклидина, так и связанной с ним салициловой кислоты. На основе этой цветной реакции разработаны способы идентификации и определения ацеклидина. Фенкарол обнаруживают с помощью раствора рейнеката аммония, образующего розовый творожистый осадок, растворимый в ацетоне. При испытании имехина устанавливают наличие четвертичного аммониевого катиона по образованию желтовато-коричневого осадка с раствором натриевой соли 1,2-нафтохинон-4-сульфокислоты.
Для идентификации производных хинуклидина используют реакцию образования ионных ассоциантов с сульфофталеиновыми красителями при определенном значении рН. Ряд красителей дает избирательные цветные реакции. По окраске ионных ассоциантов, образующихся с бромфеноловым синим при различных значениях рН, можно отличить друг от друга оксилидин, квалидил, фенкарол.
Количественное определение препаратов выполняют методом неводного титрования в среде ледяной уксусной кислоты, используя в качестве титранта 0,1 М раствор хлорной кислоты (индикатор — кристаллический фиолетовый). Ацеклидин можно также определить путем нейтрализации связанной салициловой кислоты 0,1 М водным раствором гидроксида натрия (индикатор — фенолфталеин) в присутствии хлороформа; фенкарол — методом экстракционного титрования в кислой среде, используя в качестве титранта 0,01 М раствор лаурилсульфата натрия.
Ацеклидин хранят по списку А, остальные препараты — по списку Б, в хорошо укупоренных банках из оранжевого стекла. Ацеклидин назначают при атониях желудочно-кишечного тракта и мочевого пузыря; оксилидин проявляет успокаивающее и гипотензивное действие, которое оказывает и темехин с имехиноном; фенкарол — противогистаминное (противоаллергическое) действие.
Производные тропана. Тропан представляет собой бицик-лическое основание, включающее два конденсированных цикла: пир-ролидин и пиперидин. Он является основой ряда алкалоидов и их синтетических аналогов. По химическому строению они могут быть разделены на производные спирта тропина и производные оксикис-лоты экгонина (тропин-2-карбоновой кислоты).
Препараты алкалоидов, производные тропана и их синтетические аналоги. К этой группе относятся соли алкалоидов: атропина сульфат, скополамына гидробромид и их синтетические аналоги: гоматропина гидробромид, тропацин и тропафен.
Атропин получают из корней скополии (семейство пасленовых), а также синтетически. Потребность в скополамина гидробромиде удовлетворяется получением его из семян дурмана индейского (семейство пасленовых). Синтез аналогов тропановых алкалоидов осуществляют из тропина по общей схеме синтеза сложных эфиров. Для синтеза гоматропина, тропацина и тропафена берут соответственно миндальную, дифенилуксусную и а-фенил-р-(л-ацетоксифенил)-про-пионовую кислоту или хлорангидриды этих кислот.
Это — белые кристаллические вещества, у тропацина и тропафена допускается слабый кремовый оттенок. Препараты легко растворимы в воде. По растворимости препаратов в хлороформе можно отличить препараты природных алкалоидов от синтетических аналогов.
Для испытания подлинности препаратов используют реакцию Витали—Морена, основанную на их гидролизе и нитровании выделившихся кислот (при выпаривании с концентрированной азотной кислотой). При действии на остаток после выпаривания спиртовым раствором гидроксида калия и ацетона происходит образование окрашенного в фиолетовый цвет соединения хиноидной структуры. Общая реакция на препараты заключается в осаждении оснований из растворов действием гидроксидов щелочных металлов. ГФ рекомендует эту реакцию для установления подлинности атропина сульфата и гоматропина гидробромида, основания которых имеют характерную температуру плавления. Кроме того, используют осадитель-ные реактивы: раствор пикриновой кислоты, раствор йода, реактивы Марки, Драгендорфа и др.
Количественное определение всех препаратов выполняют методом неводного титрования в среде безводной уксусной кислоты (титрант — 0,1 М раствор хлорной кислоты, индикатор — кристаллический фиолетовый). Титрование препаратов (за исключением атропина сульфата) проводят в присутствии ацетата ртути (II), подавляющего диссоциацию галогенид-ионов. Атропина сульфат определяют без ацетата ртути, так как серная кислота ведет себя как основная кислота. Имеются также способы определения препаратов методом нейтрализации в водно-спиртовой среде в присутствии хлороформа, который извлекает образующееся в процессе титрования основание (индикатор-фенолфталеин).
Препараты хранят по списку А, тропафен — по списку Б в хорошо укупоренной таре, предохраняя от света и влаги. Большинство препаратов используется в качестве холинолитиков.
Препараты алкалоидов, производных экгонина. Основу химической структуры этих препаратов составляет оксикислота экгонин. Основным алкалоидом группы является кокаин, выделенный в 1860 г. из южноамериканского растения эритроксилон кока. Синтетический кокаин представляет собой рацемат, из которого выделяют ле-вовращающийся оптический изомер и кристаллизуют в виде гидрохлорида.
Кокаина гидрохлорид — белое вещество, очень легко растворимое в воде и легко в этаноле, растворимо в хлороформе и практически не растворимо в эфире.
ГФ рекомендует для установления подлинности кокаина капельную реакцию с 1%-ным раствором перманганата калия. Образуется кристаллический фиолетовый осадок перманганата кокаина. Препарат можно идентифицировать с помощью общеалкалоидных реактивов (пикриновой кислоты, раствора йода). Едкие щелочи осаждают из растворов препарата основание кокаина. Реакцию Витали—Морена (в отличие от атропина, скополамина и тропафена) кокаин не дает. Хлорид-ион открывают по образованию хлорида серебра.
Количественное определение по ГФ выполняют методом неводного титрования подобно другим гидрохлоридам слабых оснований. Определить препарат можно также нейтрализацией 0,1 М раствором гидроксида натрия его спиртовых растворов в присутствии хлороформа (индикатор — фенолфталеин) или обратным йодометрическим методом после осаждения полийодида кокаина.
Препарат хранят по списку А в хорошо укупоренных склянках оранжевого стекла. Применяют в качестве местного анестетика. К кокаину возникает болезненное пристрастие.
Производные пурина. Пуриновыеалкалоиды. Пурин— конденсированная гетероциклическая система, состоящая из двух циклов: пиримидина и имидазола. В лечебной практике наиболее широко применяют пуриновые алкалоиды кофеин, теобромин, теофиллин (включены в ГФ). Природным источником получения пуриновых алкалоидов служат отходы чайной промышленности (чайная пыль, обрезки листьев и т. д.), содержащие 1—3 % кофеина, и бобы какао. В них содержится также 1,5—2 % теобромина. Разработано несколько способов получения этих алкалоидов. Синтетически пуриновые алкалоиды получают из мочевой кислоты. Вначале получают ксан-тин, а из него — кофеин и теобромин. В ГФ включены также препараты двойных солей пуриновых оснований: кофеин-бензоат натрия и эуфиллин. Кофеин-бензоат натрия получают смешением водных растворов, содержащих 40 % кофеина и 60 % натрия бензоата. Аналогичный способ лежит в основе получения эуфиллина (соль тео-филлинас 1,2-этилендиамином).
Производные пурина — белые кристаллические вещества без запаха, плохо растворимые в воде: кофеин плохо растворим в холодной воде (1:60), теофиллин мало растворим, теобромин практически не растворим. В горячей воде кофеин и теофиллин легко растворимы, теобромин мало растворим. В этаноле алкалоиды плохо растворимы. Кофеин, в отличие от теофиллина и теобромина, легко растворим в хлороформе. Теофиллин и теобромин растворимы в разведенных растворах кислот и щелочей. Кофеин-бензоат натрия легко растворим, эуфиллин растворим в воде. Кофеин-бензоат натрия трудно растворим в этаноле, практически не растворим в эфире и хлороформе.
Общей реакцией для испытания подлинности препаратов является мурексидная проба, основанная на разрушении молекулы пурина при нагревании с окислителем (пероксидом водорода, бромной водой, азотной кислотой и др.) до образования смеси метилированных производных аллоксана и диалуровой кислоты. Взаимодействуя друг с другом, они образуют метилированные производные аллоксантина, которые под действием избытка раствора аммиака приобретают пурпурно-красное окрашивание. Общей реакцией является и действие хлорида ртути (II). При этом образуется белый кристаллический осадок. Подлинность подтверждают и спектрофо-тометрическим способом.
Идентифицировать препараты можно с помощью осадительных реактивов. Кофеин с 0,1%-ным раствором танина образует белый осадок таната кофеина, растворимый в избытке реактива. Раствор кофеина в горячей воде при добавлении 0,1 М раствора йода остается прозрачным, но при добавлении нескольких капель соляной кислоты образуется бурый осадок. Теофиллин образует в этих условиях темно-коричневый осадок. В отличие от кофеина, теофиллин и теобромин обладают кислыми свойствами, что используется для их выявления и количественного определения. Препараты вначале превращают в натриевые соли раствором гидроксида натрия. В качестве реактива, позволяющего отличить препараты (кофеин, теофиллин и теобромин), используют раствор хлорида кобальта. Теобромин образует осадок серовато-голубого цвета, который выпадает после появления быстро исчезающего фиолетового окрашивания. Теофиллин в тех же условиях образует белый с розоватым оттенком осадок. Кофеин, не обладающий кислотными свойствами, не дает положительной реакции ни с ионом кобальта, ни с ионом серебра. Серебряная соль теобромина при нагревании на водяной бане (до 60 °С) образует коричневую желатинообразную массу. Серебряная соль теофиллина представляет собой полупрозрачный студенистый осадок, разжижающийся при нагревании и вновь застывающий при охлаждении. Теофиллин, в отличие от других пуриновых алкалоидов, образует с щелочным раствором нитропруссида натрия характерное зеленое окрашивание, исчезающее после добавлении избытка кислоты. Имеются и другие общие и идентифицирующие реакции.
Чистоту препаратов по ГФ проверяют, устанавливая допустимые пределы примесей посторонних алкалоидов, используя различные реактивы, например Майера (для кофеина).
Количественное определение препаратов основано на использовании их химических свойств. Кофеин можно оттитровать в неводной среде (хлороформ, уксусный ангидрид, бензол) хлорной кислотой (индикатор — кристаллический фиолетовый). При количественном определении теобромина в качестве неводного растворителя используют муравьиную кислоту и уксусный ангидрид (1:10), индикатором служит раствор Судана (III). Для количественного определения теобромина и теофиллина ГФ рекомендует использовать сочетание аргентометрии и косвенной нейтрализации, основанное на образовании солей серебра и выделении эквивалентных количеств азотной кислоты. Ее титруют 0,1 М раствором гидроксида натрия (индикатор — феноловый красный). Количественное определение теофиллина в эуфиллине выполняют после высушивания в течение 2,5 ч при 125— 130 °С, используя сочетание методов аргентометрии и косвенной нейтрализации. Теофиллин в эуфиллине можно определить аргенто-метрическим методом с использованием в качестве индикатора амидопирина. Спектрофотометрическое определение кофеина и кофеин-бензоата натрия выполняют, используя в качестве растворителя воду (272 нм), а теобромина и теофиллина — 0,1 М раствор гидроксида натрия (272 нм). Предложены также фотоколориметрические и фо-тотурбидиметрические методики определения пуриновых алкалоидов в лекарственных формах.
Препараты хранят по списку Б в хорошо укупоренной таре.
Кофеин и его соль применяют в качестве стимуляторов ЦНС, а теобромин, теофиллин и эуфиллин как спазмолитические и диуретические средства.
Производные эуфиллина дипрофиллин и ксантинола никотинат используют для улучшения периферического и церебрального кровообращения, при спазмах коронарных сосудов, гипертонической болезни.
Синтетические 6,9-замещенные пурина. Наиболее широко в лечебной практике используют меркаптопурин, азатиоприн, рибоксин, натрия аденозинтрифосфат двузамещенный.
Синтез меркаптопурина осуществляют из гипоксантина, действуя на него пентасульфидом дифосфора в среде безводного пиридина. Рибоксин получают микробиологическим синтезом. Источник получения натрия аденозинтрифосфата двузамещенного — дрожжи. Это
—кристаллические вещества желтого (меркаптопурин), светло-желтого (азатиоприн), белого с желтоватым оттенком (рибоксин) или белого (натрия аденозинтрифосфат двузамещенный) цвета. В воде меркаптопурин и азатиоприн практически не растворимы, рибоксин
—медленно и трудно
растворим, натрия аденозинтрифосфат двузамещенный — легко растворим. В этаноле
рибоксин очень мало растворим, меркаптопурин и азатиоприн — практически не
растворимы. Два последних растворимы в растворах щелочей и мало растворимы в
разведенных кислотах. Натрия аденозинтрифосфат двузамещенный практически не
растворим в этаноле, хлороформе и эфире. Азатиоприн и рибоксин практически не
растворимы в хлороформе, а
рибоксин — в эфире.
Подлинность рибоксина подтверждают с помощью ИК-спектра. Используют и УФ-спектры поглощения. Раствор 0,005%-ного меркаптопурина в 0,1 М растворе соляной кислоты имеет максимум поглощения около 325 нм. Азатиоприн в виде 0,01%-ного раствора в этом же растворителе — около 280 нм. Водный 0,001%-ный раствор рибоксина имеет максимум поглощения при 249 нм, в щелочной среде
— 253 нм. Отношение оптических плотностей водного раствора при 250 и 260 нм должно быть 1,60 и 1,80. Подлинность меркаптопурина можно подтвердить цветными реакциями. С раствором нитропруссида натрия в щелочном растворе препарата появляется желто-зеленое окрашивание, переходящее при подкислении в темно-зеленое. При действии на препарат в растворе аммиака хлорида меди (III) и гидро-ксиламина гидрохлорида выпадает оранжево-желтый осадок.
При испытании на чистоту в препаратах обнаруживают наличие примесей других производных пурина, являющихся источником их получения или продуктами разложения.
Количественное определение меркаптопурина основано на образовании двузамещенной соли серебра. Определение выполняют обратным аргентометрическим методом при растворении препарата в растворе аммиака. Определение можно выполнить и методом обратного меркуриметрического титрования. Количественное определение азатиоприна может быть выполнено методом неводного титрования (подобно барбитуратам), используя растворитель диметилформамид. Эквивалентную точку устанавливают потенциометрическим методом. Содержание азатиоприна и рибоксина в препаратах определяют спек-трофотометрическим методом. Растворитель для азатиоприна —0,1 М раствор соляной кислоты, для рибоксина — вода. Количественное определение натрия аденозинтрифосфатадвузамещенного основано на одновременном использовании трех методов анализа: потенциометрии, ионообменной хроматографии и спектрофотомет-рии в УФ-области.
Меркаптопурин и азатиоприн хранят по списку А, остальные препараты — по списку Б в хорошо укупоренной таре, сухом, защищенном от света месте. Меркаптопурин применяют для лечения злокачественных опухолей, азатиоприн — как иммунодепресант после пересадки органов; рибоксин и натрия аденозинтрифосфат — для лечения сердечно-сосудистых заболеваний.
Антиметаболитом пурина является противоопухолевый препарат фопурин, который применяют подобно меркаптопурину.
Производные пиразолопиримидина. Пиразолопиримидин — гетероциклическая система, очень близкая по химическому строению с 9Н-пурином. Исследования в этом ряду привели к созданию препарата алаопуринола.
Препарат практически не растворим в воде, этаноле, хлороформе, эфире, трудно растворим в диметилсульфоксиде, легко — в растворах гидроксидов щелочных металлов.
Подлинность препаратов устанавливают по ИК-спектру, сравнивая его со спектром сравнения, а также УФ-спектрофотометрией.
Количественное определение выполняют методом неводного титрования (растворители — диметилсульфоксид или диметилформамид), титрантом служит 0,1 М раствор гидроксида натрия в смеси метанола и бензола (индикатор — тимоловый синий). Конечную точку устанавливают потенциометрическим методом.
Хранят аллопуринол по списку Б в хорошо укупоренной таре, в защищенном от света месте. Назначают при подагре.
Производные птерина. Витамины, производные (ггерина. Производное птеридина — 2-амино-4-оксипиридин — известно под названием птерин, который является составной частью молекулы кислоты фолиевой (Вс), поэтому эта группа витаминов названа птери-новой. В ГФ включена кислота фолиевая, представляющая собой кристаллическое вещество желтого или желто-оранжевого цвета, практически не растворимое в воде и органических растворителях, трудно растворимое в разведенных минеральных кислотах (лучше — при нагревании) и легко — в растворах гидроксидов щелочных металлов.
Качественную и количественную оценку витамина можно проводить УФ-спектрофотометрией. ГФ рекомендует устанавливать подлинность по наличию трех характерных максимумов в УФ-спектре поглощения препарата в 0,1 М растворе гидроксида натрия (256, 283 и 365 нм). Способ фотоколориметрического определения основан на предварительном окислении препарата перманганатом калия до пте-риновой и л-аминобензоилглутаминовой кислот, с использованием азокрасителя.
Препарат хранят в хорошо укупоренной таре, в сухом, темном месте. Назначают для лечения и профилактики различных анемий.
Производные фолиевой кислоты. Структурный аналог и антагонист кислоты фолиевой — препарат метотрексат, представляющий собой смесь 4-дезокси-4-амино-ЛМ0-метилфолиевой кислоты и других птериновых соединений.
Препарат практически не растворим в воде, этаноле, дихлорэтане, эфире, но легко растворим в растворах щелочей и карбонатов.
Подлинность устанавливают по УФ- и ИК-спектрам поглощения. ИК-спектр должен соответствовать спектру сравнения, а УФ-спектр 0,001%-ного раствора препарата в 0,1 М растворе гидроксида натрия должен иметь три максимума поглощения (при 258, 303 и 370 нм). Подобно кислоте фолиевой, он окисляется перманганатом калия, образуя голубую флуоресценцию в УФ-свете. Можно использовать и бумажную хроматографию.
Количественное определение выполняют, сочетая бумажную хроматографию с УФ-спектрофотометрией. Это же определение можно выполнить методом высокоэффективной жидкостной хроматографии.
Хранят препарат по списку Б в плотно укупоренной таре, предохраняющей от света, при температуре 5—10 °С. Используют при лечении опухолевых заболеваний.I
Производные изоаллоксазина. Гетероциклическая система изоаллоксазина, подобно птеридину, включает два гетероцикла: пиразин и пиримидин, но содержит еще бензольный цикл, т. е. представляет собой бензоптеридин. К препаратам, относящимся к витаминам комплекса В, принадлежат так называемые флавиновые препараты. В лечебной практике применяют рибофлавин и рибофлавина мононуклеотид. Они сходны по внешнему виду, но различаются по удельному вращению. Рибофлавин мало растворим, а рибофлавина мононуклеотид растворим в воде; и тот и другой практически не растворим в этаноле и хлороформе; рибофлавин растворим в растворах кислот и щелочей.
Подлинность рибофлавина устанавливают по характерной яркой зеленовато-желтой окраске и интенсивной зеленой флуоресценции водного раствора в УФ-излучении. Флуоресценция исчезает при добавлении растворов соляной кислоты или щелочей. Рибофлавина мононуклеотид, в отличие от рибофлавина, дает положительную реакцию на ион натрия и на фосфаты, которые образуются после кипячения препарата в течение 5 мин в концентрированной азотной кислоте. Кроме того, определяют (без разрушения) содержание примеси фосфорной кислоты (не более 0,7 % ) спектрофотометрическим способом, используя в качестве реактива молибдат аммония. В качестве реактива на рибофлавин применяют также концентрированную серную кислоту, от которой при смачивании крупинка препарата приобретает вишнево-красное окрашивание. С солями металлов рибофлавин образует нерастворимые окрашенные комплектны: с раствором нитрата серебра — оранжево-красного, переходящего в красный, с солями ртути (II) — оранжевого цвета. Эти реакции используют для фотоколориметрического определения рибофлавина в лекарственных формах.
Для качественного и количественного анализа применяют спект-рофотометрию в УФ-области, используя в качестве растворителя воду с добавлением уксусной кислоты и ацетата натрия. Выполняют определение при длине волны 267 нм. Из химических методов для количественного определения рибофлавина применяют алкалимет-рическое определение после окисления перйодатом калия или после взаимодействия с 0,1 М раствором нитрата серебра, а также церимет-рию с йодометрическим окончанием и метод Кьельдаля (содержание азота 14,5—15,2 % ). Имеются и другие методы определения, основанные на окислении, этерификации и пр.
Хранят препараты в хорошо укупоренных банках оранжевого стекла. Назначают при недостатке данного витамина в организме.
Производные бензотиадиазина и амида хлорбен-золсульфоновой кислоты. Производные бензотиадиазина. Конденсированная система бензотиадиазина включает ядро бензо-1,3-диазина (бензопиримидина). Из многочисленных его производных в лечебной практике применяют дихлотиазид и циклометиазид. Дих-лотиазид мало растворим в воде и этаноле. Циклометиазид практически не растворим в воде, хлороформе, эфире; растворим в этаноле и легко — в ацетоне. Растворяясь в растворах щелочей, они образуют соли.
Подлинность препаратов устанавливают по функциональным группам в их молекуле. Сульфамидную группу обнаруживают по образованию окрашенных солей, которые выпадают в осадок при взаимодействии щелочных растворов препаратов с растворами солей тяжелых металлов. Так, при взаимодействии дихлотиазида с хлоридом кобальта выпадает зеленовато-голубой осадок. Циклометиазид с хлоридом кобальта образует осадок голубовато-серого цвета, а с сульфатом меди (II) — белый. Наличие атомов серы в молекулах устанавливают, окисляя препараты при кипячении с концентрированной азотной кислотой. Образовавшийся сульфат-ион открывают затем с помощью раствора хлорида бария.
Количественно дихлотиазид определяют титрованием в среде неводных растворителей или периметрическим методом. Цериметри-ческое определение основано на окислении сульфатом церия до хлор-тиазида. Избыток сульфата церия определяют йодометрически. Количественное определение циклометиазида основано на гидролизе препарата и взаимодействии в спиртовой среде с эквивалентным количеством гидроксиламина гидрохлорида в присутствии 0,1 М раствора соляной кислоты.
Хранят препарат по списку Б в хорошо укупоренных банках, предохраняя от воздействия света. Используют в качестве диуретических средств.
Производные амида хлорбензолсульфоновой кислоты. По химической структуре с производными бензотиадиазина сходны вещества, содержащие в молекулах амид о-хлорбензолсульфоновой кислоты. Из этой группы применяют фуросемид и оксодолин (хлорталидон). Это — белые кристаллические вещества, практически не растворимые в воде, трудно или мало — в этаноле, легко (фуросемид) или практически не растворимые (оксодолин) в эфире, но легко растворимые в растворах гидроксида натрия.
Подлинность препаратов устанавливают по ИК-спектрам (сравнение со стандартными образцами). УФ-спектр 0,0005%-ного раствора фуросемида в 0,01 М растворе гидроксида натрия имеет два максимума поглощения - при 228 и 271 нм, а 0,05%-ный раствор оксодолина в том же растворителе — один максимум при 335 нм. Используют и цветные реакции: раствор фуросемида в этаноле после добавления я-диметиламинобензальдегида приобретает зеленое окрашивание, переходящее в темно-красное; раствор оксодолина в серной кислоте имеет интенсивное желтое окрашивание, которое после нагревания на водяной бане и добавлении /-нафтола переходит в красно-фиолетовое.
Количественное определение фуросемида основано на кислотно-основном титровании в среде диметилформамида. Оксодолин можно определить методом неводного титрования, используя в качестве растворителя пиридин и титрант — гидроксид тетрабутиламмония. Эквивалентную точку устанавливают потенциометрическим методом.
Хранят препараты по списку Б в защищенном от света месте. Применяют в качестве диуретических и гипотензивных средств.
К препаратам, обладающим диуретическим действием и сходным по химической структуре, относится буфенокс — производное /и-ами-нобензойной кислоты.
Производные фенотиазина. Фенотиазин представляет собой конденсированную гетероциклическую систему, состоящую из шестичленного гетероцикла тиазина и двух ядер бензола. Производные фенотиазина можно разделить на две группы: к первой относятся 10-алкилпроизводные фенотиазина — пропазин, дипразин, аминазин, трифтазин, обладающие нейролептическим и противогистамин-ным действием, ко второй — 10-ацилпроизводные фенотиазина — этаперазин, нонахлазин, этмозин, этацизин, которые используют при лечении сердечно-сосудистых заболеваний. Синтез производных фенотиазина состоит из трех стадий: получения фенотиазинового ядра, синтеза алкильного или ацильного радикала, присоединения радикала к фенотиазиновому ядру.
Это — белые или со слабым желтоватым, сероватым, кремовым оттенком кристаллические вещества. Препараты легко окисляются, на свету темнеют (аминазин, трифтазин, этаперазин, этмозин) или приобретают красное (хлорацизин), сине-зеленое (пропазин) окрашивание. Особенно легко окисляются растворы препаратов. Они легко или очень легко растворимы в воде, легко или растворимы в этаноле, практически не растворимы в эфире. Нонахлазин, этацизин и этмозин растворимы или мало растворимы в воде и этаноле, чем отличаются от других производных фенотиазина.
Для испытания подлинности препаратов используют спектрофо-тометрию в УФ-области. ГФ рекомендует устанавливать удельный показатель поглощения при испытании трифтазина (0,001%-ный раствор препарата в 0,01 М растворе соляной кислоты при длине волны 256 нм), раствора пропазина — два максимума поглощения (при 252 и 302 нм), 0,0005%-ного раствора этаперазина — тоже два максимума поглощения (в области 254 и 306 нм). Перспективной для контроля качества этих соединений оказалась ВЭЖХ, которую можно использовать для идентификации, контроля чистоты и количественного определения. Кроме того, для испытания подлинности используют способность препаратов легко окисляться с образованием окрашенных продуктов. Используют бромную воду, азотную кислоту, хлорид железа (III), пероксид водорода, концентрированную серную кислоту. Эти реакции мало специфичны, и все препараты образуют продукты окисления, имеющие красное, вишнево-красное, красно-оранжевое, малиновое окрашивание.
Для идентификации препаратов можно использовать реакцию с концентрированной серной кислотой. В отличие от других производных, с трифтазином кислота дает не окрашенный продукт, а желеобразный осадок. Под действием азотной кислоты образуются окрашенные в красный цвет продукты взаимодействия с дипразином и аминазином. Раствор аминазина при этом мутнеет. Нонахлазин, в отличие от других препаратов, не дает окрашенных продуктов с азотной кислотой. Растворы этмозина и этацизина в разведенной соляной кислоте после кипячения окрашиваются в сиреневый цвет, который у этмозина от добавления нитрита натрия переходит в зеленый, а затем в желтый (реакция на морфолиновый цикл). В качестве реактивов для идентификации используют и красители: нонахлазин образует с бромфеноловым синим комплексное соединение, которое экстрагируется бензолом, окрашивая его в желтый цвет; аминазин и этаперазин с 0,1%-ным раствором метиленового синего в присутствии концентрированной серной кислоты приобретает пурпурное окрашивание; цропазин — светло-коричневое; дипразин — пурпурно-коричневое; трифтазин — серовато-зеленое; нонахлазин ~ красно-коричневое. Для качественного анализа используют также реакции комплексообразования и осаждения. Дифференцировать препараты можно и с помощью ТСХ.
Количественное определение препаратов выполняют различными вариантами метода титрования в неводных средах с титрантом — хлорной кислотой. Для аминазина, дипразина и пропазина растворителем служит ацетон, индикатором — метиловый оранжевый. Для трифтазина растворитель — ледяная уксусная кислота, индикатор — кристаллический фиолетовый. Указанные условия титрования возможны в присутствии ацетата ртути (III). Определить содержание препаратов можно методом нейтрализации 0,1 М водным раствором гидроксида натрия (индикатор — фенолфталеин). Для извлечения выделяющегося органического основания добавляют хлороформ. Кроме того, используют цери-, йодо- и йодхлорометрическое определения. Для фотоколориметрического определения широко используют цветные реакции, основанные на окислении и комплексообразовании.
Препараты хранят по списку Б в плотно закрытых банках из темного стекла, с залитыми парафином пробками. Используют в качестве нейролептиков и сердечно-сосудистых средств.
Конденсированные производные азепина и окса-з и н а. Производные дибензоазепина. Азелин — семичленный гетеро-цикл с одним атомом азота, бензоазепин и его дигидропроизводные (иминодибензил) — гетероциклические системы, включающие по два бензольных ядра. У этих соединений была установлена антидепрессивная активность, и они получили название трициклических (в молекулах по три цикла) антидепрессантов. Одним из представителей является карбамазепин. Это — кристаллическое вещество, практически не растворимое в воде и эфире, растворимое в этаноле и хлороформе. Подлинность устанавливают по цветной реакции его смеси с азотной кислотой, нагревание которой на водяной бане приводит к появлению оранжево-красной окраски. Воздействие УФ-излучения (с длиной волны 365 нм) на кристаллы препарата вызывает интенсивное синее свечение. Подтвердить подлинность препарата можно также по ИК-спектру, который сравнивают со спектром образца.
Количественно препарат определяют методом УФ-спектрофото-метрии в максимуме поглощения (285 нм), цспользуя в качестве растворителя этанол. Расчеты ведут путем сравнения результатов измерения со стандартным образцом.
Хранят по списку Б в плотно укупоренной таре. Применяют как противосудорожное и противоэпилептическое средство.
Используют и другие трициклические антидепрессанты — имизин и амитриптилин.
Производные бензодиазепина. Бензодиазепин — гетероциклическая система, включающая ядро и семичленный гетероцикл — 1,4-диазепин, содержащий два атома азота. Интерес к этим препаратам был вызван их транквилизирующим действием. Осуществлен синтез ряда этих средств, из которых нашли применение нозепам (оксазе-пам), феназепам, нитразепам, сибазон (диазепам).
Это — белые кристаллические вещества (нитразепам имеет светло-желтую окраску с зеленоватым оттенком), практически не растворимы в воде, мало или трудно — в этаноле. Различаются по растворимости в других растворителях: легко (сибазон), мало (нозепам) или умеренно (нитразепам, феназепам) растворимы в хлороформе, практически не растворимы (феназепам) или мало растворимы в эфире. При нагревании в растворах минеральных кислот они гидролизу-ются.
Подлинность препаратов устанавливают по характерным особенностям УФ-спектров поглощения. Растворы (0,005—0,0005%-ные) в этаноле имеют максимумы поглощения у нозепама при 229 и 318 нм, у феназепама — при 231 и 320 нм. УФ-спектр 0,0005%-ного раствора нитразепама в смеси с 1 М раствора соляной кислоты и метанола (1:9) имеет максимум поглощения при 280 нм, минимум —при 240 и плечо — в области 343—347 нм. В УФ-спектре сибазона три максимума поглощения: 240, 284 и 360 нм (растворитель — смесь этанола и 0,1 М раствора соляной кислоты). Различия в УФ-спектрах позволяют идентифицировать препараты.
Существуют и другие реакции для идентификации. Реакцию ди-азотирования и азосочетания после гидролиза дают только нозепам, нитразепам, феназепам, а сибазон после гидролиза превращается в окрашенное (желтого цвета) производное бензофенона. Используют реакцию пиролиза, воздействуют щелочами в жестких условиях. Органически связанные атомы хлора (нозепам, сибазон) и брома (феназепам) обнаруживают с помощью пробы Бейльштейна (препарат, внесенный на медной проволоке в бесцветное пламя горелки, окрашивает его в зеленый цвет, благодаря образованию летучих га-логенидов меди). Атомы галогенов можно обнаружить также путем сжигания в колбе с кислородом, используя в качестве поглощающей жидкости раствор гидроксида натрия. Идентифицировать эти препараты можно по образованию окрашенных флуоресцирующих продуктов в результате воздействия хлорной, серной и другими кислотами. Имеются и другие методы идентификации.
Количественное определение выполняют методом неводного титрования, используя в качестве растворителей муравьиную кислоту (нозепам) или хлороформ (феназепам) в сочетании с уксусным ангидридом; уксусный ангидрид (нитразепам), ледяную уксусную кислоту (сибазон). Титрантом служит 0,1 М раствор хлорной кислоты. Эквивалентную точку устанавливают с помощью индикатора кристаллического фиолетового или потенциометрическим методом. Количественное содержание препаратов в лекарственных формах определяют спектрофотометрией по собственному поглощению растворов препаратов в различных растворителях, а также фотоколориметрическим методом с использованием реакции азосочетания (после предварительного гидролиза и диазотирования) или других цветных реакций.
Хранят препараты по списку Б в защищенном от света месте. Применяют в качестве транквилизаторов.
Первым транквилизатором этой группы был хлозепид, который не потерял еще своего значения.
Производные диазафеноксазина. Одним из производных оксазина является антидепрессант трициклического строения азафен — кристаллическое вещество, легко растворимое в воде и практически не растворимое в органических растворителях. Его подлинность подтверждают УФ-спектром раствора в 0,01 М растворе соляной кислоты, который может иметь три максимума поглощения (в области 244, 285 и 364 нм).
Количественно азафен определяют неводным титрованием в смеси уксусного ангидрида и муравьиной кислоты. Титрант — 0,1 М раствор хлорной кислоты, индикатор — кристаллический фиолетовый.
Препарат хранят по списку Б в защищенном от света месте. Применяют как антидепрессантное средство.
Конденсированные производные р-лактамидов тиазолидина и дигидротиазина (пенициллины и це-фалоспорины). Пенициллины. Структурной основой природных и полусинтетических пенициллинов является 6-аминопенициллано-вая кислота, которая включает конденсированные тиазолидиновый и лакгамный циклы, обусловливающие биологическую активность этих антибиотиков. Расщепление одного из них приводит к полной потере активности.
Пенициллины получают биосинтетическим (из плесени пеницил-лиум) и полусинтетическим (из 6-аминопенициллановой кислоты — 6-АПК) путями. Получают 6-АПК из бензилпенициллина (или пенициллинов), воздействуя ферментом пенициллинацилазой, продуцируемым бактериями. Реже используют химические методы расщепления пенициллинов до 6-АПК. Из биосинтетических пенициллинов применяют натриевую, калиевую, новокаиновую соли бензилпенициллина и феноксиметилпенициллин. Полусинтетические пенициллины характеризуются наличием в молекуле ароматического или гетероциклического радикалов. Из них наиболее широко используют ампициллин, оксациллин, карбенициллина динатриевую соль, карфецил-лина натриевую соль.
Это — белые или почти белые кристаллические порошки без запаха. Натриевая и калиевая соли бензилпенициллина слегка гигроскопичны, карбенициллина динатриевая соль гигроскопична, фенокси-метилпенициллин негигроскопичен. Натриевые и динатриевые соли пенициллинов очень легко или легко растворимы в воде. Новокаи-новая соль бензилпенициллина, феноксиметилпенициллин и ампициллин мало и очень мало растворимы в воде. Большинство препаратов мало растворимы в этиловом и метиловом спиртах (динатриевая соль карбенициллина медленно растворима), хлороформе и эфире, феноксиметилпенициллин умеренно растворим в хлороформе.
Подлинность препаратов подтверждают с помощью УФ- и ИК-спектрофотометрии. Используют и цветную реакцию, основанную на разрыве Р-лактамного цикла и образовании медной соли гидро-ксамовой кислоты (осадок зеленого цвета). В препаратах можно обнаружить органически связанную серу после превращения ее в сульфид-ион сплавлением с едкими щелочами. По ГФ соли бензилпенициллина испытывают на ион натрия или калия с помощью соответствующих реакций или подвергают испытанию на первичные амины (для новокаиновой соли).
Препараты пенициллина отличают друг от друга по разной окраске продуктов реакции с хромотроповой кислотой в присутствии концентрированной серной кислоты. Для идентификации и фотоколориметрического определения солей бензилпенициллина, феноксиме-тилпенициллина, натриевой соли оксациллина используют реакцию, основанную на образовании полиметиновых красителей.
По требованиям НТД препараты испытывают на токсичность, пирогенность, стерильность (ГФ XI, вып. 2, с. 182, 183, 187), а натриевую и калиевую соли бензилпенициллина — на термостабилъ-ность.
Количественное определение по ГФ состоит из двух этапов: определения суммы пенициллинов и установления содержания соответствующего препарата. При анализе природных пенициллинов их сумму определяют йодометрическим методом. Сущность способа — продукт инактивации пенициллина [1 М раствором гидроксида натрия натриевую соль пенициллиновой кислоты окисляют йодом (в ацетатном буфере, рН 4,5)]. Используют и обратный йодометричес-кий метод: количественное определение солей бензилпенициллина выполняют гравиметрическим методом. Б новокаиновой соли бензилпенициллина определяют содержание новокаина, который извлекают хлороформом (новокаина должно быть не менее 37,5 % и не более 40,5 %). Кроме перечисленных используют и другие реакции количественного определения.
Биологическую активность устанавливают по антибактериальному действию на тест-микроб (золотистый стафилококк). 1 ЕД должна соответствовать 0,5988 мкг химически чистой натриевой соли бензил пенициллина (1670 ЕД в 1 мг).
Хранят препараты по списку Б в герметически закрытых флаконах. Применяют с учетом чувствительности патогенной микрофлоры.
Цефалоспорины. Цефалоспорины, сходные по строению с пени-циллинами, представляют собой производные 7-аминоцефалоспора-новой кислоты (7-АЦК) и 7-аминодезацетоксицефалоспорановой кислоты (7-АДЦК). Биосинтез этих препаратов сходен. Источник полусинтетических цефалоспоринов — природный цефалоспорин С. Применяют цефалексин и цефалотина натриевую соль.
Это — белые порошки, практически не растворимы в хлороформе и эфире. Цефалотина натриевая соль легко растворима в воде и мало — в этаноле, цефалексин трудно растворим в воде и практически не растворим в этаноле.
Для испытания подлинности используют УФ- и И К-спектрометрию. Подлинность препаратов можно установить, действуя смесью 80%-ного раствора серной кислоты и 1%-ного раствора азотной кислоты. Цефалексин приобретает желтое окрашивание, а цефалотина натриевая соль — оливково-зеленое, переходящее в красно-коричневое. Открывают также ион натрия в натриевой соли цефалотина.
Количественное определение основано на предварительном щелочном гидролизе до образования производных цефалоспориновой кислоты (7-АДЦК и 7-АЦК), которые окисляют титрованным раствором йода (параллельно анализируют стандартные образцы). Определение может быть выполнено методом неводного титрования (растворители — муравьиная и ледяная уксусная кислоты в смеси с ацетоном). Можно использовать и меркуриметрический метод.
Хранят препараты по списку Б. Используют при инфекциях, вызываемых чувствительной к препаратам микрофлорой.
В последнее время получено несколько поколений новых цефалоспоринов, отличающихся более высокой эффективностью.
Конденсированные производные коррина и нуклеотида бензимидазола (кобаламины). Цианокобаламин получают при производстве стрептомицина (при биосинтезе антибиотика из побочного продукта). Молекула витамина состоит из двух частей: кобальтового комплекса нуклеотида бензимидазола и макроциклической корриновой системы, которая включает шесть амидных групп (три ацетамидные и три пропионамидные), а также восемь метильных групп. В ГФ включен цианокобаламин. Он умеренно и медленно растворим в воде, растворим в этаноле, практически не растворим в эфире и хлороформе.
Идентифицируют препарат по атому кобальта после минерализации азотной кислотой. Полученный нитрат кобальта образует окрашенный продукт с азокрасителем пиридоксина в водно-ацетоновой среде при рН 7, с максимумом поглощения при 515—520 нм. Кобальт можно обнаружить и после сплавления с гидросульфатом калия. Для испытания подлинности и чистоты, а также количественного определения используют УФ-спектрофотометрию. Количественно препарат определяют в водных растворах при длине волны 361 нм, параллельно измеряя образец. Содержание витамина должно быть не менее 95 %. Существует биологический метод определения (очень длительный) и атомно-абсорбционный.
Препарат хранят в хорошо укупоренной таре, в защищенном от света месте. Применяют при различного рода анемиях.
Кроме того, выпускают препараты оксикобаламин и кобамамид, очень сходные по химической структуре и действию с цианокобала-мином.
Препараты назначают при анемиях различного генеза, а кобамамид и в качестве анаболического средства.
2. ОСНОВЫ ФАРМАКОГНОЗИИ
2.1 ОПРЕДЕЛЕНИЕ И ЗАДАЧИ ФАРМАКОГНОЗИИ
Фармакогнозия — наука, изучающая лекарственные растения и лекарственное сырье растительного происхождения. Термин происходит от греческих слов «pharmakon» — лекарство, яд и «gnosis» — знания. Как наука развивается с середины XIX в.
Лекарственное растительное сырье — это высушенные, реже свежесобранные части лекарственных растений, используемые для получения лекарственных средств.
Биологически активные вещества (БАВ) — это соединения различной химической структуры, содержащиеся в лекарственных растениях и определяющие основной терапевтический эффект.
В лекарственном сырье наряду с действующими веществами содержатся и так называемые сопутствующие вещества, которые также могут обладать фармакологической активностью. Довольно часто сопутствующие вещества влияют на действие БАВ, потенциируя или ингибируя их фармакологический эффект.
Задачи фармакогнозии следующие:
изучать лекарственные растения как источник биологически активных веществ;
изучать химический состав растения;
изучать динамику накопления БАВ растениями, их биосинтез по фазам вегетации и локализацию в растительном организме;
выяснять влияние факторов окружающей среды на накопление БАВ у дикорастущих растений и направленного воздействия на их содержание при выращивании лекарственных растений;
проводить стандартизацию лекарственного сырья для обеспечения его высокого качества;
изучать ресурсы лекарственных растений для выяснения естественных запасов их в природе и определения сырьевой базы;
охранять лекарственные растительные ресурсы страны;
совершенствовать методы определения подлинности и доброкачественности лекарственного растительного сырья.
2.2 ЛЕЧЕБНЫЕ КОМПОНЕНТЫ РАСТЕНИЙ
Лекарственные растения содержат комплекс БАВ, которые и оказывают фармакологическое действие. Ценность лекарственного растения зависит от количественного и качественного состава БАВ, состав которых может изменяться в процессе вегетации растений. Наряду с действующими веществами в растениях имеются и сопутствующие вещества, которые могут влиять на действие основных веществ.
В лекарственных растениях содержатся следующие биологически активные вещества.
Алкалоиды — сложные органические основания, содержащие (кроме углерода и водорода) азот. Биологическое значение их для растительного организма не установлено. Растения содержат их в виде оснований или солей с органическими кислотами (щавелевой, лимонной, яблочной). Растения преимущественно содержат несколько алкалоидов, из которых, как правило, преобладают один, два или три алкалоида, а другие содержатся в минимальных количествах. Наиболее богаты алкалоидами высшие цветковые растения. Например, в спорынье обнаружено более 30 различных алкалоидов, в маке — 26, в раувольфии змеиной — 50. Содержание алкалоидов измеряется в сотых и десятых долях процента. В воде большинство алкалоидов не растворимы, но их соли растворимы. Имеют щелочную реакцию.
Спектр фармакологического действия алкалоидов многогранен. Их применяют для возбуждения и угнетения нервной системы, повышения и понижения кровяного давления, коррекции сердечной деятельности и дыхания, изменения тонуса гладких мышц, а также в качестве успокаивающих, болеутоляющих, спазмолитических, желчегонных, отхаркивающих, антимикробных и других средств.
К алкалоидам относятся атропин, кодеин, кокаин, кофеин, никотин, морфин, стрихнин, хинин, эфедрин и др. Это — сильнодействующие препараты и их применяют только по назначению врача.
Антраценпроизводные (антрагликозиды) — преимущественно гли-козиды. Они малотоксичны, стойки при хранении, желтого, оранжевого или красного цвета. В больших количествах содержатся в коре крушины, корнях конского щавеля, ревеня и марены красильной. Под действием кислорода воздуха окисляются, поэтому сырье, содержащее их, в процессе хранения темнеет. Оказывают специфическое слабительное действие.
Витамины — органические вещества различного химического состава и строения. В организме прямо или косвенно взаимодействуют с гормонами, ферментами, аминокислотами и микроэлементами. Участвуют в обмене белков, жиров, углеводов и минеральных веществ. Потребность организма животных в витаминах удовлетворяется в основном за счет природных источников. Известно более 30 витаминов, из них около 20 поступают в организм из растений и животных отходов. Терапевтический эффект растительного сырья, содержащего сбалансированный комплекс витаминов, в ряде случаев более высок, чем при приеме синтетических витаминов. Растения содержат водорастворимые (С, Р, В: и др.), являющиеся коферментами ферментативных систем, и жирорастворимые (А, Е, К и др.) витамины, оказывающие сложное гормоноподобное действие.
Гликозиды — безазотистые вещества разнообразной химической структуры. В чистом виде они обычно кристаллические. Содержат сахаристую (гликон) и несахаристую (агликон) части. Агликон оказывает терапевтическое действие, а гликон влияет на растворимость и всасываемость гликозидов. Под влиянием воды и энзимов гликозиды легко распадаются на гликон и агликон. Поэтому растения, содержащие гликозиды, при заготовке необходимо сушить быстро и хранить в абсолютно сухом месте.
Гликозиды имеют горький вкус, легко растворимы в воде и с трудом — в спирте. В ветеринарии наиболее широко используют сердечные гликозиды. Они не имеют синтетических заменителей, поэтому растения — единственный источник их получения. Растения содержат до 30 сердечных гликозидов, близких по химическому строению.
Сердечные гликозиды — сильнодействующие препараты, их применяют только по назначению врача.
Гликоалкалоиды — вещества, обладающие свойствами и гликозидов, и алкалоидов. Состоят из гликона и алкалоида агликона, который содержит азот и образует с кислотами соли. Многие гликоалкалоиды обладают выраженным токсическим действием. К ним относится соланин, содержащийся в ботве картофеля, траве черного и сладко-горько го пасленов, и томатин — в ботве помидоров.
Горечи (горькие гликозиды) — безазотистые соединения очень горького вкуса. Рефлекторно усиливают секрецию желез желудочно-кишечного тракта и способствуют повышению аппетита. Различают простые и ароматические горечи.
Дубильные вещества (таниды) — безазотистые ароматические соединения, производные многоатомных фенолов (галлонтанины, эллаготанины). Хорошо растворимы в воде и спирте. Обладают свойством образовывать химические связи с белками. Образовавшиеся при этом соединения устойчивы к действию ферментов и влаги. Такое свойство отдельных растительных экстрактов (коры дуба) используют при выделке кожи.
Дубильные вещества присутствуют практически во всех растениях. Образуют нерастворимые соединения с солями тяжелых металлов и алкалоидами, поэтому их можно использовать в качестве противоядия. В ветеринарии применяют как противовоспалительные, кровоостанавливающие и бактерицидные средства. Действие их основано на взаимодействии с белками, в результате чего на поверхности ткани образуется пленка.
Кумарины и фурокумарины — сложные производные бензоальфа-пирона, вещества, являющиеся лактонами дважды ненасыщенной ароматической окисикоричной кислоты. Они чувствительны к действию света, быстро разрушаются, мало растворимы в воде. Повышают чувствительность кожи к ультрафиолетовым лучам, обладают спазмолитическим, сосудорасширяющим и противоопухолевым действием. Сбор и сушку сырья, содержащего кумарины, следует проводить в перчатках, так как они обладают раздражающим действием и могут вызывать дерматиты.
Липиды — жиры и жирные масла, которые являются запасными питательными веществами растений и накапливаются в больших количествах в плодах и семенах. Жирные масла — это сложные смеси эфиров глицерина и жирных кислот. Природные жирные кислоты можно разделить на три группы: насыщенные, мононенасыщенные и полиненасышенные. Жирные кислоты, входящие в состав липидов высших растений и животных, играют важную роль в процессах жизнедеятельности. Они влияют на проницаемость биологических мембран, являются энергетическим резервом, создают защитный водоотталкивающий и термоизоляционный покров, обладают слабительным (касторовое) действием и др. Используются в качестве основы для приготовления мазей, суппозиториев, инъекционных масляных растворов.
Камеди — полисахариды, состоящие из калиевой, магниевой и марганцевой солей и нескольких «сахаро-камедевых» кислот. Химический состав их изучен недостаточно. Образуются в результате перерождения клеточных стенок на местах случайных или искусственных повреждений растений и представляют собой натеки в виде густой массы, затвердевающие на солнце. Рекомендуется собирать с поверхности стволов деревьев после затвердевания. Камеди используют в качестве эмульгатора для эмульсий, а также обволакивающих и клейких веществ для пилюль и таблеток.
Клетчатка (целлюлоза) — наиболее широко распространенный структурный полисахарид растительного мира. Почти не переваривается в желудочно-кишечном тракте, но механически действуя на нервные окончания стенки, стимулирует его моторную и секреторную функции и улучшает пищеварение. Способствует выведению из организма токсических продуктов экзогенного и эндогенного происхождения. В кишечнике нормализует бактериальную флору и стимулирует биосинтез витаминов группы В.
Крахмал — смесь двух гомополисахаридов: линейного — амилазы и разветвленного — амилопектина. Откладывается преимущественно в клубнях, плодах, семенах и сердцевине стебля. Применяют в качестве обволакивающего средства при желудочно-кишечных заболеваниях.
Микроэлементы (марганец, мышьяк, кобальт, цинк, медь и др.) входят в состав ферментов, витаминов, гормонов и активно участвуют в различных биохимических процессах. Они необходимы для обеспечения иммунитета, нормального кроветворения, тканевого дыхания и белкового обмена.
Пектины входят в состав межклеточного склеивающего вещества. Широко распространены в растительном мире и имеются в небольших количествах во всех частях растения, но преимущественно накапливаются в корнях и плодах. В большинстве случаев это — балластное вещество. Установлено, что некоторые пектины способны связывать свинец, кобальт, цезий, обладают противовоспалительным действием и эффективны при колитах, энтероколитах, ожогах и язвах.
Полисахариды содержат разнообразные углеводы. В растениях распространены простые (глюкоза, фруктоза, галактоза, ксилоза) и более сложные (сахароза) углеводы. По функциональному назначению полисахариды делят на структурные (целлюлоза) и резервные (гликоген, крахмал). Полисахариды наряду с белками и липидами — важнейшие химические соединения живых организмов. Для ветеринарии определенный интерес представляют крахмал, инулин, камеди, слизи, пектиновые вещества. Полисахариды обладают антибиотической, противовирусной и противоопухолевой активностью. Они — основные запасные питательные вещества клеток и в больших количествах откладываются в плодах и корнях.
Сапонины — сложные органические
соединения гликозидного характера. Водные растворы сапонинов образуют при
встряхивании обильную очень стойкую пену, подобно мыльной, за что они и
получили свое название (от лат. sapo — мыло). Хорошо растворимы в ![]() спиртах и щелочных
растворах. Сапонины широко распространены в природе. Особенно их много содержат
представители семейств гвоздичных и первоцветных. Они в значительных
количествах накапливаются в корнях (солодка, аралия, жень-шень). Действуют
раздражающе на слизистые оболочки глаз, носоглотки. При приеме в больших дозах
внутрь вызывают рвоту, понос, при введении в кровь — гемолиз эритроцитов. В
ветеринарии отдельные сапонины применяют в качестве отхаркивающих (усиливающих
секрецию бронхиальных желез), мочегонных, седативных, противоязвенных,
противо-склеретических средств. Установлено, что они регулируют водно-солевой
обмен. Ряд стероидных сапонинов служат источником для синтеза гормональных
препаратов, широко применяемых при нарушениях холестеринового обмена.
Установлено стимулирующее и адап-тогенное действие их на организм.
спиртах и щелочных
растворах. Сапонины широко распространены в природе. Особенно их много содержат
представители семейств гвоздичных и первоцветных. Они в значительных
количествах накапливаются в корнях (солодка, аралия, жень-шень). Действуют
раздражающе на слизистые оболочки глаз, носоглотки. При приеме в больших дозах
внутрь вызывают рвоту, понос, при введении в кровь — гемолиз эритроцитов. В
ветеринарии отдельные сапонины применяют в качестве отхаркивающих (усиливающих
секрецию бронхиальных желез), мочегонных, седативных, противоязвенных,
противо-склеретических средств. Установлено, что они регулируют водно-солевой
обмен. Ряд стероидных сапонинов служат источником для синтеза гормональных
препаратов, широко применяемых при нарушениях холестеринового обмена.
Установлено стимулирующее и адап-тогенное действие их на организм.
Слизи — безазотистые вещества, преимущественно полисахариды, продукт ослизнения клеточных стенок. Сильно разбухают в воде или растворяются в ней, образуя вязкие коллоидные растворы. Применяют в качестве обволакивающих средств при желудочно-кишечных заболеваниях.
Смолы — обычно густые жидкости, липкие на ощупь, обладающие характерным ароматным запахом. По химическому строению близки к эфирным маслам и в растениях часто встречаются одновременно с ними. Долго незасыхающие смолы называют бальзамами. Оказывают в основном бактерицидное и местно раздражающее действие. Сосновую, пихтовую и кедровую смолы преимущественно используют как ранозаживляющие средства.
Фитонциды — сложные органические соединения разного химического состава. Обладают бактерицидным и фунгицидным действием. Вырабатываются растениями для самозащиты от патогенных микроорганизмов. Различают летучие (некоторые эфирные масла), действующие на расстоянии, и нелетучие (тканевые соки), действующие контактным способом, фитонциды. Применяют с лечебной и профилактической целью при раде инфекционных и вирусных заболеваний.
Флавоноиды — чаще всего гликозиды. Обусловливают желтую, красную и оранжевую окраску плодов, цветков и корней. Они обладают желчегонным, спазмолитическим, кардиотоническим действием. Ряд флавоноидов, оказывая Р-витаминное действие, уменьшают проницаемость и ломкость капилляров, участвуют в окислительно-восстановительных процессах. У них выявлен противоопухолевый и радиозащитный эффект.
Эфирные масла — летучие вещества, обладающие своеобразным запахом и являющиеся смесью различных терпеноидных и терпено-подобных веществ и их производных. Наиболее ценной составной частью эфирных масел являются азулен, хамазулен — вещества, оказывающие выраженное противовоспалительное и антиаллергическое действие. Хамазулен активизирует функцию ретикулоэндотелиаль-ной системы, усиливает фагоцитоз и улучшает тканевое дыхание. Эфирные масла действуют болеутоляюще, влияют на деятельность сердечно-сосудистой и центральной нервной системы, ряд эфирных масел — отхаркивающе и дезодорирующе, в малых дозах при ингаляции повышают секреторную функцию бронхов.
2.3 СОДЕРЖАНИЕ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ В РАСТЕНИЯХ И ИХ РОЛЬ В ЖИЗНЕДЕЯТЕЛЬНОСТИ ЖИВОТНЫХ
Ценность любого лекарственного растения зависит от элементного состава. Растения состоят из воды (70—90 %), сухой органической массы (5—20 %) и золы (1—5%). В химический состав органических соединений в количестве от десятых до сотых долей процента входят макроэлементы — углерод (45 % сухой массы), кислород (42 %), водород (6,5 %), азот (1,5 %) и зольные химические элементы — фосфор, калий, кальций, кремний, магний, натрий, железо, сера, алюминий (суммарно 5 %).
Азот — биогенный элемент, входящий в состав РНК, ДНК, аминокислот, витаминов группы В, хлорофилла и различных белков растений. Свободный азот атмосферы и почвы недоступен для непосредственного использования высшими растениями. Связывание и перевод молекулярного азота атмосферы в азотистые соединения осуществляют клубеньковые бактерии, живущие в почве в симбиозе с растениями. Азот образуется также в результате разложения органических веществ (навоза, листьев, травы, компоста) специальными бактериями. Под влиянием последних азот переходит в аммиак, азотистую и азотную кислоты и соли этих кислот.
Алюминий содержат многие растения. Участвует в процессах регенерации костной ткани, в фосфорном обмене, повышает кислотность и активацию желудочного сока, участвует в синтезе эпителия и соединительной ткани, повышает активность ряда ферментов, а в больших дозах — угнетает их деятельность.
Бром в виде солей положительно влияет на функции центральной нервной системы, регулирует деятельность желез внутренней секреции, в частности половых, влияя на течение полового цикла. Содержится в основном в белокочанной капусте и зерновых. Бром может угнетать активность ферментов слюны и поджелудочного сока. Вместе с йодом влияет на деятельность щитовидной железы.
Железо в растениях вместе с медью и цинком может содержаться как микроэлемент, а в отдельных органах растений — как макроэлемент. При недостатке солей железа возникает хлороз растений.
Железо необходимо для образования многих ферментов. В организме приблизительно 3/4 всего железа входит в состав гемоглобина крови, а 1/4 часть находится в форме железосодержащего белка — ферритина. Основные депо ферритина — селезенка, печень и костный мозг. При недостатке в организме солей железа и других его соединений нарушается азотистый, минеральный и жировой обмены, развивается малокровие.
Йод — незаменимый микроэлемент. Концентрация йода в растениях зависит от содержания его в почве и воде. Из овощей наиболее богаты йодом свекла столовая, помидоры, огурцы, лук репчатый, сельдерей, спаржа (проростки), капуста белокочанная, морковь, зерновые и бобовые культуры, ягоды, плоды фейхоа, морская капуста (ламинария). Йод участвует в образовании гормонов щитовидной железы тироксина и трийодтиронина, повышает усвоение организмом кальция и фосфора, положительно действует при атеросклерозе и ожирении. Недостаток в пище йода приводит к возникновению эндемического зоба, уровской болезни.
Калий способствует синтезу белков, крахмала, жиров, а также использованию железа для образования в листьях растений хлорофилла. У ряда растений соли калия составляют более 50 % золы. Соли калия входят в состав основных систем крови, участвуют в процессах передачи нервного возбуждения, образовании ацетилхолина и других физиологически активных веществ. В организме участвуют в регуляции сократительной деятельности сердца, удалении из организма воды и хлористого натрия.
Кальций имеет большое значение для растений: способствует нейтрализации органических кислот в растениях; его соли — развитию корневой системы. Соли кальция входят в состав всех клеток и плазмы крови, способствуют образованию костной ткани, необходимы для выработки ферментов, участвующих в свертывании крови. Ионизированный кальций требуется организму для поддержания нормальной нервно-мышечной возбудимости.
Кобальт в сочетании с медью стимулирует рост стебля и корней растений. Кобальт — единственный элемент, который может запасаться в организме на длительный период. Большое содержание его отмечено в черемухе обыкновенной, шиповнике майском и др. Он участвует в синтезе белков, превращении жиров, усвоении азота, фосфора и кальция, стимулирует рост животных. При его недостатке уменьшается синтез витамина В|2, тормозится переход железа в состав гемоглобина крови, что приводит к развитию анемии, развивается зоб, а при избытке — нарушается тканевое дыхание.
Кремний входит в состав всех растений, является строительным материалом для клеточной ткани растений.
Литий в больших концентрациях содержится в алоэ, белене черной, красавке. Его недостаток способствует увеличению акушерско-гинекологических заболеваний у крупного рогатого скота.
Магний имеет большое значение для растений как элемент, входящий в состав хлорофилла. Участвует в реакции переноса фосфорных соединений. Соли магния входят в состав ряда ферментов и участвуют в процессах углеводного и фосфорного обмена в организме, необходимы для нормальной возбудимости нервной системы. Магний способствует выведению холестерина из организма, входит в состав костей.
Марганец активно участвует в фотосинтезе, синтезе ряда витаминов групп С, В, Е, ускоряет рост растений и созревание семян. Содержание марганца в растениях зависит от характера и биохимического состава почвы. Особенно высока концентрация марганца в капусте, других листовых овощах, зернах злаков, клубнях, плодах и листьях диких растений (медунице и др.). Марганец положительно влияет в организме на процессы кроветворения, тканевого дыхания, иммунитет, рост и размножение, предупреждает развитие атеросклероза.
Медь необходима для активации процесса фотосинтеза в растениях, способствует передвижению продуктов фотосинтеза из листьев в другие органы растения, участвует в процессе дыхания, влияет на белковый, углеводный и азотистый обмены, увеличивает засухоустойчивость растений, вместе с кобальтом стимулирует рост стебля и корней. Много соединений меди содержат помидоры, баклажаны, зеленый горошек, шпинат, салат, брюква, репчатый лук, тыква, морковь, свекла и др. Медь входит в состав ферментов. В растениях повышает эффективность цинка, марганца и бора. Медь способствует обмену витаминов А, С, Е, Р. При ее недостатке снижается активность действия окислительных ферментов, что может привести к различным формам анемии, нарушениям кроветворения; ускоряется развитие зоба и замедляется образование костной мозоли при переломах.
Мышьяк входит в состав многих пищевых и лекарственных растений, но его физиологическая роль мало изучена. В небольших количествах он содержится в свекле, картофеле, хрене, луке, капусте, томатах и др. В ветеринарии и медицине препараты мышьяка применяют при неврозах, миастении, некоторых формах анемии, лейкозе, псориазе. В больших дозах мышьяк угнетает синтез лейкоцитов.
Молибден участвует в процессах накопления в клетках растений аскорбиновой кислоты, усвоения азота и синтеза хлорофилла. Сверхконцентраторы молибдена — багульник болотный, горец птичий, плоды жостера слабительного, крапива двудомная, мята перечная. Эти растения могут быть использованы для профилактики болезней, связанных с недостатком в организме молибдена. В организме молибден связан с ферментами и участвует в синтезе витаминов В12 и Е. Малые дозы молибдена в продуктах питания ведут к обезвреживанию токсинов (ядов), а избыток его (при одновременном недостатке йода) способствует появлению анемий, подагры, эндемического зоба, расстройству работы кишечника.
Натрий благоприятно действует на клеточный сок растений, создавая высокое осмотическое давление. Это позволяет растениям поглощать воду даже при засоленности почв, способствует накоплению питательных веществ в корнеплодах (сахарная свекла и др.).
Никель участвует в активации ферментов, связанных с расщеплением и использованием глюкозы, способствует увеличению количества эритроцитов и гемоглобина в крови. Избыток никеля приводит к развитию кератитов и кератоконъюнктивитов. Содержится в красавке, пустырнике, термопсисе.
Селен — ультрамикроэлемент, содержащийся в землянике лесной, лимоннике, мать-и-мачехе, пастернаке, золотом корне, смородине черной, тыкве, укропе, эвкалипте и др. Обладает противораковой активностью, совместно с витамином Е стимулирует образование антител и повышает иммунный статус организма, положительно влияет на состояние сердечно-сосудистой системы и образование красных кровяных телец.
Сера содержится в эфирных маслах, белковых соединениях (ме-тионине и др.) и некоторых гликозидах (синигрине). В растения поступает из минеральных и органических соединений. Входит в состав биокатализаторов. Энергия, образующаяся в результате окисления серы, используется на синтез органического вещества из диоксида углерода.
Стронций в растениях участвует в обмене веществ, вместе с бором способствует росту корня. В обмене веществ связан с кальцием. Сверхконцентраторы стронция: алоэ, анис, бадан, брусника, горец змеиный, кора дуба, кровохлебка лекарственная.
Титан стимулирует активность кроветворения, ускоряет восстановление белков сыворотки крови и способствует увеличению количества эритроцитов, необходим для построения эпителиальной ткани, возбуждающе влияет на центральную нервную систему и дыхание. Количество титана в крови резко снижается при заболеваниях крови, раке, язвенной болезни желудка и двенадцатиперстной кишки, токсикозе, ожогах. Титан в небольших количествах обнаружен во многих пищевых растениях.
Фосфор содержится в растениях и их семенах. Большую роль играет в процессах дыхания и фотосинтеза.
Фтор содержится в салате, петрушке, сельдерее, картофеле, белокочанной капусте, моркови, свекле столовой, многих зерновых культурах, ягодах, фруктах, листьях чая. Влияет на ферментативные процессы, обмен углеводов, функцию щитовидной железы. Избыток его угнетающе действует на щитовидную железу.
Хром содержится в моркови, картофеле, томатах, белокочанной капусте, репчатом луке, кукурузе, овсе, ржи, ячмене, фасоли и других растениях. Он активизирует гормон инсулин. При недостатке хрома нарушается углеводный обмен, что приводит к сахарному диабету, возникновению заболеваний глаз, замедлению роста. Трех- и шестивалентные соединения хрома (хроматы и бихроматы) очень ядовиты; могут вызывать рак легких и разные аллергические заболевания.
Хлор — постоянный компонент тканей растений и животных. Необходим для образования кислорода в процессе фотосинтеза. В плазме крови около 1 % солей хлористого натрия, калия и кальция, что дает солоноватый вкус и слабощелочную реакцию крови. Хлористый натрий играет основную роль в поддержании относительного постоянства химического состава в организме и водно-солевого обмена, способствуя удержанию тканями воды. Хлор, являясь основной частью соляной кислоты, активно влияет на пищеварение.
Цинк участвует в синтезе РНК, белков, входит в состав ряда ферментов, является активатором гормона инсулина, участвует в клеточном дыхании, развитии скелета, обеспечении иммунитета и нормальном функционировании половых желез. Повышенное содержание этого микроэлемента оказывает канцерогенное влияние. При дисбалансе цинка возникают тяжелые заболевания — карликовость, бесплодие, половой инфантилизм, различные анемии, дерматиты и т. д. Один из признаков дефицита цинка в организме — появление белых пятен или полос на ногтевых поверхностях. К растениям, содержащим много цинка, относятся фиалка полевая, череда и чистотел большой. Сверхконцентраторы цинка — алоэ древовидное, береза повислая, лапчатка прямостоячая, сушеница топяная.
2.4 МЕТОДЫ ОПРЕДЕЛЕНИЯ ПОДЛИННОСТИ ЛЕКАРСТВЕННОГО РАСТИТЕЛЬНОГО СЫРЬЯ
Подлинность лекарственного растительного сырья определяют четырьмя анализами.
Макроскопический анализ. Для его проведения следует знать морфологию растений. Изучают внешний вид сырья невооруженным глазом или с помощью лупы (Х10), измеряют размеры частиц с помощью миллиметровой линейки. При дневном освещении определяют цвет сырья с поверхности, на изломе и на разрезе. Запах устанавливают при растирании или разломе частей растений, а вкус — только у неядовитых растений. При изучении внешнего вида обращают внимание на морфологические признаки частей сырья.
Микроскопический анализ. Используют для определения подлинности измельченного лекарственного растительного сырья. Для этого нужно знать анатомическую структуру растений в целом и характерные для конкретного растения признаки, отличающие его от других растений.
Химический анализ. Предусматривает проведение качественных, микрохимических, гистохимических реакций и сублимации для определения в сырье действующих или сопутствующих веществ. Микрохимические реакции целесообразнее проводить параллельно с микроскопическим анализом. Гистохимические реакции проводят для выявления конкретных соединений в местах их локализации в растении. Под сублимацией понимают получение из растительного сырья легко возгоняемых при нагревании веществ с последующей качественной реакцией с сублиматом.
Люминесцентный анализ. Основан на использовании источников излучения (газоразрядных ламп), возбуждающих люминесценцию, и светофильтров, выделяющих нужный спектральный участок. Люминесцентный анализ проводят для определения в лекарственном сырье веществ, обладающих люминесценцией.
2.5 МЕТОДЫ ОПРЕДЕЛЕНИЯ ДОБРОКАЧЕСТВЕННОСТИ ЛЕКАРСТВЕННОГО РАСТИТЕЛЬНОГО СЫРЬЯ
Доброкачественность растительного лекарственного сырья зависит от многих факторов и определяется правильностью и своевременностью его заготовки, содержанием биологически активных веществ, уровнем влажности, отсутствием плесени, посторонних примесей и вредителей. Без анализов качества лекарственное сырье не допускают к использованию. Определяют доброкачественность специальными методами исследования, которые включают приемку сырья, отбор проб и их анализ.
Приемка сырья. Вначале изучают приложенные документы и проводят внешний осмотр партии. Партия — это не менее 50 кг сырья одного наименования, однородного по всем показателям и оформленного одним сопроводительным документом. В сопроводительном документе должны быть указаны: наименование сырья, адрес отправителя, дата отправки, номер и масса партии, год, месяц и район заготовки, результаты испытания качества сырья, обозначение НТД на сырье, фамилия, должность и подпись ответственного лица. На склады сырье, как правило, поступает крупными партиями, поэтому есть понятие единица продукции, которое включает грузовые места, состоящие из различных упаковок.
Внешним осмотром определяют правильность маркировки и целостность тары. Продукцию с поврежденной тарой проверяют отдельно. Отбор проб. Количество проб зависит от объема поступившего сырья. При поступлении партии до 5 ед. продукции отбирают пробы из каждой упаковки. В партии 6—50 ед. продукции отбирают пробы из пяти упаковок. Из партии более 50 ед. отбирают пробы из 10 % ед. продукции из разных мест партии. При повреждении тары пробы отбирают из каждой единицы продукции.
Отобранные единицы продукции вскрывают и визуально определяют однородность сырья по подготовке, цвету, запаху, степени засоренности посторонними примесями и ядовитыми растениями, наличию гнили, плесени и амбарных вредителей. При обнаружении неоднородности сырья, плесени и гнили вся партия подлежит рассортировке и вторично предъявляется к сдаче. При наличии в сырье ядовитых растений, амбарных вредителей, не характерного для предъявляемого сырья запаха, не исчезающего при проветривании, партию сырья не принимают.
От каждой из отобранных единиц продукции берут точечные пробы из трех разных мест: сверху, из середины и снизу. Сырье из мешков и тюков отбирают рукой, семена и мелкие плоды — зерновым щупом. Точечные пробы объединяют в единую пробу, из которой методом квартования выделяют среднюю, а из нее — аналитическую пробу. Масса средней пробы зависит от вида сырья и может колебаться от 150 до 6000 г.
Отклонение от установленной средней массы пробы не должно превышать 10 %.
Наименование сырья _________ Масса (г)
Трава цельная 600
за исключением
травы донника, душицы, тимьяна, 150
чабреца
Трава измельченная 200
Листья
цельные 400
за искючением:
листьев сенны 200
листьев брусники и толокнянки 150
Листья резаные, обмолоченные 200
Цветки 300
за исключением
цветков ноготков, цветков ромашки 200
аптечной
Кукурузные столбики с рыльцами 200
Корни,
клубни, корневища цельные 600
за исключением:
корневища лапчатки, корневища и корня 1000
девясила
корневища мужского папоротника, корня 1500
ревеня
корня солодки очищенного 2500
корня солодки неочищенного, барбариса 6000
корневища и корня марены 400
Корни и корневища резаные, дробленые 250
Корни и корневища в порошке 150
Кора цельная 600
Кора резаная 200
Плоды сочные 200
за исключением:
плодов шиповника 300
плодов перца стручкового 550
Плоды сухие и
семена 300
за исключением:
плодов амми 150
семян дурмана индейского, термопсиса 200
Почки березовые 150
Почки сосновые 350
Морская капуста шинкованная 1000
Морская капуста порошок 400
Рожки спорыньи 200
Березовый гриб-чага 3000
Среднюю пробу лучше хранить в многослойном бумажном мешке с этикеткой, на которой указывают дату отбора пробы, фамилию и должность лица, выполнившего работу, наименование сырья и поставщика, массу и номер партии.
Масса аналитической пробы зависит от вида сырья и характера анализа: для определения влажности 15—500 г, содержания золы —25— 1000, измельченности и содержания примесей — 25—5000 г (табл. 1). Из средней массы вначале отбирают пробу для определения измельченности и наличия примесей, затем крупные виды сырья (траву, корни и др.) оставшейся части средней пробы режут на куски средней величины, перемешивают и отбирают пробы для определения влажности и содержания золы. Пробу, отобранную для определения влажности, необходимо сразу поместить в герметически укупоренную банку.
Анализ сырья. Его проводят по следующей схеме.
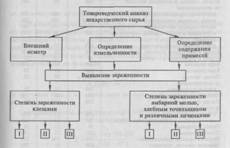
На измельченность его проводят с использованием сит на данное сырье. Большую по массе аналитическую пробу просеивают порциями. Сырье, прошедшее сквозь сито, взвешивают и определяют процент его.
Перепечатка материалов без ссылки на наш сайт запрещена