Контрольная работа: Фотоны, спектры и цвет
Контрольная работа: Фотоны, спектры и цвет
ФОТОНЫ, СПЕКТРЫ И ЦВЕТ
I. Электромагнитное излучение
Электромагнитное
излучение представляет собой поток особых частиц - фотонов (photon = «светон» по-русски). Эти частицы,
которые принято обозначать символом γ (или hn), все время летят с огромной
скоростью c = 300 000 км/с = 3·1010
см/с в вакууме (несколько медленнее в прозрачных конденсированных средах).
Направление движения и скорость представляют собой вектор скорости ![]() , который является
фундаментальным свойством (атрибутом) фотона (при этом скорость и направление,
как правило, независимы). Фотон обладает электрическим и магнитным полями,
которые совершают противофазные гармонические колебания перпендикулярно
направлению полета фотона с частотой n (Гц = с-1). Эта частота неизменна и является атрибутом фотона.
, который является
фундаментальным свойством (атрибутом) фотона (при этом скорость и направление,
как правило, независимы). Фотон обладает электрическим и магнитным полями,
которые совершают противофазные гармонические колебания перпендикулярно
направлению полета фотона с частотой n (Гц = с-1). Эта частота неизменна и является атрибутом фотона.
За период (т.е. за время одного колебания) фотон пролетает в вакууме расстояние l = c/n, которое называется «длина волны». Длине волны 550 нм (это наиболее яркий цвет для нашего глаза) соответствует частота 5,455·1014 Гц = 545,5 ТГц. Условно можно считать, что размер фотона равен (соответствует) величине l.
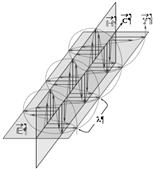
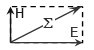
Рис. 1. Схема движения фотона.
![]() - фотон и его спиральная траектория;
- фотон и его спиральная траектория; ![]() - вектор скорости фотона;
- вектор скорости фотона; ![]() - вектор напряженности
магнитного поля;
- вектор напряженности
магнитного поля; ![]() - вектор
напряженности электрического поля фотона; l - длина волны.
- вектор
напряженности электрического поля фотона; l - длина волны.
На рис. 1 показана схема движения фотона. Плоскость колебаний вектора H называется плоскостью поляризации или просто поляризацией фотона; плоскость колебаний вектора E так и называется - плоскость колебаний. В вакууме эти плоскости фиксированы (неизменны) в пространстве, поэтому поляризация является одним из атрибутов фотона.
Если провести кривую через сумму векторов H и E (сумма векторов равна диагонали прямоугольника, сторонами которого являются слагаемые вектора) получится спираль, закрученная либо по часовой стрелке (правая спираль), либо против часовой стрелки (как на рис. 1, левая спираль). Эти две возможные пространственные траектории соответствуют квантово-механическому свойству элементарных частиц, которое называется «спин» и которое у фотона имеет 2 состояния (±1). Спин и соответствующая спиральность представляют собой важное фундаментальное свойство фотона. Важнейшим атрибутом фотона является его энергия: Eγ = h·n = h·c/l; здесь h = 6,626·10-34 Дж·с – фундаментальная физическая константа, которая называется «постоянная Планка»; c - скорость света в вакууме.
Энергии фотонов видимого света расположены в диапазоне от ~160 кДж/моль (дальний красный свет) до ~310 кДж/моль (дальний фиолетовый свет). Для l = 550 нм (см. выше) Eγ = NA·3,614·10-19 Дж/(моль g) = ~218 кДж/моль (NA = 6,022·1023 моль−1 - число Авогадро).
Для сравнения «условно средняя» энергия гамма-квантов (фотонов гамма-излучения) около 5∙1011 Дж/моль = 500 000 000 кДж/моль(!), а энергия, выделяемая при окислении глюкозы до CO2 и H20, составляет ~2870 кДж/моль[1], однако в организме большая часть (~60%) этой энергии рассеивается (переходит в тепло) и запас химической энергии составляет ~1145 кДж/моль глюкозы - это 36 молекул АТФ с энергией гидролиза ~31,8 кДж/моль АТФ.
Таким образом, существует 5 фундаментальных свойств фотона: скорость, направление, поляризация, энергия (или сопряженная частота) и спин (или сопряженная спиральность).
Монохромное (монохроматическое) и гетерохромное излучение. Цвет.
Поток фотонов с приблизительно одинаковыми значениями n называется монохроматическим (или монохромным) излучением (одноцветное излучение по-русски). В видимом диапазоне оно воспринимается как окрашенный световой поток. Цвет однозначно определяется энергией (или сопряженной частотой) фотонов, что позволяет приписать фотону цвет соответствующего монохромного излучения. Наиболее чистые монохромные линии излучения дают лазеры: полуширина (т.е. ширина на половине высоты) линии испускания гелий-неонового лазера меньше 0,01 нм (рис. 2). Лазерные фотоны, кроме того, имеют одинаковые направления и поляризации, т.е. практически идентичны. Такое излучение называется когерентным.
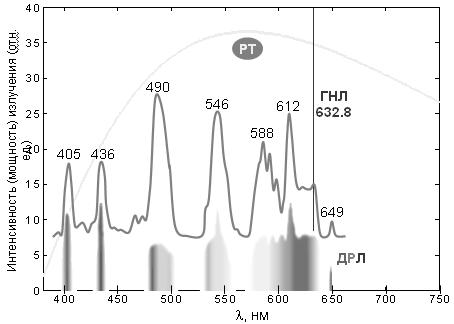
Рис. 2. Спектры испускания трех типов источников фотонов оптического диапазона электромагнитного излучения.
ГНЛ – гелий–неоновый лазер: монохроматическое излучение при 632,8 нм; ДЛР – дуговая ртутная лампа (высокого давления): линейчатый (дискретный) спектр (показан его вид в спектроскопе и соответствующий график с указанием длин волн некоторых линий люминесценции паров ртути); РТ – раскаленные тела (солнце, лампа накаливания): сплошной (непрерывный) спектр излучения.
Однако наиболее распространенные источники электромагнитного излучения, например, солнце, испускают фотоны с различными энергиями (гетерохромное излучение), которые различаются по всем фундаментальным свойствам. Совокупность этих фотонов образует СПЕКТР испускания.
Спектром какого-либо параметра в общем случае называется зависимость параметра от частоты (или точнее – распределение значений параметра по частоте). В оптике спектром также называют и чаще используют зависимость параметра от длины волны в вакууме, которую называют просто «длина волны».
Как видно из рисунка, существует 2 типа такого излучения – дискретное и непрерывное. Дискретные линейчатые спектры характерны для атомов и небольших молекул в газовой фазе (при нормальном или умеренном давлении). Сплошные (непрерывные) спектры в оптическом диапазоне характерны для тел, нагретых до нескольких тысяч градусов.
Совокупность фотонов, исходящих от солнца (спектр излучения солнца) в космосе соответствует температуре ~6000° с максимумом при ~500 нм. Этот спектр наш зрительный анализатор принимает за «точку отсчета», и мы воспринимаем его как белый цвет. В атмосфере коротковолновая часть спектра рассеивается, и максимум спектра сдвигается ~ к 550 нм (слегка желтоватый цвет).
II. Взаимодействие фотонов электромагнитного излучения с
веществом
Фотоны весьма эффективно взаимодействуют с электронами – как свободными, так и входящими в состав атомов и молекул, причем оптические фотоны взаимодействуют исключительно с внешними электронами, которые поэтому называются оптическими электронами: взаимодействуют векторы электрического поля частиц. Существует два основных типа таких взаимодействий: упругие и резонансные.
1. Упругие взаимодействия. Фотоны видимого и ультрафиолетового излучения «залипают» (задерживаются) на внешних электронах атомов и молекул. В результате этого скорость v движения фотонов в конденсированных (плотных) прозрачных средах уменьшается:
v = c/n,
где n – (абсолютный) показатель преломления. Показатель преломления любого газа, в том числе воздуха (n = 1,0003), при обычных условиях много меньше, чем показатели преломления жидкостей (~1,5) или твердых тел (у воды n = 1,333).
При этом изменяются направление движения и поляризация фотонов и длина волны, но энергия (и частота) и спин не изменяются.
С этим типом взаимодействия фотонов и электронов связаны такие явления, как зеркальное отражение и преломление света (рис. 3), диффузное (неупорядоченное, хаотичное) отражение, дифракция (отклонение от прямолинейного направления движения фотонов в неоднородных средах, огибание препятствий) и интерференция (взаимодействие когерентных пучков, приводящее к неравномерному распределению интенсивности излучения в пространстве) и, наконец, дисперсия – расхождение цветных лучей (фотонов с разной энергией) при преломлении и дифракции.
Упругие взаимодействия также являются причиной молекулярного рассеяния света – хаотического изменения направления и поляризации фотонов при взаимодействии с внешними электронами атомов и молекул.
Вероятность и величина этих изменений в прозрачных средах малы, но накапливаются при большом пробеге (сотни км в атмосфере) и становятся заметными, например, синее небо: рассеяние пропорционально ν4 (λ–4), и рассеиваются в основном фотоны синей области спектра. Рассеяние пропорционально n2 (n – показатель преломления), поэтому эффекты рассеяния более выражены в плотных средах, например, вода синеет на глубине (при толщине слоя) несколько метров. Рассеяние ~ пропорционально размеру молекул и/или их агрегатов (надмолекулярных комплексов или молекулярных систем, к которым можно отнести внутриклеточные частицы – митохондрии, хлоропласты etc.)
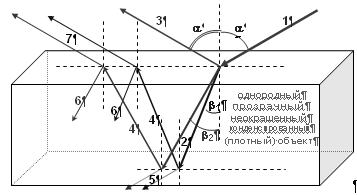
Рис. 3. Зеркальное отражение и преломление света.
Гетерохромный поток фотонов на границе двух сред разной плотности разделяется на несколько пучков: луч отражения (3) и лучи преломления (2). Если среда, из которой поток исходит (луч 1) – вакуум или газ, а плотная среда прозрачна и однородна, то характер распределения фотонов по пучкам определяется спектральным составом и поляризацией входящего луча и показателем преломления n = c/v плотной среды: sin(a)/sin(b) = n; n синего луча ~ на 2% больше, чем n красного луча, т.е. углы преломления разноцветных лучей незначительно различаются: b2 – b1 = ~1º, но на больших расстояниях расхождение лучей – дисперсия – становится существенным (радуга, например).
Оба выходящих пучка (2 и 3) частично поляризованы, даже если входящий луч (1) не поляризован (т.е. состоит из фотонов с разной произвольной поляризацией): пучок 2 частично поляризован в плоскости, перпендикулярной плоскости отражения, а луч 3 – частично или полностью (tg(a) = n) поляризован в плоскости отражения.
Если плотный объект имеет плоскую параллельную нижнюю грань, как на рисунке, на этой грани произойдет отражение (4) и преломление (5), а отраженный луч в свою очередь отразится (6) и преломится (7) на верхней грани и т.д. Причем лучи 1 и 5, 2 и 6, 3 и 7 параллельны, а углы отражения лучей 4 равны b1 и b2, соответственно. Если sin(b) > 1/n, наблюдается явление полного внутреннего отражения (преломленные лучи 5 и 7 отсутствуют), – это свойство реализуется в волоконной оптике.
2. Резонансные взаимодействия – поглощение света.
Все атомы и молекулы, наряду с заполненными s, p, d и f орбиталями, имеют большое количество вакантных – не заполненных – орбиталей, как это показано на рис. 4.
Эти орбитали далеко отстоят от уровня энергии ближайших к ним внешних оптических электронов молекулы, и самопроизвольно электроны не могут попасть на эти орбитали. Однако электрон может захватить подходящий фотон и перескочить на одну из вакантных орбиталей.
Этот переход имеет свойства электрического диполя и характеризуется дипольным моментом перехода μ = q∙l (q – заряд электрона, l – длина диполя), который имеет строго определенное направление относительно молекулярных осей. Для захвата фотона, который (захват) называется поглощением света и приводит к возбуждению молекулы, необходимо выполнение следующих условий:
1) электрон и фотон находятся на расстоянии взаимодействия;
2) резонанс энергий: разность энергий основного S0 и возбужденного Sk состояний электрона равна энергии фотона (поэтому резонансные взаимодействия);
3) направление дипольного момента перехода S0 → Sk в пространстве ~ совпадает с направлением колебаний вектора E электрического поля фотона (в растворе молекулы ориентированы в пространстве хаотично, и 1/3 из них всегда удовлетворяет этому условию);
4) совпадают спины (спиновые состояния) электрона и фотона.
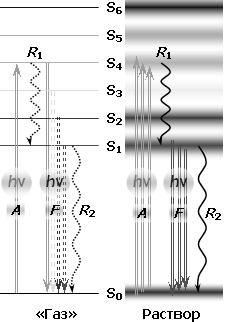
Рис. 4. Структура внешней электронной оболочки сложной органической молекулы.
S0 – основное состояние, молекулярная орбиталь, на которой находятся внешние оптические электроны; S1–S6 – вакантные орбитали; A – захват фотона, поглощение (возбуждение молекулы); F – излучение фотона, флуоресценция (люминесценция, свечение молекулы); R1 – тепловая релаксация возбужденных состояний (с потерей части энергии фотона); R2 – тепловая релаксация в основное состояние (с полной потерей энергии) – фотон исчезает.
Слева – виртуальная структура в газовой фазе (по аналогии с атомными спектрами), которой соответствует линейчатый спектр поглощения; справа – реальная структура с «размытыми» электронными уровнями вследствие внутри– и межмолекулярных взаимодействий. Структуре соответствует гладкий широкополосный спектр поглощения (рис. 5).
В виртуальной структуре возбужденные уровни не взаимодействуют, переходы между ними маловероятны, поэтому основной канал дезактивации возбужденных состояний – флуоресценция (почти без потери энергии).
В реальной структуре уровни существенно перекрываются, и возбуждение ~ за 10–12 с скатывается на нижнюю орбиталь, на которой задерживается на время 10–9–10–8 с, в течение которого переходит в основное состояние путем тепловой релаксации (R2) или с излучением фотона флуоресценции (F).
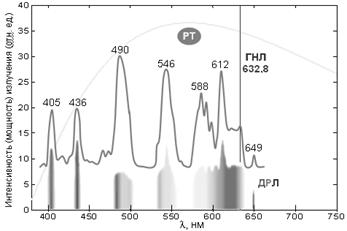
Рис. 5. Спектры поглощения сложной органической молекулы (пигмента).
Показан виртуальный линейчатый спектр молекулы в газовой фазе и реальный широкополосный спектр поглощения молекулы в растворе. Соответствующие электронные структуры молекулы приведены на рис. 4.
При соблюдении этих условий электрон с большой вероятностью захватит фотон и перейдет на соответствующую вакантную орбиталь Sk. Поскольку таких уровней много, поглощение молекулы в целом характеризуется спектром поглощения. Для электронной структуры, показанной на рис. 4, соответствующие спектры поглощения приведены на рис. 5.
У сложных органических молекул в конденсированных средах вследствие внутри– и межмолекулярных взаимодействий возникает большая неопределенность энергий молекулярных орбиталей, электронные уровни становятся размытыми и перекрываются между собой (рис. 4), в результате чего возбужденный электрон быстро (~ за 1 пс) скатывается на нижний возбужденный уровень S1 (см. подпись к рис. 4), откуда он переходит в основное состояние либо путем безизлучательной тепловой релаксации, либо с излучением фотона флуоресценции. Энергия этих фотонов значительно меньше, чем у исходного, захваченного фотона, а излучаются они в направлении, перпендикулярном направлению перехода S0 → S1; за время жизни возбуждения (среднее время пребывания электрона на S1) молекула в растворе успевает повернуться на любой угол, поэтому направление движения и поляризация фотона флуоресценции могут быть любые, случайные, а спиновое состояние – как у электрона на S1 орбитали (как правило, совпадает с исходным). В результате резонансных взаимодействий фотона и электрона (захвата фотона молекулой) этот фотон исчезает. Вместо него может появиться новый фотон с меньшей энергией, произвольным направлением движения, поляризацией и спином (спин электрона может измениться в процессе релаксации), т.е. меняются ВСЕ фундаментальные свойства фотона или он вообще исчезает.
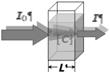
Рис. 6. Схема измерения коэффициентов и спектров поглощения пигментов в растворе.
Параллельный (сфокусированный) пучок фотонов, как правило, монохроматический с переменной длиной волны, пропускают через кювету с раствором пигмента. При прохождении через раствор пучок ослабляется, т.к. часть фотонов поглощается молекулами пигмента. Процесс поглощения описывается законом Бугера–Ламберта–Бера[2].
Закон Бугера–Ламберта–Бера можно выразить следующими формулами:
T = I/I0 = 10–D; D = k(l)·L;
здесь I0 – интенсивность (мощность) входящего пучка фотонов, I – интенсивность (мощность) выходящего пучка, L – толщина слоя вещества, через которое проходит свет (длина оптического пути); T – [оптическое] пропускание; D – оптическая плотность; k(λ) – [десятичный] показатель поглощения, характеризующий свойства вещества и зависящий от длины волны (в вакууме) λ поглощаемого света. Эта зависимость называется спектром поглощения вещества.
Для растворов пигментов в непоглощающих растворителях k(λ) = e(l)·[C], где e(l) – молярный коэффициент поглощения, [C] – концентрация растворенного вещества, моль/л.
Спектры k(λ), e(l) и D(l) не зависят от концентрации. Спектр пропускания T(l,C), наоборот, зависит, однако именно этот спектр, с учетом спектральной зависимости нашего субъективного восприятия, однозначно определяет цвет пигмента.
Рассмотрим связь поглощения и цвета на примере растворов растительного пигмента антоциана, который обуславливает окраску цветов и зрелых плодов и ягод. Спектры поглощения антоциана (точнее, смеси антоцианов) приведены на рис. 7.
Эксперимент выполнен ученицей 9б класса МОУ Лицея «Физико-техническая школа» (г. Обнинск) Юлией Дуфлот под руководством преподавателя химии высшей категории Е.В. Тетенькиной. Спектры измерены на спектрофотометре «Specord» (Германия). Математическая обработка (интерполирование, экстраполирование и сглаживание спектров) проведена в среде MatLab (MatLab®, the MathWorks, Inc.) автором, сотрудником ВНИИ СХРАЭ РАСХН (г. Обнинск, 109 км Киевского шоссе) Тетенькиным В.Л.
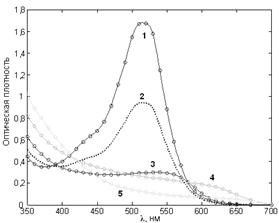
Рис. 7. Спектры поглощения антоцианов из ягод черники при разных pH растворов.
Цвет линий и точек приблизительно соответствует окраске растворов пигментов (в скобках – pH образцов по универсальному индикатору): образцы №1 (2,5) и №2 (4) красные; №3 (6,5) розовый; №4 (8) зеленоватый; №5 (10) светло-желтый.
Как видно из рисунка 7, спектры антоциана очень подвижны, зависят от pH раствора и, как показал эксперимент, могут соответствовать практически любому цвету раствора. Широкая цветовая гамма антоцианов и простота смены цвета объясняет, почему именно этот пигмент выбран природой для окраски. Локализация пигмента в вакуолях (рис. 9) позволяет создать любую его концентрацию и придать окраске необходимую густоту и насыщенность.
При движении от кислой к щелочной среде можно отметить монотонные изменения спектров поглощения антоцианов:
1) уменьшается амплитуда поглощения в видимой области спектра, т.е. растворы становятся более светлыми (прозрачными);
2) максимум в видимой области смещается в длинноволновую сторону, что приводит к характерным изменениям цвета растворов;
3) увеличивается амплитуда поглощения в фиолетовой (ультрафиолетовой) области спектра, доминирование поглощения в которой придает растворам желтоватый оттенок.
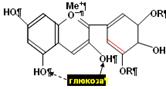
Рис. 8. Антоциан дельфинол.
Присоединения глюкозы превращает антоцианидин дельфинидол в антоциан (моно или дигликозид).
У пигментов все 7 двойных связей сопряжены, одна из них (красная) – полуизолирована.
Катион металла у оксоний–аниона кислорода определяет цвет пигментов: Fe – синий, Mo – фиолетовый, Ca – пурпурный. Цвет зависит также от диссоциации OH групп и, следовательно, от pH раствора пигментов.
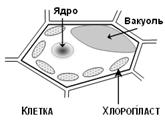
Рис. 9. Схема строения клетки растений.
Все пигменты фотосинтеза (хлорофиллы, каротиноиды) находятся во внутренних мембранах хлоропластов, а водорастворимые антоцианы локализованы в изолированных мешках — вакуолях. В живых листьях антоцианы поглощают избыточную солнечную радиацию в видимой области спектра (максимум поглощения антоцианов расположен в области энергетического максимума излучения солнца) и ультрафиолет, защищая, таким образом, важные молекулярные компоненты клеток от повреждения. В цветах и зрелых плодах антоцианы обуславливают их окраску, хлоропласты отсутствуют, а вакуоль с раствором антоцианов занимает почти весь объем клетки, что придает окраске необходимые густоту, колорит, яркость и насыщенность.
При увеличении концентрации возрастает вклад слабых полос в формирование цвета раствора. В частности, например, образец 4 при высокой концентрации, вероятно, будет «казаться» синим, а образец 5 – зеленоватым.
Структурная химическая формула одного из антоцианов показана на рис. 8. Большое число двойных сопряженных связей и анион оксония в гетероцикле приводят к общему смещению главного длинноволнового максимума ~ в середину оптического диапазона. Конкретное положение и амплитуда максимума зависят от pH раствора и катиона (рис. 8).
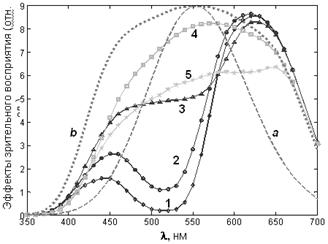
Рис. 10. Спектральные эффекты зрительного восприятия света:
a – спектр поглощения пигментов клеток сетчатки человеческого глаза (колбочек), ответственных за цветовосприятие; b – спектр цветовосприятия человека (спектральная чувствительность сетчатки, скорректированная зрительным анализатором); 1, 2, 3, 4, 5 – спектры зрительного восприятия окраски антоциана при разных pH растворов (см. рис. 7). Номера соответствуют номерам образцов.
По спектрам, представленным на рис. 7, можно рассчитать пропускание растворов и определить их цвет.
Зрительный эффект, производимый цветом светового луча некоторой длины волны, пропорционален интенсивности излучения и чувствительности зрительного анализатора к электромагнитному излучению этой длины волны:
эффект = Const·T·b,
где T – оптическое пропускание растворов пигмента, b – спектральная зависимость цветовосприятия.[3] Спектры цветовосприятия растворов антоциана с различными значениями pH представлены на рис. 10.
Из указанных спектров рассчитаны вклады цветовых составляющих палитры RGB в каждый из спектров растворов антоциана, суммой которых окрашены круги, показанные на рис. 11.
Совпадение с реальной окраской растворов антоциана очень хорошее. Синий цвет, подобный 4a, имеет экстракт ягод черники, в котором концентрация антоцианов достаточно велика, при щелочных pH.

Рис. 11. Реконструкция цвета растворов антоциана из ягод черники.
Цвета получены в палитре RGB (Red-Green-Blue) компьютера, соотношение интенсивностей цветов RGB рассчитано из спектров зрительного восприятия окраски растворов антоциана (рис. 10). Номера окрашенных кругов соответствуют номерам образцов. 4a – образец 4 при ~ пятикратно увеличенной концентрации антоциана: при высоких концентрациях происходит ассоциация (как правило, димеризация) молекул пигментов, вследствие которой происходит перераспределение амплитуд коротковолновых и длинноволновых полос поглощения в пользу последних. В результате этого в спектре 4 (рис. 10) наряду с общим уменьшением амплитуд произойдет значительное ослабление красной составляющей (650 нм) и существенное усиление синей составляющей (450 нм). Комбинирование RGB дает цвет 4a.
III. Особенности человеческого цветовосприятия
В сетчатке глаза имеется 3 типа специальных клеток – колбочек, содержащих 3 разных зрительных пигмента с различающимися спектрами поглощения. Общий спектр этих пигментов показан на рис. 9 (кривая a). Этих трех пигментов в трех типах колбочек достаточно для различения огромного количества цветовых оттенков.
При поглощении пигментом фотона колбочки посылают импульс в зрительный анализатор, расположенный в затылочной части коры головного мозга. Анализатор подразделен на три: анализатор контуров, анализатор движения и анализатор цвета. Первые два получают информацию от других клеток сетчатки – палочек, а сигналы от колбочек поступают в анализатор цвета, который выдает информацию о пространственном распределении цветовой палитры. В сознание поступает интегрированная информация всех трех анализаторов.
Колбочки первого типа (К1) содержат пигмент, поглощающий синий свет (~450 нм); колбочки второго (К2) и третьего (К3) типов содержат пигмент, поглощающие в широком спектральном диапазоне с максимумом в желто-зеленой области спектра (~550 нм); спектр К3 смещен относительно К2 ~ на 10 нм в длинноволновую сторону.
Частота нервных импульсов, поступающих в анализатор, зависит от λ и пропорциональна амплитуде поглощения колбочек при этой длине волны.
Обработка информации начинается уже в нервных волокнах: импульсы от К1 и К2 поступают непосредственно в анализатор, а импульс от К3 гасится импульсами от К2. Вследствие этого в спектральной области, где поглощение К2 ³ К3, импульс от К3 в анализатор проходит редко, т.к. высока вероятность его подавления импульсом от К2. В длинноволновой части спектра поглощение К3 >> К2, импульс от К3 гасится редко. В результате спектр импульсов от К3 оказывается в красной области спектра (~650 нм). Таким образом формируется третий квазипигмент.[4]
Очевидно, что амплитуды поглощения этих пигментов неодинаковы: поглощение и частота импульсов от пигмента К1 и квазипигмента К3 ~ в 5 раз меньше, чем у желто-зеленого пигмента К2. Анализатор корректирует спектральную чувствительность зрения с использованием всего накопленного опыта и запомненной информации, подравнивая спектральную чувствительность к виду (рис. 10, кривая b), близкому к спектру солнечного излучения, прошедшего через атмосферу.
Три типа детекторов цвета в сетчатке означает, что в цветовосприятии должны существовать три базовых цвета.. Предположительно это – красный, желтый и синий, комбинации которых показаны на рис. 12.
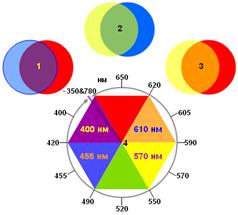
Рис. 12. Спектральные особенности зрительного анализатора человека.
1, 2 и 3 – комбинации трех базовых цветов, предположительно красного, желтого и синего, за распознавание которые отвечают три типа колбочек и три зрительных пигмента, в результате дают 3 промежуточных цвета[5] (в парах кругов один – полупрозрачный). При этом фиолетовый цвет оказывается между красным и синим. Это означает, что линейная цветовая шкала (соответствующая шкале длин волн) в анализаторе цвета свернута в кольцо (4), как это показано на рисунке.
Комбинации пар этих цветов дает промежуточные 3 цвета (фиолетовый, зеленый и оранжевый), при этом фиолетовый оказывается промежуточным между красным и синим. Это означает, что у зрительного анализатора линейная цветовая шкала свернута в непрерывное кольцо, как это показано на рис. 12 (см. подпись к рис. 12).[6]
Это наблюдение подтверждают и непосредственные эксперименты по восприятию цвета: цвет лучей в дальней красной области бордовый, который относится скорее к фиолетовой цветовой гамме, чем к красной. Соответственно, цвет лучей фиолетовой коротковолновой области приобретает красноватый оттенок (пурпурный цвет). Смыкание шкалы происходит при длинах волн, которые глаз и анализатор уже не видят (около 350 и 780 нм).
Эта свертка создает возможность для компактной формы записи и хранения информации: необходимо хранить коды трех базовых цветов и для любого оттенка – 3 числа (вернее, их мозговые аналоги или коды), которые соответствуют интенсивности трех базовых цветов в окраске объекта. Большей информацией анализатор цвета и не располагает, поскольку пигментов всего 3.[7]
В линейной шкале тоже можно выделить базовые оттенки, но в эту базовую цветовую систему должны обязательно входить краевые цвета: дальний красный и дальний фиолетовый, которые для анализатора ничего не означают и зрительно не представимы, поскольку человек их никогда не видел. По этой же причине этим базовым компонентам невозможно приписать «число», соответствующее амплитуде компонента. Если же взять те же базовые цвета, что получились при кольцевой свертке, спектральные области ниже 450 нм и выше 650 нм не могут быть оцифрованы и выпадают из анализа.
В случае простых спектров шестиугольник цветовосприятия (рис. 12) позволяет предсказать цвет пигмента, если известно спектральное положение его максимума поглощения: цвет будет противоположным. Например, в спектре образца №1 (рис. 7) ярко выраженный максимум расположен при 520 нм, следовательно, цвет раствора – красный.
Для двухкомпонентных спектров излучения или пропускания с ~ одинаковыми амплитудами компонентов цвет будет промежуточным. Например, объект, спектр которого состоит из синей и зеленой полос, будет голубой etc. Сложение противоположных цветов дает цвет в черно-белой палитре.
Кроме трех «чисел», характеризующих цвет, цветовой анализатор передает в интегратор информацию о форме (по аналогии с цветом можно предположить, что анализатор имеет базовый набор форм – круг, квадрат etc.), размере (это «число») и координатах в пространстве (3 «числа») данного цветного пятна и, последовательно, всех таких пятен в поле зрения. Интегратор с использованием информации от анализатора контуров детализирует форму цветного пятна, и в сознание поступает четкая цветная картинка.
Литература
1. В.Л. Тетенькин, ВНИИ Сельскохозяйственной Радиологии и АгроЭкологии, г. Обнинск, 109 км Киевского шоссе, 2011 г.
[1] ~685 ккал (1 кал = 4,1868 Дж)
[2] Закон открыт экспериментально французом Пьером Бугером (1729 г.), проанализирован немцем И.Г. Ламбертом (1760 г.) и в отношении концентрации C проверен на опыте немцем А. Бером (1852 г.)
[3] Эта блестящая идея пришла в голову автору в процессе написания статьи.
[4] Эта блестящая гипотеза придумана автором в процессе написания статьи.
[5] На разных дисплеях цвета выглядят немного по-разному
[6] Эта блестящая гипотеза придумана автором в процессе написания статьи.
[7] Эта блестящая идея пришла в голову автору в процессе написания статьи.
Перепечатка материалов без ссылки на наш сайт запрещена