Курсовая работа: Гормоны
Курсовая работа: Гормоны
Министерство образования и науки Кыргызской Республики
Кыргызский Государственный Университет им. И.Арабаева
Факультет биологии и химии
Кафедра общей биологии и современной технологии ее обучения
Курсовая работа
На тему: ГОРМОНЫ
Выполнила: Акматова М.К.
гр.Б-53
Проверила: доц. Бейшеналиева С.Т.
Бишкек-2009
План
Введение
1.Химическая природа и классификация гормонов
2. Механизм действия гормонов. Роль циклазной системы в механизме действия гормонов
3. Строение, биороль простагландинов и тромбоксанов
4. Регуляция секреции гормонов
5. Гормональная регуляция углеводного, липидного, белкового и водно-солевого обмена
Заключение
Литература
Введение
В этой курсовой работе в курсе биохимии я выбрала тему «Гормоны». Изучив анатомию, морфологию и физиологию гормонов мы уже знаем, что гормоны играют очень большую роль в организме человека и животных. И ходе этой курсовой работы я хочу изучить биохимию гормонов, т.е. подробнее узнать об их химическом составе и о их строении, так же узнать какие химические процессы протекают с участием гормонов в живых организмах.
Гормоны - это то, что делает нас особенным и непохожим на остальных. Они предопределяют наши физические и психические особенности. Вырастем мы высоким или не очень, полным или худым.
Наши гормоны влияют на все аспекты нашей жизни - с момента зачатия и до самой смерти. Они будут влиять на наш рост, половое развитие, формирование наших желаний, на обмен веществ в организме, на крепость мышц, на остроту ума, поведение, даже на наш сон.
Слово „гормон“ часто вызывает фривольные ассоциации: у кого-то они выделяются в избытке, да ещё и где-то играют. Но о том, как гормоны играют, мы поговорим в другой раз. Сейчас — о том, как они работают.
Эта удивительная управляющая система возникла в ходе эволюции, вероятно, чуть позже многоклеточности и одновременно с кровеносной системой. На самом деле даже одноклеточные существа небезразличны к химическим сигналам, приходящим извне, в том числе от других клеток. Но только у многоклеточных могла появиться изощрённая многоуровневая регуляция, известная под названием эндокринной системы.
Она управляет именно теми функциями организма, которые чаще всего бывают неподвластны воле и сознанию, от переработки питательных веществ до влюблённости, от роста рук, ног и туловища до колебаний настроения, от зачатия ребёнка до таинственной деятельности внутренних органов, которые многим своим хозяевам и по именам-то не известны. Вернее, наоборот: эти функции неподвластны воле, потому что управляются не нервной, а эндокринной системой. Специальные клетки в железах и тканях вырабатывают гормоны (от греч. hormamo — приводить в движение, побуждать). Эти вещества выделяются во внеклеточное пространство, в кровь и лимфу, а с их токами попадают в „мишени“ — органы и клетки и производят нужные эффекты. Примечательно, что они работают в очень низких концентрациях — до 10–11 моль/л.
Гормоны (от греч. hormao – привожу в движение, побуждаю) – биологически активные вещества, которые вырабатываются железами внутренней секреции и выделяются непосредственно в кровь, лимфу или ликвор. (Кононский). Они обладают строго специфическим и избирательным действием, способные повышать или понижать уровень жизнедеятельности организма.
Выделяемые гормоны из эндокринных желез отличаются от других биологически активных веществ рядом свойств:
1. Действие гормонов носит дистантный характер, иными словами, органы, на которые гормоны действуют, расположены далеко от железы.
2. Действие гормонов строго специфично. Некоторые гормоны действуют лишь на определенные клетки – мишени, другие - на множество различных клеток.
3. Гормоны обладают высокой биологической активностью.
4. Гормоны действуют только на живые клетки.
1. Химическая природа и классификация гормонов
Гормоны следует классифицировать по трем основным признакам.
1. По химической природе
2. По эффекту (знаку действия) – возбуждающие и тормозящие.
3. По месту действия на органы – мишени или другие железы: 1) эффекторные; 2) тропные.
В настоящее время описано и выделено более полутора сотен гормонов из разных многоклеточных организмов.
По химической природе гормоны делятся на следующие группы: белково-пептидные, производные аминокислот и стероидные гормоны. Первая группа — это гормоны гипоталамуса и гипофиза, поджелудочной и паращитовидной желёз и гормон щитовидной железы кальцитонин. Некоторые гормоны, например фолликулостимулирующий и тиреотропный, представляют собой гликопротеиды — пептидные цепочки, „украшенные“ углеводами. Пептидные и белковые гормоны обычно действуют на внутриклеточные процессы через специфические рецепторы, расположенные на поверхностной мембране клеток-мишеней. Гормонов имеющих белковую или полипептидную природу называют тропинами, так как они оказывают направленное стимулирующее действие на процессы роста и обмена веществ организма и на функцию периферических эндокринных желез. Рассмотрим некоторых гормонов белково-пептидной природы.
Тиреотропный гормон (тиреотропин) представляет собой сложный белок глюкопротеид с молекулярным весом около 10000. Он стимулирует функцию щитовидной железы, активирует ферменты протеазы и тем способствует распаду тиреоглобулина в щитовидной железе. В результате протеолиза освобождаются гормоны щитовидной железы – тироксин и трииодтиронин, которые поступают в кровь и с ней к соответствующим органам и тканям. Тиреотропин способствует накоплению иода в щитовидной железе, при этом в ней увеличивается число клеток и активируется их деятельность.
Тиреотропин выделятся гипофизом непрерывно в небольших количествах. Выделение его регулируется нейросекреторными веществами гипоталамуса.
Фолликулостимулирующий гормон обеспечивает развитие фолликул в яичниках и сперматогенез в семенниках. Представляет собой белок глюкопротеида с молекулярным весом 67000.
Производные аминокислот — это амины, которые синтезируются в мозговом слое надпочечников (адреналин и норадреналин) и в эпифизе (мелатонин), а также иодсодержащие гормоны щитовидной железы трииодтиронин и тироксин (тетраиодтиронин), из аминокислоты тирозина, которая, в свою очередь, синтезируется из незаменимой аминокислоты фенилаланина. К ним относятся гормоны мозгового слоя надпочечников норадреналин и адреналин, и гормоны щитовидной железы – трииодтиронин и тироксин.
Биохимическое изучение щитовидной железы началось с открытия содержания в ней значительных количеств иода (Бауман, 1896). Освальдом (1901) был обнаружен иодсодержащий белок тиреоглобулин. В 1919г. Кендалл при гидролизе тиреоглобулина выделил криссталическое вещество, содержащее около 60% иода. Эту аминокислоту он назвал тироксином (тетраиодтиронин). Образующийся в щитовидной железе тиреоглобулин не поступает в кровь как таковой. Он подвергается сначала ферментативному расщеплению, получившиеся при этом иодсодержащие тироксины и являются продуктами, выделяемыми в кровь. В тканях организма тироксины претерпевают химические превращения, образующиеся при этом продукты, очевидно, и оказывают свое действие на ферментативные системы, локализующиеся в митохондриях. Было найдено, что тироксин распределяется в клетках следующим образом: в клеточном ядре – 47 мг/%, в митохондриях – 34 мг/%, микросомах – 43мг/% и цитоплазме – 163 мг/%.
Гормоны щитовидной железы являются производными тиронина. В 1927г. Харрингтон и Барджер установили структуру тироксина, который можно считать как производное L – тиронина. Тиронин в организме образуется из аминокислоты L - тирозина. 199
Кроме тироксина, в щитовидной железе и плазме крови имеется другое, родственное ему соединение – трииодтиронин.
Корковый и мозговой слой надпочечников млекопитающих секретируют гормоны, различные как по химической природе, так и по физиологическому действию.
Гормоном мозгового слоя является адреналин. Адреналин – это продукт окисления и декарбоксилирования аминокислоты тирозина. Кроме адреналина, мозговой слой надпочечников вырабатывает также норадреналин, отличающийся от адреналина отсутствием в его молекуле метильной группы:
Адреналин и норадреналин вырабатываются различными клетками мозгового слоя. Биосинтез адреналина начинается с окисления фенилаланина, который превращается в тирозин; тирозин под влиянием фермента ДОФА - оксидазы превращается в 3,4-дегидрооксифенилаланин (ДОФА). Последний декарбоксилируется, и образуется амин, и из него норадреналин. Адреналин возникает уже как продукт метилирования норадреналина.
Третья группа как раз и отвечает за легкомысленную репутацию, которую гормоны приобрели в народе: это стероидные гормоны, которые синтезируются в коре надпочечников и в половых железах. Взглянув на их общую формулу, легко догадаться, что их биосинтетический предшественник — холестерин. Стероиды отличаются по количеству атомов углерода в молекуле: С21 — гормоны коры надпочечников и прогестерон, С19 — мужские половые гормоны (андрогены и тестостерон), С18 — женские половые гормоны (эстрогены). Многие гормоны являются членами семейств со сходной структурой, что отражает процесс молекулярной эволюции. Стероидные гормоны растворяются в жирах и легко проникают через клеточные мембраны. Их рецепторы находятся в цитоплазме или ядре клеток-мишеней.
В настоящее время из коры надпочечников выделено в чистом виде несколько десятков стероидов. Многие из них биологически неактивны, кроме таких, как альдостерол, гидрокортизон, кортизон, кортикостероид, 11- дегидрокортикостерон, 11- дезоксикортикостерон, 17-окси-11-дезоксикортико-стерон и 19- оксикортикостерон и некоторые другие. Стероиды имеют широкое применение в лечебной практике. Многие из них синтезированы и применяются при лечении болезней крови, ревматизма, бронхиальной астмы и др.
В настоящее время считают, что из перечисленных выше кортикостероидов надпочечники в основном секретируют 17- оксикортикостерон, кортикостерон и альдостерон. Все они имеют тетрациклическую структуру циклопентанпергидрофенантрена. Структурная основа такого циклического типа соединения характерна и для многих других соединений типа стероидов (холестерин, желчные кислоты, провитамин Д, половые гормоны). Многие из таких стероидов содержат 21 атом углерода и могут рассматриваться как производные прегнана или его изомера – аллопрегнана.
Стероиды коры надпочечников различаются наличием или отсутствием карбоксильных и гидроксильных групп, а также двойных связей между четвертым и пятым атомами углерода.
Кортизол (гидрокортизон) наиболее активный из естественных глюкопротеидов, регулирует углеводный, белковый и жировой обмен, вызывает распад лимфоидной ткани и торможение синтеза соединительной ткани.
Кортикостерон не содержит гидроксильной группы у семнадцатого атома углерода, и действие его отличается от действия гидрокортизона. Он не обладает антивоспалительным действием, почти не действует на лимфоидную ткань и не эффективен при заболеваниях, при которых с успехом используется гидрокортизон. У различных видов животных секретируется неодинаковое количество этих гормонов.
К стероидным гормонам также относятся половые гормоны. Это стероиды андрогенной (мужские) и эстрогенной (женские) природы.
Из природных андрогенных гормонов наиболее эффективными являются тестостерон и андростерон. Андростерон – это кортикостероид, так как у семнадцатого атома углерода находится кетогруппа. Тестостерон является просто стероидом. Он по своему строению близок к полициклическому углеводороду андростану. Андрогены отличаются от кортикостероидов, содержащих двадцать один атом углерода, отсутствием боковой цепи у семнадцатого атома углерода.
Тестостерон отличается от андростана тем, что имеет двойную связь в положении четыре и пять, кетогруппу в положении три и гидроксильную группу в положении семнадцать. В организме он расщепляется, и в ходе его распада наряду с другими метаболитами образуется андростерон.
Мужские половые гормоны является анаболическими гормонами, они стимулируют синтез и накопление белка в мышцах, наиболее выражено это в молодом возрасте. У андростерона проявляется только половое действие, но нет анаболического.
Андрогены являются синергистами (усиливают действие) некоторых других гормонов (например, кортикостероидов, гормона роста и других). В медицинской практике, животноводстве при импотенции и проявлениях недостаточности мужских половых желез применяется препарат метилтестостерон. Он отличается от тестостерона тем, что содержит метильную группу у семнадцатого атома углерода. Искусственно синтезируемый метилтестостеронв несколько раз активнее природного тестостерона.
Женские половые гормоны, или эстрогены, образуются в фолликулах яичников, в желтом теле и во время беременности в плаценте. Они являются производными эстрана, состоят из восемнадцати атомов углерода и отличаются от циклопентанопергидрофенантрена тем, что содержат только одну метильную группу тринадцатого атома углерода. Свойствами женских половых гормонов - вызывание течки у животных и разрастание слизистой оболочки матки – обладают несколько производных эстрана. Наиболее эффективными из них являются: эстрадиол, эстрон (Фолликул) и эстриол (яичник женщины секретирует примерно 1 мг эстрадиола за сутки).
2. Механизм действия гормонов. Роль циклазной системы в механизме действия гормонов
По механизму действия гормоны делят на два основные типа. Первый – это белковые и пептидные гормоны, катехоламины и гормоноиды. Их молекула, подойдя к клетке- мишени, соединяется с молекулами белковых рецепторов наружной плазматической мембраны, затем с помощью медиаторов (ц АМФ, ц ГМФ, простагландинов, Са2+) оказывает влияние на ферментные системы клетки- мишени и на обмен веществ в ней. К гормонам второго типа относят стероидные и часть тиреоидных гормонов. Их молекула легко проникает в глубь клетки- мишени через поры мембраны; взаимодействует с молекулами гликопротеидных рецепторов, локализированных в цитозоле, митохондриях на ядерной мембране, оказывая воздействие на весь клеточный метаболизм, и в первую очередь процессы транскрипции.
Механизмы действия гормонов на клетки-мишени.
В зависимости от строения гормона существуют два типа взаимодействия. Если молекула гормона липофильна, (например, стероидные гормоны), то она может проникать через липидный слой наружной мембраны клеток-мишеней. Если молекула имеет большие размеры или является полярной, то ее проникновение внутрь клетки невозможно. Поэтому для липофильных гормонов рецепторы находятся внутри клеток-мишеней, а для гидрофильных - рецепторы находятся в наружной мембране.
Для получения клеточного ответа на гормональный сигнал в случае гидрофильных молекул действует внутриклеточный механизм передачи сигнала. Это происходит с участием веществ, которых называют вторыми посредниками. Молекулы гормонов очень разнообразны по форме, а "вторые посредники" - нет.
Надежность передачи сигнала обеспечивает очень высокое сродство гормона к своему белку-рецептору.
Что такое посредники, которые участвуют во внутриклеточной передаче гуморальных сигналов?
Это циклические нуклеотиды (цАМФ и цГМФ), инозитолтрифосфат, кальций-связывающий белок - кальмодулин, ионы кальция, ферменты, участвующие в синтезе циклических нуклеотидов, а также протеинкиназы - ферменты фосфорилирования белков. Все эти вещества участвуют в регуляции активности отдельных ферментных систем в клетках-мишенях.
Разберем более подробно механизмы действия гормонов и внутриклеточных посредников.
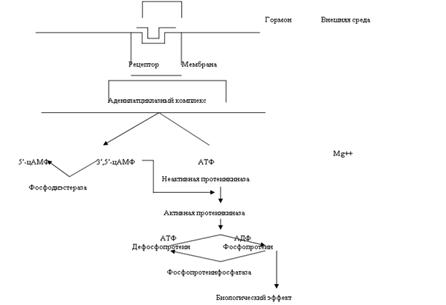
Существует два главных способа передачи сигнала в клетки-мишени от сигнальных молекул с мембранным механизмом действия:
аденилатциклазная (или гуанилатциклазная) системы;
фосфоинозитидный механизм.
Прежде чем выяснить роль циклазной системы в механизме действия гормонов, рассмотрим определение этой системы. Система циклазная – это система, состоящая из содержащихся в клетке аденозинциклофосфата, аденилатциклазы и фосфодиэстеразы, регулирующая проницаемость клеточных мембран, участвует в регуляции многих обменных процессов живой клетки, опосредует действие некоторых гормонов. То есть роль циклазной системы заключается в том, что они являются вторыми посредниками в механизме действия гормонов.
Система «аденилатциклаза - цАМФ». Мембраны фермент аденилатциклаза может находиться в двух формах - активированной и неактивированной. Активация аденилатциклазы происходит под влиянием гормон-рецепторного комплекса, образование которого приводит к связыванию гуанилового нуклеотида (ГТФ) с особым регуляторным стимулирующим белком (GS-белок), после чего GS-белок вызывает присоединение магния к аденилатциклазе и ее активацию. Так действуют активизирующие аденилатциклазу гормоны глюкагон, тиреотропин, паратирин, вазопрессин, гонадотропин и др. Некоторые гормоны, напротив, подавляют аденилатциклазу (соматостатин, ангиотензин-П и др.).
Под влиянием аденилатциклазы из АТФ синтезируется цАМФ, вызывающий активацию протеинкиназ в цитоплазме клетки, обеспечивающих фосфорилирование многочисленных внутриклеточных белков. Это изменяет проницаемость мембран, т.е. вызывает типичные для гормона метаболические и, соответственно, функциональные сдвиги. Внутриклеточные эффекты цАМФ проявляются также во влиянии на процессы пролиферации, дифференцировки, на доступность мембранных рецепторных белков молекулам гормонов.
Система «гуанилатциклаза - цГМФ». Активация мембранной гуанилатциклазы происходит не под непосредственным влиянием гормон-рецепторного комплекса, а опосредованно через ионизированный кальций и оксидантные системы мембран. Так реализуют свои эффекты натрийуретический гормон предсердий - атриопептид, тканевой гормон сосудистой стенки. В большинстве тканей биохимические и физиологические эффекты цАМФ и цГМФ противоположны. Примерами могут служить стимуляция сокращений сердца под влиянием цАМФ и торможение их цГМФ, стимуляция сокращений гладких мышц кишечника цГМФ и подавление цАМФ.
Кроме аденилатциклазной или гуанилатциклазной систем существует также механизм передачи информации внутри клетки-мишени с участием ионов кальция и инозитолтрифосфата.
Инозитолтрифосфат - это вещество, которое является производным сложного липида - инозитфосфатида. Оно образуется в результате действия специального фермента - фосфолипазы "С", который активируется в результате конформационных изменений внутриклеточного домена мембранного белка-рецептора.
Этот фермент гидролизует фосфоэфирную связь в молекуле фосфатидил-инозитол-4,5-бисфосфата и в результате образуются диацилглицерин и инозитолтрифосфат.
Известно, что образование диацилглицерина и инозитолтрифосфата приводит к увеличению концентрации ионизированного кальция внутри клетки. Это приводит к активации многих кальций-зависимых белков внутри клетки, в том числе активируются различные протеинкиназы. И здесь, как и при активации аденилатциклазной системы, одной из стадий передачи сигнала внутри клетки является фосфорилирование белков, которое в приводит к физиологическому ответу клетки на действие гормона.
В работе фосфоинозитидного механизма передачи сигналов в клетке-мишени принимает участие специальный кальций-связывающий белок - кальмодулин. Это низкомолекулярный белок (17 кДа), на 30 % состоящий из отрицательно заряженных аминокислот (Глу, Асп) и поэтому способный активно связывать Са+2. Одна молекула кальмодулина имеет 4 кальций-связывающих участка. После взаимодействия с Са+2 происходят конформационные изменения молекулы кальмодулина и комплекс "Са+2-кальмодулин" становится способным регулировать активность (аллостерически угнетать или активировать) многие ферменты - аденилатциклазу, фосфодиэстеразу, Са+2,Мg+2-АТФазу и различные протеинкиназы.
В разных клетках при воздействии комплекса "Са+2-кальмодулин" на изоферменты одного и того же фермента (например, на аденилатциклазу разного типа) в одних случаях наблюдается активация, а в других - ингибирование реакции образования цАМФ. Такие различные эффекты происходят потому, что аллостерические центры изоферментов могут включать в себя различные радикалы аминокислот и их реакция на действие комплекса Са+2-кальмодулин будет отличаться.
Таким образом, в роли "вторых посредников" для передачи сигналов от гормонов в клетках-мишенях могут быть:
циклические нуклеотиды (ц-АМФ и ц-ГМФ);
ионы Са;
комплекс "Са-кальмодулин";
диацилглицерин;
инозитолтрифосфат.
Механизмы передачи информации от гормонов внутри клеток-мишеней с помощью перечисленных посредников имеют общие черты:
одним из этапов передачи сигнала является фосфорилирование белков;
прекращение активации происходит в результате специальных механизмов, инициируемых самими участниками процессов, - существуют механизмы отрицательной обратной связи.
Гормоны являются основными гуморальными регуляторами физиологических функций организма, и в настоящее время хорошо известны их свойства, процессы биосинтеза и механизмы действия. Гормоны являются высокоспецифичными веществами по отношению к клеткам-мишеням и обладают очень высокой биологической активностью.
3. Строение, биороль простагландинов и тромбоксанов
Простагландины — биологически активные вещества, представляющие собой производные полиненасыщенных жирных кислот, молекула которых содержит 20 углеродных атомов. Биологическое действие простагландина многообразно; один из основных биологических эффектов простагландина заключается в их выраженном действии на тонус гладкой мускулатуры различных органов. Простагландины снижают выделение желудочного сока и уменьшают его кислотность, являются медиаторами воспаления и аллергических реакций, принимают участие в деятельности различных звеньев репродуктивной системы, играют важную роль в регуляции деятельности почек, оказывают влияние на различные эндокринные железы. Нарушение биосинтеза простагландина является причиной развития тяжелых патологических состояний. Синтетические и полусинтетические простагландины используют в качестве лекарственных средств.
В середине 30-х гг. 20 в. шведский ученый Эйлер (V. Euler) обнаружил в экстракте из предстательной железы (простаты) биологически активные вещества, которые он назвал простагландинами, полагая, что они вырабатываются только в предстательной железе. Позже было установлено, что простагландин образуются практически во всех органах и тканях. В 1962 г. была расшифрована химическая структура простагландинов. Оказалось, что углеродный скелет молекулы простагландина имеет вид пятичленного цикла и двух боковых цепей. Простагландины можно рассматривать как производные так называемой простановой кислоты — соединения, не существующего в природе, но полученного синтетически.
Известно около 20 различных простагландинов. В зависимости от строения их делят на несколько типов, обозначаемых буквами латинского алфавита: А, В, С, D, Е, F и т.д. Простагландины каждого типа разделяют на 1-ю, 2-ю и 3-ю серии в зависимости от числа двойных связей в боковых цепях молекулы. С учетом типа и серии простагландинов обозначают ПГЕ2 (PGE2), ПГД1 (PGD1), ПГН2 (PGH2) и т.д.
В 70-х гг. 20 в. было обнаружено, что в организме человека и животных образуются и другие биологически активные производные полиненасыщенных жирных кислот, в тромбоцитах — тромбоксаны (ТХ). Тромбоксаны были обнаружены группой шведских биохимиков во главе с Б.Самуэльсонам. От простагландинов тромбоксаны отличаются наличием в молекуле вместо пятичленного цикла шестичленного оксанового кольца, в зависимости от структуры которого различают тромбоксаны А и В (ТХА и ТХВ). Тромбоксаны обоих типов, в свою очередь, делят на 1-ю, 2-ю и 3-ю серии по тому же принципу, что и простагландины.
В организме человека и животных простагландины и тромбоксаны образуются из общего предшественника — незаменимых полиненасыщенных жирных кислот с соответствующим числом углеродных атомов и двойных связей в молекулах, в т.ч. из линолевой и арахидоновой кислот. Фактором, лимитирующим скорость биосинтеза простагладина является общее количество (пул) свободных жирных кислот, поэтому вещества, влияющие на гидролитическое расщепление триглицеридов, фосфолипидов и эфиров холестерина, в состав которых входят полиненасыщенные жирные кислоты, могут регулировать интенсивность образования простагландина. Так, катехоламины, брадикинин, ангиотензин II вызывают усиление освобождения жирных кислот в организме, тем самым косвенно стимулируя образование простагландинов. По-видимому, таков же механизм стимуляции биосинтеза простагландинов, тромбоксанов при ишемии или механическом воздействии на клетки. Кортикостероидные гормоны, напротив, подавляют биосинтез простагландина и тромбоксанов, т.к. они ингибируют освобождение жирных кислот. Некоторые соединения влияют на образование отдельных типов простагландинов и тромбоксанов, например перекиси жирных кислот специфически угнетают биосинтез простагландина I2-(простагландина I2 или простациклина), а имидазол — образование тромбоксана А2. Ряд лекарственных средств оказывает выраженное действие на образование простагландинов и тромбоксанов изменяя не только их общее количество, но и соотношение между отдельными типами и сериями. например, лекарственные средства, обладающие противовоспалительным действием, — салицилаты, индометацин (метиндол), бруфен и др. — ингибируют циклооксигеназу, катализирующую первый этап биосинтеза простгландина. Это приводит к уменьшению образования простагландинов и тромбоксанов.
Простагландины и тромбоксаны являются короткоживущими соединениями. Время полужизни некоторых из них исчисляется секундами. Быстрое разрушение простагландинов обусловливает локальность их эффектов — простагландин действуют главным образом в месте их синтеза. Метаболизм простагландина приводящий к их быстрой инактивации, осуществляется во всех тканях, но особенно активно в легких, печени и почках.
Биологическое действие простагландина многообразно благодаря не только биологической поливалентности индивидуальных простагландинов, но и большому их разнообразию. Простагландины F1 и D2 вызывают сокращение бронхов, а простагландин Е2 — их расслабление. Тромбоксан А2 сокращает стенки кровеносных сосудов и повышает АД, а простагландин I2 оказывает сосудорасширяющее действие, сопровождающееся гипотензивным эффектом. Антагонистические взаимоотношения между тромбоксаном А2 и простагландином I2 проявляются и при их действии на систему свертывания крови: тромбоксан А2 является мощным природным индуктором агрегации тромбоцитов, а простагландин I2, синтезирующийся в стенках кровеносных сосудов, выполняет в организме человека и животных роль ингибитора агрегации тромбоцитов. Соотношение простагландина I2 и тромбоксана А2 имеет важное значение для нормального функционирования сердечно-сосудистой системы.
Простагландины необходимы для процесса овуляции; они влияют на продвижение яйцеклетки и подвижность сперматозоидов, на сократительную деятельность матки, а также необходимы для нормальной родовой деятельности: слабую родовую активность и перенашивание беременности связывают с недостатком П., а повышенное образование П. может стать причиной самопроизвольных абортов и преждевременных родов. У новорожденных П. регулируют закрытие сосудов пуповины и артериального протока.
Простагландины помимо воздействия на специфические рецепторы способны непосредственно влиять на функциональные структуры клетки. В качестве лекарственных средств простагландины используются для вызывания родов, возбуждения и стимуляции родовой деятельности, прерывания беременности. В терапевтических дозах простагландины не оказывают неблагоприятного влияния на мать и плод. Чувствительность матки к введению простагландина различна на разных сроках беременности; на очень ранних и на поздних сроках стимулирующий эффект вызывается легко, а в промежутке между ними на введение препаратов простагландина миометрий реагирует слабо. Противопоказаниями к использованию простагландина с целью вызывания аборта, возбуждения и стимуляции родовой деятельности являются тяжелые соматические заболевания, аллергические реакции на препараты простагландинов, бронхиальная астма, эпилепсия, рубец на матке.
4. Регуляция секреции гормонов
Гормональная регуляция, регуляция жизнедеятельности организма животных и человека, осуществляемая при участии поступающих в кровь гормонов; одна из систем саморегуляции функций, тесно связанная с нервной и гуморальной системами регуляции и координации функций.
Одним из важнейших биологических процессов является регуляция секреции гормонов, обеспечивающая их образование, выделение из клеток и поступление в циркуляцию в количестве, необходимом для поддержания процессов метаболизма и других функций тканей и органов. Составными частями этой регулирующей системы являются гуморальные факторы, к которым надо отнести продукты метаболизма и гормоны, нейро-гормональные и нервные факторы.
Можно привести ряд примеров влияния продуктов метаболизма на различные этапы секреции гормонов. Так, примером гуморальных регуляций является выделение инсулина из бета-клеток островков поджелудочной железы во внеклеточное пространство и циркуляцию, при повышении уровня гликемии, тимуляторами этой секреции являются также аминокислоты, оординированно с процессом выделения инсулина происходит овышение его биосинтеза. Снижение уровня сахара крови способствует понижению секреции инсулина, повышению секреции и поступлению в циркуляцию его гормональных антагонистов — глюкагона, вырабатываемого альфа-клетками островков поджелудочной железы, гормона роста, гидрокортизона, адреналина и медиатора норадреналина. Это строго координированное взаимодействие ряда гормонов в итоге сложных метаболических процессов обеспечивает сохранение физиологического уровня сахара крови и метаболизма глюкозы.
Кроме регуляции секреции гормонов в ответ на повышенный к ним запрос, существенное значение имеет высвобождение гормонов из их связи с белками. Изучены специфические белки, связывающие в плазме крови инсулин, тироксин, гормон роста, прогестерон, гидрокортизон, кортикостероп и другие гормоны. Гормоны и протеины связаны нековалентными связями, обладающими сравнительно низкой энергией, поэтому эти комплексы легко разрушаются, освобождая гормон. Комплексирование с белками дает возможность сохранять часть гормона в неактивной форме. Кроме того, эта связь защищает гормон от действия химических и энзи-матических факторов. К представлению, что связанные с белками гормоны являются одной из транспортных форм в циркуляции и обеспечивают их резервирование, добавились другие факты: важным компонентом биологического значения этих комплексов является возможность быстрого высвобождения из них свободных, т. е. активных, гормонов.
Регуляция секреции гормонов осуществляется несколькими связанными между собой механизмами. Их можно проиллюстрировать на примере кортизола, основного глюкокортикоидного гормона надпочечников. Его продукция регулируется по механизму обратной связи, который действует на уровне гипоталамуса. Когда в крови снижается уровень кортизола, гипоталамус секретирует кортиколиберин – фактор, стимулирующий секрецию гипофизом кортикотропина (АКТГ). Повышение уровня АКТГ, в свою очередь, стимулирует секрецию кортизола в надпочечниках, и в результате содержание кортизола в крови возрастает. Повышенный уровень кортизола подавляет затем по механизму обратной связи выделение кортиколиберина – и содержание кортизола в крови снова снижается. Секреция кортизола регулируется не только механизмом обратной связи. Так, например, стресс вызывает освобождение кортиколиберина, а соответственно и всю серию реакций, повышающих секрецию кортизола. Кроме того, секреция кортизола подчиняется суточному ритму; она очень высока при пробуждении, но постепенно снижается до минимального уровня во время сна. К механизмам контроля относится также скорость метаболизма гормона и утраты им активности. Аналогичные системы регуляции действуют и в отношении других гормонов.
Самое важное значение имеет в регуляции секреции гормонов центральная нервная система. Одной из важнейщих областей ЦНС, координирующей и контролирующей функции эндокринных желез, является гипоталамус, где локализуются нейросекреторные ядра и центры, принимающие участие в регуляции синтеза и секреции гормонов аденогипофиза. Гипоталамо-гипофизарная регуляция осуществляется механизмами, функционирующими по принципу обратной связи, в которых четко выделяются различные уровни взаимодействия (рис. 1).
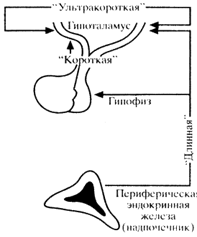
Рис 2. Уровни функционирования обратной связи.
Под “длинной” цепью обратной связи подразумевается взаимодействие периферической эндокринной железы с гипофизарными и гипоталамическими центрами (не исключено, что и с супрагипоталамическими и другими областями ЦНС) посредством влияния на указанные центры изменяющейся концентрации гормонов в циркулирующей крови.
Под “короткой” цепью обратной связи понимают такое взаимодействие, когда повышение гипофизарного тропного гормона (например, АКТГ) модулирует и модифицирует секрецию и высвобождение гипофизотропного гормона (в данном случае кортиколиберина).
“Ультракороткая” цепь обратной связи – вид взаимодействия в пределах гипоталамуса, когда высвобождение одного гипофизотропного гормона влияет на процессы секреции и высвобождения другого гипофизотропного гормона. Этот вид обратной связи имеет место в любой эндокринной железе. Так, высвобождение окситоцина или вазопрессина через аксоны этих нейронов и посредством межклеточных взаимодействий (от клетки к клетке) модифицирует активность нейронов, продуцирующих эти гормоны. Другой пример, высвобождение пролактина и его диффузия в межваскулярные пространства приводит к влиянию на соседние лактотрофы с последующим угнетением секреции пролактина.
“Длинная” и “короткая” цепи обратной связи функционируют как системы “закрытого” типа, т.е. являются саморегулирующими системами. Однако они отвечают на внутренние и внешние сигналы, изменяя на короткое время принцип саморегуляции (например, при стрессе и др.). Наряду с этим на указанные системы влияют механизмы, поддерживающие биологический циркадный ритм, связанный со сменой дня и ночи. Циркадный ритм представляет собой компонент системы, регулирующий гомеостаз организма и позволяющий адаптироваться к изменяющимся условиям внешней среды. Информация о ритме день-ночь передается в ЦНС с сетчатки глаза на супрахиазматические ядра, которые вместе с эпифизом образуют центральный циркадный механизм – ”биологические часы”. Помимо механизма день-ночь, в деятельности этих “часов” принимают участие другие регуляторы (изменение температуры тела, состояние отдыха, сна и др.).
5. Гормональная регуляция углеводного, липидного, белкового и водно- солевого обмена
Основные энергетические ресурсы живого организма — углеводы и жиры обладают высоким запасом потенциальной энергии, легко извлекаемой из них в клетках с помощью ферментных катаболических превращений. Энергия, высвобождаемая в процессе биологического окисления продуктов углеводного и жирового обменов, а также гликолиза, превращается в значительной степени в химическую энергию фосфатных связей синтезируемого АТФ. Аккумулированная же в АТФ химическая энергия макроэргических связей, в свою очередь, расходуется на разного вида клеточную работу — создание и поддержание электрохимических градиентов, сокращение мышц, секреторные и некоторые транспортные процессы, биосинтез белка, жирных кислот и т.д. Помимо «топливной» функции углеводы и жиры наряду с белками выполняют роль важных поставщиков строительных, пластических материалов, входящих в основные структуры клетки, — нуклеиновых кислот, простых белков, гликопротеинов, ряда липидов и т.д. Синтезируемая благодаря распаду углеводов и жиров АТФ не только обеспечивает клетки необходимой для работы энергией, но и является источником образования цАМФ, а также участвует в регуляции активности многих ферментов, состояния структурных белков, обеспечивая их фосфорилирование.
Углеводными и липидными субстратами, непосредственно утилизируемыми клетками, являются моносахариды (прежде всего глюкоза) и неэстерифицированные жирные кислоты (НЭЖК), а также в некоторых тканях кетоновые тела. Их источниками служат пищевые продукты, всасываемые из кишечника, депонированные в органах в форме гликогена углеводов и в форме нейтральных жиров липиды, а также неуглеводные предшественники, в основном аминокислоты и глицерин, образующие углеводы (глюконеогенез). К депонирующим органам у позвоночных относятся печень и жировая (адипозная) ткань, к органам глюконеогенеза — печень и почки. У насекомых депонирующим органом является жировое тело. Кроме этого, источниками глюкозы и НЭЖК могут быть и некоторые запасные или другие продукты, хранящиеся или образующиеся в работающей клетке. Разные пути и стадии углеводного и жирового обменов взаимосвязаны многочисленными взаимовлияниями. Направление и интенсивность течения этих обменных процессов находятся в зависимости от ряда внешних и внутренних факторов. К ним относятся, в частности, количество и качество потребляемой пищи и ритмы ее поступления в организм, уровень мышечной и нервной деятельности и т.д.
Животный организм адаптируется к характеру пищевого режима, к нервной или мышечной нагрузке с помощью сложного комплекса координирующих механизмов. Так, контроль течения различных реакций углеводного и липидного обменов осуществляется на уровне клетки концентрациями соответствующих субстратов и ферментов, а также степенью накопления продуктов той или иной реакции. Эти контролирующие механизмы относятся к механизмам саморегуляции и реализуются как в одноклеточных, так и в многоклеточных организмах. У последних регуляция утилизации углеводов и жиров может происходить на уровне межклеточных взаимодействий. В частности, оба вида обмена реципрокно взаимоконтролируются: НЭЖК в мышцах тормозят распад глюкозы, продукты же распада глюкозы в жировой ткани тормозят образование НЭЖК. У наиболее высокоорганизованных животных появляется особый межклеточный механизм регуляции межуточного обмена, определяемый возникновением в процессе эволюции эндокринной системы, имеющей первостепенное значение в контроле метаболических процессов целого организма.
Среди гормонов, участвующих в регуляции жирового и углеводного обменов у позвоночных, центральное место занимают следующие: гормоны желудочно-кишечного тракта, контролирующие переваривание пищи и всасывание продуктов пищеварения в кровь; инсулин и глюкагон — специфические регуляторы межуточного обмена углеводов и липидов; СТГ и функционально связанные с ним «соматомедины» и СИФ, глюкокортикоиды, АКТГ и адреналин — факторы неспецифической адаптациии. Следует отметить, что многие названные гормоны принимают также непосредственное участие и в регуляции белкового обмена (см. гл. 9). Скорость секреции упомянутых гормонов и реализация их эффектов на ткани взаимосвязаны.
Мы не можем специально останавливаться на функционировании гормональных факторов желудочно-кишечного тракта, секретируемых в нервно-гуморальную фазу сокоотделения. Их главные эффекты хорошо известны из курса общей физиологии человека и животных и, кроме того, о них уже достаточно полно упоминалось в гл. 3. Более подробно остановимся на эндокринной регуляции межуточного метаболизма углеводов и жиров.
Гормоны и регуляция межуточного углеводного обмена. Интегральным показателем баланса обмена углеводов в организме позвоночных является концентрация глюкозы в крови. Этот показатель стабилен и составляет у млекопитающих примерно 100 мг% (5 ммоль/л). Его отклонения в норме обычно не превышают ±30%. Уровень глюкозы в крови зависит, с одной стороны, от притока моносахарида в кровь преимущественно из кишечника, печени и почек и, с другой — от его оттока в работающие и депонирующие ткани (рис. 2).
Приток глюкозы из печени и почек определяется соотношением активностей гликогенфосфорилазной и гликогенсинтетазной реакции в печени, соотношением интенсивности распада глюкозы и интенсивности глюконеогенеза в печени и отчасти в почке. Поступление глюкозы в кровь прямо коррелирует с уровнями фосфорилазной реакции и процессов глюконеогенеза. Отток глюкозы из крови в ткани находится в прямой зависимости от скорости ее транспорта в мышечные, адипозные и лимфоидные клетки, мембраны которых создают барьер для проникновения в них глюкозы (напомним, что мембраны клеток печени, мозга и почек легко проницаемы для моносахарида); метаболической утилизации глюкозы, в свою очередь зависимой от проницаемости к ней мембран и от активности ключевых ферментов ее распада; превращения глюкозы в гликоген в печеночных клетках (Левин и др., 1955; Ньюсхолм, Рэндл, 1964; Фоа, 1972). Все эти процессы, сопряженные с транспортом и метаболизмом глюкозы, непосредственно контролируются комплексом гормональных факторов.
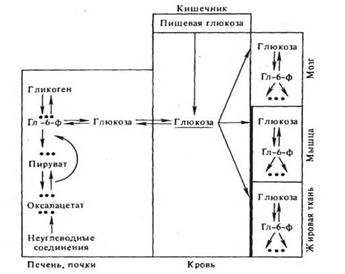
Рис.2. Пути поддержания динамического баланса глюкозы в крови Мембраны мышечных и адипозных клеток имеют "барьер" для транспорта глюкозы; Гл-б-ф — глюкозо-б-фосфат
Гормональные регуляторы углеводного обмена по действию на общее направление обмена и уровень гликемии могут быть условно разделены на два типа. Первый тип гормонов стимулирует утилизацию глюкозы тканями и ее депонирование в форме гликогена, но тормозит глюконеогенез, и, следовательно, вызывает снижение концентрации глюкозы в крови. Гормоном такого типа действия является инсулин. Второй тип гормонов стимулирует распад гликогена и глюконеогенез, а следовательно, вызывает повышение содержания глюкозы в крови. К гормонам этого типа относятся глюкагон (а также секретин и ВИП) и адреналин. Гормоны третьего типа стимулируют глюконеогенез в печени, тормозят утилизацию глюкозы различными клетками и, хотя усиливают образование гликогена гепатоцитами, в результате преобладания первых двух эффектов, как правило, также повышают уровень глюкозы в крови. К гормонам данного типа можно отнести глюкокортикоиды и СТГ — «соматомедины». Вместе с тем, обладая однонаправленным действием на процессы глюконеогенеза, синтеза гликогена и гликолиза, глюкокортикоиды и СТГ — «соматомедины» по-разному влияют на проницаемость мембран клеток мышечной и адипозной ткани к глюкозе.
По направленности действия на концентрацию глюкозы в крови инсулин является гипогликемическим гормоном (гормон «покоя и насыщения»), гормоны же второго и третьего типов — гипергликемическими (гормоны «стресса и голодания») (рис.3).
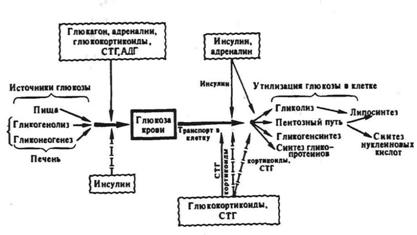
Рис 3. Гормональная регуляция углеводного гомеостаза: сплошными стрелками обозначена стимуляция эффекта, пунктирными — торможение
Инсулин можно назвать гормоном усвоения и депонирования углеводов. Одной из причин усиления утилизации глюкозы в тканях является стимуляция гликолиза. Она осуществляется, возможно, на уровне активации ключевых ферментов гликолиза гексокиназы, особенно одной из четырех известных ее изоформ — гексокиназы П, и глюкокиназы (Вебер, 1966; Ильин, 1966, 1968). По-видимому, определенную роль в стимуляции катаболизма глюкозы инсулином играет и ускорение пентозофосфатного пути на стадии глюкозо-6-фосфатдегидрогеназной реакции (Лейтес, Лаптева, 1967). Считается, что в стимуляции захвата глюкозы печенью при пищевой гипергликемии под влиянием инсулина важнейшую роль играет гормональная индукция специфического печеночного фермента глюкокиназы, избирательно фосфорилирующего глюкозу при высоких ее концентрациях.
Главная причина стимуляции утилизации глюкозы мышечными и жировыми клетками — прежде всего избирательное повышение проницаемости клеточных мембран к моносахариду (Лунсгаард, 1939; Левин, 1950). Таким путем достигается повышение концентрации субстратов для гексокиназной реакции и пентозофосфатного пути.
Усиление гликолиза под влиянием инсулина в скелетных мышцах и миокарде играет существенную роль в накоплении АТФ и обеспечении работоспособности мышечных клеток. В печени усиление гликолиза, по-видимому, важно не столько для повышения включения пирувата в систему тканевого дыхания, сколько для накопления ацетил-КоА и малонил-КоА как предшественников образования многоатомных жирных кислот, а следовательно, и три-глицеридов (Ньюсхолм, Старт, 1973). Образующийся в процессе гликолиза глицерофосфат также включается в синтез нейтрального жира. Кроме того, и в печени, и особенно в адипозной ткани для повышения уровня липогенеза из глюкозы существенную роль играет стимуляция гормоном глюкозо-б-фосфатдегидрогеназной реакции, приводящей к образованию НАДФН — восстанавливающего кофактора, необходимого для биосинтеза жирных кислот и глицерофосфата. При этом у млекопитающих только 3-5% всасываемой глюкозы превращается в печеночной гликоген, а более 30% накапливается в виде жира, откладываемого в депонирующих органах.
Таким образом, основное направление действия инсулина на гликолиз и пентозофосфатный путь в печени и особенно в жировой клетчатке сводится к обеспечению образования триглицеридов. У млекопитающих и птиц в адипоцитах, а у низших позвоночных в гепатоцитах глюкоза — один из главных источников депонируемых триглицеридов. В данных случаях физиологический смысл гормональной стимуляции утилизации углеводов сводится в значительной мере к стимуляции депонирования липидов. Одновременно с этим инсулин непосредственно влияет на синтез гликогена — депонируемой формы углеводов — не только в печени, но и в мышцах, почке, и, возможно, жировой ткани.
Адреналин по влиянию на углеводный обмен близок к глюкагону, поскольку механизмом медиации их эффектов является аденилатциклазный комплекс (Робизон и др., 1971). Адреналин, как и глюкагон, усиливает распад гликогена и процессы глюконеогенеза. В физиологических концентрациях глюкагон преимущественно рецептируется печенью и адипозной тканью, а адреналин — мышцами (прежде всего миокардом) и жировой тканью. Поэтому для глюкагона в большей, а для адреналина в меньшей степени характерны отставленная во время стимуляция глюконеогенетических процессов. Однако же для адреналина в значительно большей степени, чем для глюкагона, типично повышение гликогенолиза и, по-видимому, вследствие этого гликолиза и дыхания в мышцах. В плане не механизмов, а общего влияния на гликолитические процессы в мышечных клетках адреналин является отчасти синерегистом инсулина, а не глюкагона. Видимо, инсулин и глюкагон в большей мере — гормоны питания, а адреналин — стрессорный гормон.
В настоящее время установлен ряд биохимических механизмов, лежащих в основе действия гормонов на липидный обмен.
Известно, что длительный отрицательный эмоциональный стресс, сопровождающийся увеличением выброса катехоламинов в кровяное русло, может вызвать заметное похудание. Уместно напомнить, что жировая ткань обильно иннервируется волокнами симпатической нервной системы, возбуждение этих волокон сопровождается выделением норадреналина непосредственно в жировую ткань. Адреналин и норадреналин увеличивают скорость липолиза в жировой ткани; в результате усиливается мобилизация жирных кислот из жировых депо и повышается содержание неэстерифи-цированных жирных кислот в плазме крови. Как отмечалось, тканевые липазы (триглицеридлипаза) существуют в двух взаимопревращающихся формах, одна из которых фосфорилирована и каталитически активна, а другая – нефосфорилирована и неактивна. Адреналин стимулирует через аденилатциклазу синтез цАМФ. В свою очередь цАМФ активирует соответствующую протеинкиназу, которая способствует фосфорилированию липазы, т.е. образованию ее активной формы. Следует заметить, что действие глюкагона на липолитическую систему сходно с действием кате-холаминов.
Не подлежит сомнению, что секрет передней доли гипофиза, в частности соматотропный гормон, оказывает влияние на липидный обмен. Гипофункция железы приводит к отложению жира в организме, наступает гипофизарное ожирение. Напротив, повышенная продукция СТГ стимулирует липолиз, и содержание жирных кислот в плазме крови увеличивается. Доказано, что стимуляция липолиза СТГ блокируется ингибиторами синтеза мРНК. Кроме того, известно, что действие СТГ на липолиз характеризуется наличием лаг-фазы продолжительностью около 1 ч, тогда как адреналин стимулирует липолиз почти мгновенно. Иными словами, можно считать, что первичное действие этих двух типов гормонов на липолиз проявляется различными путями. Адреналин стимулирует активность аденилатциклазы, а СТГ индуцирует синтез данного фермента. Конкретный механизм, с помощью которого СТГ избирательно увеличивает синтез аденилатциклазы, пока неизвестен.
Инсулин оказывает противоположное адреналину и глюкагону действие на липолиз и мобилизацию жирных кислот. Недавно было показано, что инсулин стимулирует фосфодиэстеразную активность в жировой ткани. Фосфодиэстераза играет важную роль в поддержании постоянного уровня цАМФ в тканях, поэтому увеличение содержания инсулина должно повышать активность фосфодиэстеразы, что в свою очередь приводит к уменьшению концентрации цАМФ в клетке, а следовательно, и к образованию активной формы липазы.
Несомненно, и другие гормоны, в частности тироксин, половые гормоны, также оказывают влияние на липидный обмен. Например, известно, что удаление половых желез (кастрация) вызывает у животных избыточное отложение жира. Однако сведения, которыми мы располагаем, не дают пока основания с уверенностью говорить о конкретном механизме их действия на обмен липидов.
В гормональной регуляции обмена белков участвуют гормоны щитовидной железы тироксин (Т3) усиливает синтез белков; Высокие концентрации Т3 наоборот, подавляют синтез белка; гормон роста, инсулин тестостерон, эстроген усиливают распад белков, особенно в мышечной и лимфоидной тканях, но стимулируют синтез белков в печени.
Регуляция водно-солевого обмена происходит нервно-гормональным путём. При изменении осмотической концентрации крови возбуждаются специальные чувствительные образования (осморецепторы), информация от которых передаётся в центр, нервную систему, а от неё к задней доле Гипофиза. При повышении осмотической концентрации крови увеличивается выделение антидиуретического гормона, который уменьшает выделение воды с мочой; при избытке воды в организме снижается секреция этого гормона и усиливается её выделение почками. Постоянство объёма жидкостей тела обеспечивается особой системой регуляции, рецепторы которой реагируют на изменение кровенаполнения крупных сосудов, полостей сердца и др.; в результате рефлекторно стимулируется секреция гормонов, под влиянием которых почки изменяют выделение воды и солей натрия из организма. Наиболее важны в регуляции обмена воды гормоны вазопрессин и глюкокортикоиды, натрия — альдостерон и ангиотензин, кальция — Паратиреоидный гормон и кальцитонин.
Заключение
В заключительной части моей курсовой работы, я хочу сказать, что гормоны обладают весьма высокой биологической активностью. Они имеет очень сложную химическую структуру, механизмы действия и огромную значимость в обмене веществ. Одно нарушение функции некоторых эндокринных желез может оказывать влияние, как на функцию других желез, так и на нервную систему. В связи с такой значимостью, в медицине существует терапевтическое использование гормонов. Гормоны использовались первоначально в случаях недостаточности какой-либо из желез внутренней секреции для замещения или восполнения возникшего гормонального дефицита. Первым эффективным гормональным препаратом был экстракт щитовидной железы овцы, примененный в 1891 английским врачом Г.Марри для лечения микседемы. На сегодняшний день гормональная терапия способна восполнить недостаточную секрецию практически любой эндокринной железы; прекрасные результаты дает и заместительная терапия, проводимая после удаления той или иной железы. Гормоны могут использоваться также для стимуляции работы желез. Гонадотропины, например, применяют для стимуляции половых желез, в частности для индукции овуляции.
Кроме заместительной терапии, гормоны и гормоноподобные препараты используются и для других целей. Так, избыточную секрецию андрогена надпочечниками при некоторых заболеваниях подавляют кортизоноподобными препаратами. Другой пример – использование эстрогенов и прогестерона в противозачаточных таблетках для подавления овуляции.
Гормоны могут применяться и как агенты, нейтрализующие действие других медикаментозных средств; при этом исходят из того, что, например, глюкокортикоиды стимулируют катаболические процессы, а андрогены – анаболические. Поэтому на фоне длительного курса глюкокортикоидной терапии (скажем, в случае ревматоидного артрита) нередко дополнительно назначают анаболические средства для снижения или нейтрализации ее катаболического действия.
Часто гормоны применяют как специфические лекарственные средства. Так, адреналин, расслабляющий гладкие мышцы, очень эффективен в случаях приступа бронхиальной астмы. Гормоны используются и в диагностических целях. Например, при исследовании функции коры надпочечников прибегают к ее стимуляции, вводя пациенту АКТГ, а ответ оценивают по содержанию кортикостероидов в моче или плазме.
В настоящее время препараты гормонов начали применяться почти во всех областях медицины. Гастроэнтерологи используют кортизоноподобные гормоны при лечении регионарного энтерита или слизистого колита. Дерматологи лечат угри эстрогенами, а некоторые кожные болезни – глюкокортикоидами; аллергологи применяют АКТГ и глюкокортикоиды при лечении астмы, крапивницы и других аллергических заболеваний. Педиатры прибегают к анаболическим веществам, когда необходимо улучшить аппетит или ускорить рост ребенка, а также к большим дозам эстрогенов, чтобы закрыть эпифизы (растущие части костей) и предотвратить таким образом чрезмерный рост.
При трансплантации органов используют глюкокортикоиды, которые уменьшают шансы отторжения трансплантата. Эстрогены могут ограничивать распространение метастазирующего рака молочной железы у больных в период после менопаузы, а андрогены применяются с той же целью до менопаузы. Урологи используют эстрогены, чтобы затормозить распространение рака предстательной железы.
Литература
1. Ажгихина И.С., Простагландины, М., 1978.
2. Алексахина Н.В., Виноградов А.Д., Биохимия животных, М., 1975. –27с.
3. Афиногенова С.А., Булатов А.А., Биохимия гормонов и гормональной регуляции, М.Мир , 1993. – 384с.
4. Кононский А.И., Биохимия животных, М.Молодая гвардия, 1992. -526с.
5. Марри Р., Греннер Д., Мейес П., Биохимия человека, М.Мир,1993. – 384с.
6. Розен В.Б., Основы эндокринологии, М.Высшая школа, 1984. – 336с.
7. Юдаев Н.А., Биохимия гормонов и гормональной регуляции, М.,1976. -300с.
8. Химическая природа гормонов. http//www.medbookaide.ru
9. Механизм действия гормонов.http//www.doktorvisus.ru/medarticle/33555.
10. Биохимия гормонов. http//www.medbiol.ru
Перепечатка материалов без ссылки на наш сайт запрещена