Курсовая работа: Тесты как инструмент измерения уровня знаний по теме: "Кислородсодержащие органические соединения с элементами экологии"
Курсовая работа: Тесты как инструмент измерения уровня знаний по теме: "Кислородсодержащие органические соединения с элементами экологии"
Тесты как инструмент измерения уровня знаний по теме: «Кислородсодержащие органические соединения с элементами экологии»
Содержание
Введение
Глава I. Тестирование как одна из форм контроля знаний
Глава II. Состояние изучаемого вопроса в современной российской школе
2.1 Одноатомные предельные спирты
2.2 Многоатомные предельные спирты
2.3 Фенолы
2.4 Альдегиды
2.5 Одноосновные предельные карбоновые кислоты
2.6 Сложные эфиры
Глава III. Экологические особенности изучения темы: «Кислородсодержащие органические соединения»
Глава IV. Мои уроки
Задачи
ТЕСТЫ
Литература
ВВЕДЕНИЕ
В современную эпоху научно-технической революции необычайную сложность и важность приобрели вопросы взаимодействия природы и человека. Бурный рост населения Земного шара, интенсивное развитие техники во много раз увеличили степень воздействия человека на природу, потребление различных природных ресурсов. Серьезной проблемой стали вопросы возможного и к тому же быстрого истощения запасов полезных ископаемых, пресной воды, ресурсов растительного и животного мира, загрязнения природной среды.
Экологические проблемы имеют глобальный характер и затрагивают все человечество.
К числу самых волнующих, несомненно, относятся проблемы, связанные с загрязнением окружающей среды: воздуха, почвы, воды. Чтобы курс химии приобрел «экологическое звучание», нужно признать, что одной из главных его целей будет формирование у учащихся нового, ответственного отношения к природе.
ГЛАВА 1. ТЕСТИРОВАНИЕ КАК ОДНА ИЗ ФОРМ КОНТРОЛЯ ЗНАНИЙ
Одна из важных задач квалиметрии - быстрая и надежная оценка знаний человека. Теория педагогических тестов рассматривается как часть педагогической квалиметрии. Исследовалось состояние контроля знаний учащихся школ с применением тестовых измерителей и выявлялись основные проблемы при использовании тестов: качество и валидность содержания тестовых заданий, надежность результатов тестирования, недостатки обработки результатов по классической теории тестов, отсутствие использования современной теории обработки тестовых материалов с применением вычислительной техники. Высокая погрешность измерения тестовых результатов не позволяет говорить о высокой надежности результатов измерения.
Тестирование является одной из наиболее технологичных форм проведения автоматизированного контроля с управляемыми параметрами качества. В этом смысле ни одна из известных форм контроля знаний учащихся с тестированием сравниться не может. Но и абсолютизировать возможности тестовой формы нет никаких оснований.
Применение диагностических тестов в зарубежных школах имеет давнюю историю. Признанный авторитет в области педагогического тестирования Э. Торндайк (1874-1949) выделяет три этапа внедрения тестирования в практику американской школы:
1. Период поисков (1900-1915 гг.). На этом этапе происходило осознание и первоначальное внедрение тестов памяти, внимания, восприятия и других, предложенных французским психологом А. Бинэ. Разрабатываются и проверяются тесты интеллекта, позволяющие определять коэффициент умственного развития.
2. Последующие 15 лет - годы "бума" в развитии школьного тестирования, когда было разработано и внедрено множество тестов. Это привело к окончательному осмыслению роли и места тестирования, возможностей и ограничений.
3. С 1931 г. начинается современный этап развития школьного тестирования. Поиски специалистов направляются на повышение объективности тестов, создание непоерывной (сквозной) системы школьной тестовой диагностики, подчиненной единой идее и общим принципам, созданию нооых более совершенных средств предъявления и обработки тестов, накопления и эффективного использования диагностической информации. Напомним в связи с этим, что педология, развившаяся в России в начале века, безоговорочно приняла тестовую основу объективного школьного контроля.
После известного постановления ЦК ВКП(б) "О педологических извращениях в системе Наркомпроса" (1936 г.) были ликвидированы не только интеллектуальные, но и безобидные тесты успеваемости. Попытки возродить их в 70-х годах ни к чему не привели. В этой области наша наука и практика значительно отстали от зарубежной.
В школах развитых стран внедрение и совершенствование тестов шло быстрыми темпами. Широкое распространение получили диагностические тесты школьной успеваемости, использующие форму альтернативного выбора правильного ответа из нескольких правдоподобных, написания очень краткого ответа (заполнения пропусков), дописывания букв, цифр, слов, частей формул и т.п. С помощью этих несложных заданий удается накапливать значительный статистический материал, подвергать его математической обработке, получать объективные выводы в пределах тех задач, которые предъявляются к тестовой проверке. Тесты печатаются в виде сборников, прилагаются к учебникам, распространяются на компьютерных дискетах.
Виды тестового контроля знаний
При подготовке материалов для тестового контроля необходимо придерживаться следующих основных правил:
- Нельзя включать ответы, неправильность которых на момент тестирования не может быть обоснована учащимися. - Неправильные ответы должны конструироваться на основе типичных ошибок и должны быть правдоподобными. - Правильные ответы среди всех предлагаемых ответов должны размещаться в случайном порядке. - Вопросы не должны повторять формулировок учебника. - Ответы на одни вопросы не должны быть подсказками для ответов на другие. - Вопросы не должны содержать "ловушек".
Тесты обученности применяются на всех этапах дидактического процесса. С их помощью эффективно обеспечивается предварительный, текущий, тематический и итоговый контроль знаний, умений, учет успеваемости, академических достижений.
Тесты обученности все больше проникают в массовую практику. Ныне кратковременный опрос всех учащихся на каждом уроке с помощью тестов используют почти все педагоги. Преимущество такой проверки в том, что одновременно занят и продуктивно работает весь класс и за несколько минут можно получить срез обученности всех учащихся. Это вынуждает их готовиться к каждому уроку, работать систематически, чем и решается проблема эффективности и необходимой прочности знаний. При проверке определяются прежде всего пробелы в знаниях, что очень важно для продуктивного самообучения. Индивидуальная и дифференцированная работа с обучаемыми по предупреждению неуспеваемости также основывается на текущем тестировании.
Естественно, не все необходимые характеристики усвоения можно получить средствами тестирования. Такие, например, показатели, как умение конкретизировать свой ответ примерами, знание фактов, умение связно, логически и доказательно выражать свои мысли, некоторые другие характеристики знаний, умений, навыков диагностировать тестированием невозможно. Это значит, что тестирование должно обязательно сочетаться с другими (традиционными) формами и методами проверки. Правильно действуют те педагоги, которые, используя письменные тесты, дают возможность обучаемым устно обосновывать свои ответы. В рамках классической теории тестов уровень знаний испытуемых оценивается с помощью их индивидуальных баллов, преобразованных в те или иные производные показатели. Это позволяет определить относительное положение каждого испытуемого в нормативной выборке.
К наиболее значимым преимуществам IRT относят измерение значений параметров испытуемых и заданий теста в одной и той же шкале, что позволяет соотнести уровень знаний любого испытуемого с мерой трудности каждого задания теста. Критики тестов интуитивно осознавали невозможность точного измерения знаний испытуемых различного уровня подготовки с помощью одного и того же теста. Это одна из причин того, что в практике стремились обычно создавать тесты, рассчитанные на измерение знаний испытуемых самого многочисленного, среднего уровня подготовленности. Естественно, что при такой ориентации теста знания у сильных и слабых испытуемых измерялись с меньшей точностью.
В зарубежных странах в практике контроля нередко используются так называемые тесты успешности, которые включают несколько десятков заданий. Естественно, что это позволяет более полно охватить все основные разделы курса. Предъявляемые задания обычно выполняются в письменном виде. При этом используются два вида заданий:
а) требующие от учащихся самостоятельного составления ответа (задания с конструктивным типом ответа);
б) задания с выборочным типом ответа. В последнем случае учащийся выбирает из числа предъявленных ответ, который он считает правильным.
Важно отметить, что эти типы заданий подвергаются серьезной критике. Отмечается, что задания с конструктивным типом ответа приводят к необъективности оценок. Так, разные экзаменаторы и нередко даже один и тот же экзаменатор ставят разные оценки за один и тот же ответ. Кроме того, чем больше свободы в ответе у учащихся, тем больше и вариантов оценки преподавателей [1].
ГЛАВА 2. СОСТОЯНИЕ ИЗУЧАЕМОГО ВОПРОСА В СОВРЕМЕННОЙ РОССИЙСКОЙ ШКОЛЕ
План изучения темы
Тема «Спирты и фенолы» (6–7 ч)
1. Спирты: строение, номенклатура, изомерия. 2. Физические и химические свойства спиртов. 3. Получение и применение метанола и этанола. 4. Многоатомные спирты. 5. Фенол: строение и свойства. 6. Генетическая связь между углеводородами и спиртами.
Тема «Альдегиды и карбоновые кислоты» (9 ч)
1. Альдегиды: строение и свойства.
2. Получение и применение альдегидов.
3. Предельные одноосновные карбоновые кислоты.
4. Отдельные представители карбоновых кислот (муравьиная, пальмитиновая, стеариновая, олеиновая кислоты).
5. Мыла как соли высших карбоновых кислот. Применение кислот.
6. Практическая работа № 3 «Получение и свойства карбоновых кислот».
7. Практическая работа № 4 «Экспериментальное решение задач на распознавание органических соединений».
Преподавание темы начинается с 10 класса, первого полугодия. При изучении этой темы пользуются учебником химии под редакцией Г.Е. Рудзитис, Ф.Г. Фельдман, также учебником за 10 класс под редакцией Н.С. Ахметова. Дидактическим материалом служит книга по химии для 10классов под редакцией А.М. Радецкого, В.П. Горшкова; используются задания для самостоятельной работы по химии за 10 класс под редакцией Р.П. Суровцева, С.В. Софронова; используется сборник задач по химии для средней школы и для поступающих в вузы под редакцией Г.П. Хомченко, И.Г. Хомченко. [2,3, 4]
2.1 Одноатомные предельные спирты СnН2n+1OH
Строение молекул
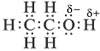
Из электронной формулы спирта видно, что в его молекуле химическая связь между атомом кислорода и атомом водорода весьма полярна. Поэтому водород имеет частичный положительный заряд, а кислород – отрицательный. И как следствие: 1) атом водорода, связанный с атомом кислорода, подвижен и реакционноспособен; 2) возможно образование водородных связей между отдельными молекулами спирта и между молекулами спирта и воды:
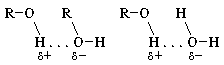
Получение
В промышленности:
а) гидратацией алкенов:
![]()
б) сбраживанием сахаристых веществ:
![]()
в) путем гидролиза крахмалосодержащих продуктов и целлюлозы с последующим сбраживанием образовавшейся глюкозы;
г) из синтез-газа получают метанол:
![]()
В лаборатории:
а) из галогенопроизводных алканов, действуя на них AgOH или КОН:
С4Н9Вr
+ AgОН ![]() С4Н9OН
+ AgBr
С4Н9OН
+ AgBr![]() ;
;
б) гидратацией алкенов:
![]()
Химические свойства
1. Взаимодействие со щелочными металлами:
2C2H5
– OH + 2Na ![]() 2C2H5
– ONa + H2
2C2H5
– ONa + H2![]() .
.
2. Взаимодействие с кислотами:
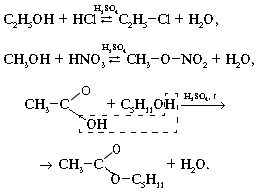
3. Реакции окисления:
а) спирты горят:
2С3Н7ОН
+ 9O2 ![]() 6СО2 + 8Н2О;
6СО2 + 8Н2О;
б) в присутствии окислителей спирты окисляются:
![]()
4. Спирты подвергаются дегидрированию и дегидратации:
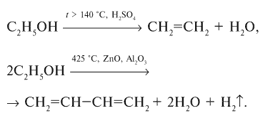
2.2 Многоатомные предельные спирты
Строение молекул
По строению молекул многоатомные спирты сходны с одноатомными. Отличие заключается в том, что в их молекулах имеется несколько гидроксильных групп. Содержащийся в них кислород смещает электронную плотность от атомов водорода. Это и приводит к увеличению подвижности водородных атомов и усилению кислотных свойств.
Получение
В промышленности:
а) гидратацией этиленоксида:
б) глицерин получают синтетическим путем из пропилена и путем гидролиза жиров.
В лаборатории: как и одноатомные спирты, путем гидролиза галогенопроизводных алканов водными растворами щелочей:
Химические свойства
Многоатомные спирты имеют сходное строение с одноатомными спиртами. В связи с этим их свойства тоже сходные.
1. Взаимодействие со щелочными металлами:
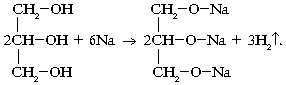
2. Взаимодействие с кислотами:
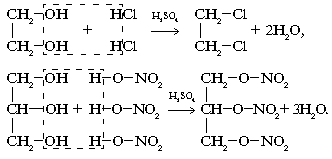
3. В связи с усилением кислотных свойств многоатомные спирты в отличие от однотомных реагируют с основаниями (при избытке щелочи):
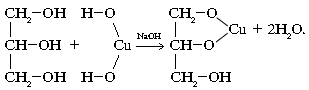
2.3 Фенолы
R–OH или R(OH)n
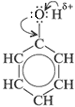
Строение молекул
В отличие от радикалов алканов (СН3–, С2Н5 – и т. д.) бензольное кольцо обладает свойством притягивать к себе электронную плотность кислородного атома гидроксильной группы. Вследствие этого атом кислорода сильнее, чем в молекулах спиртов, притягивает к себе электронную плотность от атома водорода. Поэтому в молекуле фенола химическая связь между атомом кислорода и атомом водорода становится более полярной, а водородный атом более подвижен и реакционноспособен.
Получение
В промышленности:
а) выделяют из продуктов пиролиза каменного угля; б) из бензола и пропилена:
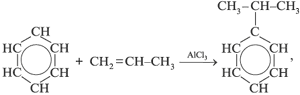
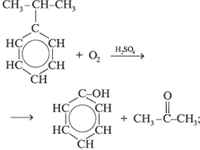
в) из бензола:
С6Н6
![]() С6Н5Сl
С6Н5Сl
![]() С6Н5
– OH.
С6Н5
– OH.
Химические свойства
В молекуле фенола наиболее ярко проявляется взаимное влияние атомов и атомных групп. Это выявляется при сравнении химических свойств фенола и бензола и химических свойств фенола и одноатомных спиртов.
1. Свойства, связанные с наличием группы –OH:
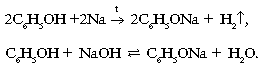
2. Свойства, связанные с наличием бензольного кольца:
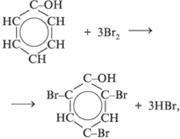
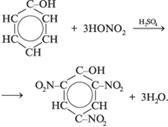
3. Реакции поликонденсации:
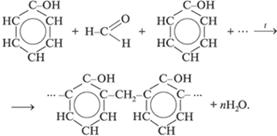
2.4 Альдегиды
Строение молекул
Электронная и структурная формулы альдегидов следующие:
![]()
У альдегидов
в альдегидной группе между атомами углерода и водорода существует ![]() -связь,
а между атомами углерода и кислорода – одна
-связь,
а между атомами углерода и кислорода – одна ![]() -связь и одна
-связь и одна ![]() -связь, которая
легко разрывается.
-связь, которая
легко разрывается.
Получение
В промышленности:
а) окислением алканов:
![]()
б) окислением алкенов:
![]()
в) гидратацией алкинов:
![]()
г) окислением первичных спиртов:
![]()
(этот метод используется и в лаборатории).
Химические свойства
1. Из-за
наличия в альдегидной группе ![]() -связи наиболее характерны реакции присоединения:
-связи наиболее характерны реакции присоединения:
![]()
2. Реакции окисления (протекают легко):
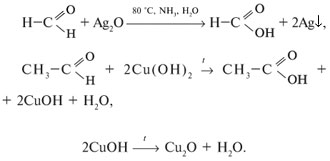
3. Реакции полимеризации и поликонденсации:
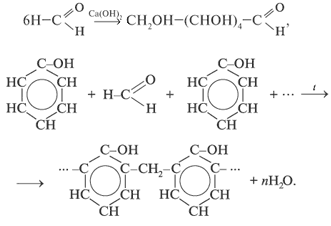
2.5 Одноосновные предельные карбоновые кислоты
Строение молекул
Электронная и структурная формулы одноосновных карбоновых кислот следующие:
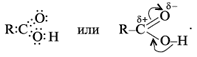
Из-за сдвига электронной плотности к атому кислорода в карбонильной группе атом углерода приобретает частичный положительный заряд. Вследствие этого углерод притягивает электронную плотность от гидроксильной группы, и атом водорода становится более подвижным, чем в молекулах спиртов.
Получение
В промышленности:
а) окислением алканов:
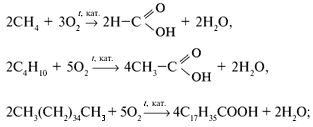
б) окислением спиртов:
![]()
в) окислением альдегидов:
![]()
г) специфическими методами:
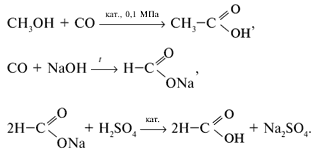
Химические свойства
1. Простейшие карбоновые кислоты в водном растворе диссоциируют:
СН3СООН
![]() Н+
+СН3СОО–.
Н+
+СН3СОО–.
2. Реагируют с металлами:
2HCOOH + Mg ![]() (HCOO)2Mg + H2
(HCOO)2Mg + H2![]() .
.
3. Реагируют с основными оксидами и гидроксидами:
HCOOH + КОН ![]() НСООК+ Н2О.
НСООК+ Н2О.
4. Реагируют с солями более слабых и летучих кислот:
2СН3СООН
+ К2СО3 ![]() 2СН3СООК + СО2
2СН3СООК + СО2![]() + Н2О.
+ Н2О.
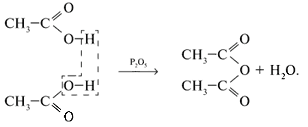
5. Некоторые кислоты образуют ангидриды:
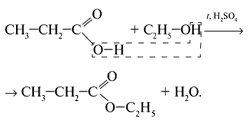
6. Реагируют со спиртами:
2.6 Сложные эфиры
Получение
Сложные эфиры главным образом получают при взаимодействии карбоновых и минеральных кислот со спиртами:
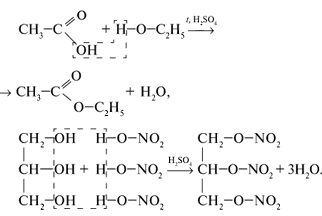
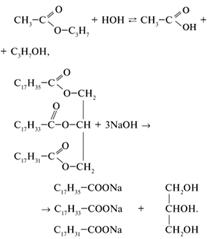
Химические свойства
Характерное свойство сложных эфиров – способность подвергаться гидролизу [3,4]:
ГЛАВА 3. ЭКОЛОГИЧЕСКИЕ ОСОБЕННОСТИ ИЗУЧЕНИЯ ТЕМЫ: «КИСЛОРОДСОДЕРЖАЩИЕ ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ»
Фенолы являются одними из наиболее распространенных загрязняющих веществ, поступающих в водную среду со сточными водами нефтеперерабатывающих, лесохимических, коксохимических, анилинокрасочных и других предприятий.
Фенолы представляют собой оксизамещенные ароматических углеводородов (бензола, его гомологов, нафталина и др.). Обычно их принято разделять на летучие с водяным паром (фенол, креозолы, ксиленолы и др.) и нелетучие фенолы (ди- и триоксисоединения). По числу гидроксильных групп различают одноатомные, двухатомные и многоатомные фенолы. Фенолы в естественных речных условиях образуются при процессах метаболизма водных организмов, при биохимическом окислении и трансформации органических веществ.
Фенолы используются для дезинфекции, изготовления клеев и фенолформальдегидных пластмасс. Они входят в состав выхлопных газов бензиновых и дизельных двигателей, присутствуют в больших количествах в сточных водах нефтеперерабатывающих, лесохимических, анилинокрасочных и ряда других предприятий. Высокими концентрациями этих соединений отличаются сточные воды коксохимических производств, в которых уровни содержания летучих фенолов достигают 250-350 мг/л, многоатомных фенолов — 100-140 мг/л.
В природных водах фенолы обычно находятся в растворенном состоянии в виде фенолятов, фенолятных ионов и свободных фенолов. Они могут вступать в реакции конденсации и полимеризации, образуя сложные гумусоподобные и другие довольно устойчивые соединения. В природных условиях сорбция фенолов взвесью и донными отложениями обычно несущественна. В зонах техногенного загрязнения этот процесс более значим. Типичные содержания фенолов в незагрязненных и слабозагрязненных водах не превышают 20 мкг/л. В загрязненных водах их содержания достигают десятков и сотен микрограммов в 1 л.
Хорошая растворимость фенолов и наличие соответствующих источников обусловливают высокую интенсивность загрязнения ими речных вод в условиях городских агломераций, где их содержания достигают десятков и даже сотен микрограмм в 1 л воды. Например, в водах рек Рейн и Майн в начале 1980-х гг. стабильно наблюдались повышенные концентрации многих представителей фенолов, поступающих со сточными водами. Надежным показателем степени загрязнения воды фонолами является численность фенолразрушающих бактерий. Сапрофитные анаэробы обычно присутствуют в местах интенсивного разрушения фенола, причем в условиях загрязнения количество собственно фенола (карболовой кислоты, оксибензола) и сапрофитных бактерий в донном иле и в придонном слое воды намного больше, чем в толще воды. Фенолы относительно интенсивно подвергаются биохимическому и химическому окислению, зависящему от температуры воды, величины рН, содержания кислорода и ряда других факторов. В речном потоке наблюдается тесная обратная зависимость между температурой воды и переносом фенолов, которая объясняется микробным окислением этих соединений.
Фенолы обладают токсическим действием и ухудшают органолептические показатели воды. Токсическое воздействие фенолов на рыб заметно возрастает с увеличением температуры воды. Известно, что фенолы играют важную роль в процессах аккумуляции тяжелых металлов высшими водными растениями, изменяют режим биогенных элементов и растворенных в речной воде газов. В процессе биохимической деструкции фенола происходит изменение всех элементов гидрохимического режима: снижение концентраций кислорода, увеличение цветности, окисляемости, БПК, щелочности и агрессивности (по отношению, например, к бетону) воды. Образующиеся в процессах деструкции и трансформации фенола продукты по своим свойствам могут быть более токсичными (например, пирокатехин, который, к тому же, способен образовывать со многими металлами хелаты).
Одноатомные фенолы — сильные нервные яды, вызывающие общее отравление организма также и через кожу, на которую действуют прижигающе. Отравление человека фенолом происходит При вдыхании его паров и аэрозоля, образующегося при конденсации паров, попадании вещества в желудочно-кишечный тракт и при всасывании через кожу.
Острые отравления человека наблюдали в основном при попадании фенола на кожу. Действие фенола на кожу зависит в меньшей степени от концентрации раствора и в большей от длительности воздействия.
Гигиеническое регламентирование фенола: — в воздухе рабочей зоны ПДК 0,3 мг/м3, пары, II класс опасности, вещество опасно при поступлении через неповрежденную кожу; — в атмосферном воздухе ПДК максимально разовая 0,01 мг/м3, среднесуточная 0,01 мг/м3, II класс опасности; в почве ПДК не установлена.
Химическое загрязнение окружающей среды является наиболее ощутимым и заметным. В воздухе жилых помещений присутствуют оксиды азота, серы, углерода, летучие органические соединения, взвешенные вещества, микроорганизмы.
Существует несколько типов источников загрязнения атмосферы помещения: источники высокой температуры, строительные материалы и продукты жизнедеятельности человека и живых организмов. Продукты жизнедеятельности человека представлены главным образом оксидом углерода, углеводородами, аммиаком, альдегидами, кетонами, спиртами, фенолами. В малых количествах в результате жизнедеятельности человека выделяются ацетон, ацетальдегид, изопрен, этанол, этилмеркаптан, сероводород, сероуглерод, а также нитротолуол, кумарин, нафталин. Пыль также является источником загрязнения воздуха помещений как механическая взвешенная примесь (до 250 тыс. пылинок в литре воздуха) и как место жительства пылевых клещей, число которых в грамме пыли может достигать 2-3 тысяч. Продуктами жизнедеятельности клещей является ряд химических веществ, отрицательно сказывающихся на дыхательной системе человека и способных вызывать аллергические реакции.
Полимеры, лаки, краски
Значительная часть загрязняющих веществ в воздухе помещений вызвана применением полимерных и лакокрасочных материалов. При повышении температуры в помещении, отделанном с применением полимерных материалов, появляется специфический запах пластмасс, возникающий вследствие выделения изопрена, стирола, бензола и других веществ.
Полистирольные пластики являются источником выделения формальдегида, стирола, этилбензола, изопентана, бутанола. При 20 градусах по Цельсию в продуктах, выделяющихся из суспензионного полистирола, были обнаружены стирол в количестве 26,2 мкг/кг, этилбензол – 12,3 мкг/кг, бутанол – 21,5 мкг/кг. Вспененный полистирол является источником выделения изопентана – 10,7 мг/кг, этилбензола – 0,5 мг/кг, бутена, фенола и др. веществ. При исследовании состава продуктов, выделяющихся из поливинилхлорида при 20 градусах, методом газовой хроматографии в следовых количествах были идентифицированы бензол и этилен. Пластифицированный поливинилхлорид является источником выделения пластификаторов группы фталатов.
Шведские учёные оценили количество фталатов, поступающих в водоёмы Швеции только в результате мойки полов, покрытых линолеумом, в 60 тонн в год. Ковровые покрытия, гардины, мебель, изготовленные с применением синтетических волокон являются источником выделения ацетонитрила, аммиака, хлористого и цианистого водорода. Лакокрасочные материалы загрязняют воздух веществами, содержащимися в растворителях: бензолом, толуолом, уайт-спиритом, ксилолом и др. Древесно-стружечные плиты и некоторые части мебельной фурнитуры могут являться источником выделения в окружающую среду фенола, формальдегида. Большинство альдегидов и кеталей способны вызывать первичное раздражение кожи, глаз и дыхания. Это свойство в большей степени проявляется у низших членов ряда, у тех, которые являются ненасыщенными в алифатической цепи, и у галогензамещенных членов. Альдегиды могут оказывать обезболивающий эффект, но их раздражающее действие может заставить персонал ограничить воздействие еще до его появления. Раздражение слизистых оболочек может быть связано с цилиостатическим эффектом, когда повреждаются похожие на волосы реснички, которые выстилают дыхательные пути и обеспечивают очистку воздуха. Степень токсичности в семействе альдегидов изменяется в широких пределах. Некоторые из ароматических и алифатических альдегидов быстро расщепляются в процессе обмена веществ и не оказывают вредного воздействия; они считаются безопасными для использования в пищевых продуктах в качестве ароматизаторов. Тем не менее, другие члены семейства известны (или подозреваются) как канцерогенные вещества, и при возможном контакте с ними должны соблюдаться соответствующие меры предосторожности. Некоторые альдегиды являются химическими мутагенами, а некоторые - аллергенами. Еще одно токсическое воздействие альдегидов связано с их снотворным действием. Более подробная информация относительно некоторых членов семейства альдегидов приведена ниже, а также содержится в прилагаемых таблицах. Уксусный альдегид является раздражителем слизистой оболочки, а также оказывает общее наркотическое действие на центральную нервную систему. Низкие концентрации вызывают раздражение слизистой оболочки глаз, носа и верхних дыхательных путей, а также катар бронхов. Обширный контакт может привести к повреждению роговидного эпителия. Высокие концентрации вызывают головную боль, ступор, бронхит и отек легких. Глотание вызывает тошноту, рвоту, диарею, наркотическое состояние и остановку дыхания; смерть может наступить из-за повреждения почек, жировой дегенерации печени и сердечной мышцы. Уксусный альдегид поступает в кровь как метаболит этилового спирта, и вызовет покраснение лица, дрожание рук и другие неприятные симптомы. Этот эффект усиливается лекарственным средством тетурам (антабус), а также воздействием промышленных химикалий, таких как цианамид и диметилформамид.
В дополнение к его непосредственному
воздействию уксусный альдегид относится к группе 2B канцерогенных веществ, то
есть по классификации Международного агентства по исследованию рака (IARC)
считается возможно канцерогенным для людей и канцерогенным для животных. В
различных экспериментах уксусный альдегид стимулировал аберрацию хромосом. Повторяющееся
воздействие паров уксусного альдегида вызывает дерматит и конъюнктивит. При
хронической интоксикации симптомы похожи на симптомы хронического алкоголизма:
потеря веса, анемия, бред, зрительные и слуховые галлюцинации, ослабление
интеллекта и нарушения психики. Акролеин является распространенным
загрязнителем атмосферы и содержится в отработанных газах двигателей
внутреннего сгорания, в состав которых входит большое количество различных альдегидов.
Концентрация акролеина увеличивается при использовании дизельного топлива или
мазута. Кроме того, акролеин в больших количествах обнаружен в табачном дыме не
только в виде макрочастиц но и - преимущественно - в газообразной форме. В
сочетании с другими альдегидами (уксусный альдегид, пропиональдегид,
формальдегид, и т.д.) его концентрация достигает ![]() , что, по всей видимости, делает
его одним из наиболее опасных альдегидов в табачном дыме. Таким образом,
акролеин представляет собой возможную опасность для производственных помещений
и окружающей среды. Акролеин токсичен и обладает сильным раздражающим
действием, а высокое давление его насыщенного пара может привести к быстрому
образованию опасных концентраций в атмосфере. Пары акролеина могут вызывать
поражения дыхательных путей, а для глаз опасны как пары, так и сама жидкость.
Контакт с кожей может привести к серьезным ожогам. Акролеин очень легко
обнаруживается, поскольку сильное раздражение имеет место при концентрациях
значительно ниже опасного для здоровья порога (его мощный слезоточивый эффект при
очень низком содержании в атмосфере (
, что, по всей видимости, делает
его одним из наиболее опасных альдегидов в табачном дыме. Таким образом,
акролеин представляет собой возможную опасность для производственных помещений
и окружающей среды. Акролеин токсичен и обладает сильным раздражающим
действием, а высокое давление его насыщенного пара может привести к быстрому
образованию опасных концентраций в атмосфере. Пары акролеина могут вызывать
поражения дыхательных путей, а для глаз опасны как пары, так и сама жидкость.
Контакт с кожей может привести к серьезным ожогам. Акролеин очень легко
обнаруживается, поскольку сильное раздражение имеет место при концентрациях
значительно ниже опасного для здоровья порога (его мощный слезоточивый эффект при
очень низком содержании в атмосфере (![]() ) заставляет людей убегать с
загрязненного места в поисках защитных средств). Следовательно, воздействие
акролеина, по большей части, является результатом утечки из трубопроводов или
емкостей. Нельзя полностью исключить и серьезных хронических последствий, например,
рака. Наибольшую опасность представляет собой вдыхание паров акролеина.
Результатом может быть раздражение носоглотки, ощущение стеснения в груди,
одышка, тошнота и рвота. Бронхолегочные последствия поражения акролеином весьма
серьезны; даже после выздоровления остаются неисчезающие радиологические и
функциональные нарушения. Эксперименты на животных показали, что акролеин
представляет собой отравляющее вещество нарывного действия; он повреждает
слизистую оболочку дыхательных путей до такой степени, что дыхательная функция
за время от 2 до 8 дней полностью блокируется. Неоднократное попадание на кожу
может привести к дерматиту и аллергическим реакциям. Не так давно были открыты
его мутагенные свойства. На примере дрозофилы Rapaport показал это еще 1948. Цель
исследования заключалась в том, чтобы выяснить, не вызывается ли рак легкого,
связь которого со злоупотреблением табаком неоспорима, присутствующим в дыме
акролеином, а также не является ли содержащийся в горелом масле акролеин
причиной некоторых форм рака пищеварительного тракта, которые, как было
установлено, связаны с употреблением в пищу горелого масла. Недавние
исследования показали, что акролеин для некоторых клеток является мутагенным
(морские водоросли типа Dunaliella bioculata), а для других нет (дрожжи типа Saccharomices
cerevisiae). Если акролеин является мутагенным для клетки, то в ее ядре
обнаруживаются ультраструктурные изменения, подобные тем, что возникают при
облучении морских водорослей рентгеновскими лучами. Акролеин также оказывает разнообразное
влияние на синтез ДНК , действуя на некоторые ферменты. Акролеин очень
эффективно блокирует работу ресничек бронхиальных клеток, которые помогают
очищать бронхи. В сочетании с его воспалительным действием это дает высокую
вероятность хронических заболеваний бронхов. Хлорацетальдегид обладает
способностью сильно раздражать не только слизистые оболочки (он опасен для глаз
даже в виде пара и может вызвать необратимые повреждения), но и кожу. Он
вызывает подобные ожогам повреждения при контакте с 40% раствором и заметное
раздражение при длительном или неоднократном воздействии 0,1% раствора. Меры
предосторожности должны заключаться в предотвращении любого контакта с
хлорацетальдегидом и контроле его содержания в атмосфере. Хлоралгидрат главным
образом выделяется людьми сначала в виде трихлорэтанола и затем, по прошествии
определенного времени, как трихлоруксусная кислота, которая при повторном
воздействии может достигать половины дозы. В больших дозах хлоралгидрат
действует подобно наркотику и угнетает дыхательный центр. Кретоновый альдегид
является сильным раздражителем и может вызвать ожог роговицы; по токсичности он
подобен акролеину. Были отмечены случаи аллергических реакций у контактирующих
с ним рабочих, а некоторые тесты на мутагенность дали положительные результаты.
Кроме того, что П-диоксан в значительной степени пожароопасен, он также
относится IARC к канцерогенам группы 2B, то есть установленным канцерогеном для
животных и возможным канцерогеном для человека. Изучение последствий вдыхания
П-диоксана на животных показало, что его пары могут вызывать наркотическое
состояние, поражение легких, печени и почек, раздражение слизистых оболочек,
застой и отек легких, изменение в поведении и повышение количества клеток
крови. Большие дозы П-диоксана, содержащегося в питьевой воде, вели к развитию
опухолей у крыс и морских свинок. Эксперименты с животными также показали, что
П-диоксан быстро впитывается через кожу, вызывая нарушение координации,
наркотическое состояние, эритему, а также поражая почки и печень.
) заставляет людей убегать с
загрязненного места в поисках защитных средств). Следовательно, воздействие
акролеина, по большей части, является результатом утечки из трубопроводов или
емкостей. Нельзя полностью исключить и серьезных хронических последствий, например,
рака. Наибольшую опасность представляет собой вдыхание паров акролеина.
Результатом может быть раздражение носоглотки, ощущение стеснения в груди,
одышка, тошнота и рвота. Бронхолегочные последствия поражения акролеином весьма
серьезны; даже после выздоровления остаются неисчезающие радиологические и
функциональные нарушения. Эксперименты на животных показали, что акролеин
представляет собой отравляющее вещество нарывного действия; он повреждает
слизистую оболочку дыхательных путей до такой степени, что дыхательная функция
за время от 2 до 8 дней полностью блокируется. Неоднократное попадание на кожу
может привести к дерматиту и аллергическим реакциям. Не так давно были открыты
его мутагенные свойства. На примере дрозофилы Rapaport показал это еще 1948. Цель
исследования заключалась в том, чтобы выяснить, не вызывается ли рак легкого,
связь которого со злоупотреблением табаком неоспорима, присутствующим в дыме
акролеином, а также не является ли содержащийся в горелом масле акролеин
причиной некоторых форм рака пищеварительного тракта, которые, как было
установлено, связаны с употреблением в пищу горелого масла. Недавние
исследования показали, что акролеин для некоторых клеток является мутагенным
(морские водоросли типа Dunaliella bioculata), а для других нет (дрожжи типа Saccharomices
cerevisiae). Если акролеин является мутагенным для клетки, то в ее ядре
обнаруживаются ультраструктурные изменения, подобные тем, что возникают при
облучении морских водорослей рентгеновскими лучами. Акролеин также оказывает разнообразное
влияние на синтез ДНК , действуя на некоторые ферменты. Акролеин очень
эффективно блокирует работу ресничек бронхиальных клеток, которые помогают
очищать бронхи. В сочетании с его воспалительным действием это дает высокую
вероятность хронических заболеваний бронхов. Хлорацетальдегид обладает
способностью сильно раздражать не только слизистые оболочки (он опасен для глаз
даже в виде пара и может вызвать необратимые повреждения), но и кожу. Он
вызывает подобные ожогам повреждения при контакте с 40% раствором и заметное
раздражение при длительном или неоднократном воздействии 0,1% раствора. Меры
предосторожности должны заключаться в предотвращении любого контакта с
хлорацетальдегидом и контроле его содержания в атмосфере. Хлоралгидрат главным
образом выделяется людьми сначала в виде трихлорэтанола и затем, по прошествии
определенного времени, как трихлоруксусная кислота, которая при повторном
воздействии может достигать половины дозы. В больших дозах хлоралгидрат
действует подобно наркотику и угнетает дыхательный центр. Кретоновый альдегид
является сильным раздражителем и может вызвать ожог роговицы; по токсичности он
подобен акролеину. Были отмечены случаи аллергических реакций у контактирующих
с ним рабочих, а некоторые тесты на мутагенность дали положительные результаты.
Кроме того, что П-диоксан в значительной степени пожароопасен, он также
относится IARC к канцерогенам группы 2B, то есть установленным канцерогеном для
животных и возможным канцерогеном для человека. Изучение последствий вдыхания
П-диоксана на животных показало, что его пары могут вызывать наркотическое
состояние, поражение легких, печени и почек, раздражение слизистых оболочек,
застой и отек легких, изменение в поведении и повышение количества клеток
крови. Большие дозы П-диоксана, содержащегося в питьевой воде, вели к развитию
опухолей у крыс и морских свинок. Эксперименты с животными также показали, что
П-диоксан быстро впитывается через кожу, вызывая нарушение координации,
наркотическое состояние, эритему, а также поражая почки и печень.
Формальдегид и его полимерная
производная параформальдегид. Формальдегид легко полимеризуется как в жидком, так и в твердом
состоянии, в результате чего образуется смесь химических соединений, известная
как параформальдегид. Этот процесс полимеризации замедляется присутствием воды,
и поэтому применяемый в промышленности формальдегид (известный как формалин или
формол) представляет собой водный раствор, содержащий от 37 до 50 весовых
процентов формальдегида; к этим водным растворам в качестве ингибитора
полимеризации добавляют от 10 до 15 % метилового спирта. Формальдегид токсичен
при глотании и вдыхании паров, а также может вызывать повреждения кожи. При
обмене веществ он превращается в муравьиную кислоту. Токсичность
полимеризованного формальдегида потенциально подобна токсичности мономера,
поскольку при нагревании происходит деполимеризация. Воздействие формальдегида
вызывает острые и хронические реакции. Доказано, что формальдегид является
канцерогеном для животных; по классификации IARC он относится к группе 1B, как
возможный канцероген для человека. Следовательно, при работе с формальдегидом
должны приниматься такие же меры предосторожности, как и для всех канцерогенных
веществ. Низкие концентрации паров формальдегида вызывают раздражение, особенно
глаз и дыхательных путей. Из-за растворимости формальдегида в воде его
раздражающий эффект ограничен верхними дыхательными путями. Концентрации
порядка ![]() вызывают
легкую формикацию глаз и носоглотки; при
вызывают
легкую формикацию глаз и носоглотки; при ![]() ощущение дискомфорта быстро
нарастает; при
ощущение дискомфорта быстро
нарастает; при ![]() наблюдается серьезное затруднение
дыхания, жжение в глазах, носу и трахее, сильное слезотечение и кашель.
Концентрации от 50 до
наблюдается серьезное затруднение
дыхания, жжение в глазах, носу и трахее, сильное слезотечение и кашель.
Концентрации от 50 до ![]() вызывают чувство стеснения в
груди, головную боль, сильное сердцебиение, а в тяжелых случаях приводят к
смерти из-за отека или спазма гортани. Также могут наблюдаться ожоги.
вызывают чувство стеснения в
груди, головную боль, сильное сердцебиение, а в тяжелых случаях приводят к
смерти из-за отека или спазма гортани. Также могут наблюдаться ожоги.
Формальдегид реагирует с хлористым
водородом, и сообщалось, что в результате такой реакции во влажном воздухе
может образовываться незначительное количество вторичного хлорметилового эфира,
который является опасным канцерогенным веществом. Дальнейшие исследования
показали, что при нормальной температуре и влажности окружающей среды даже при
очень высоких концентрациях формальдегида и хлористого водорода не образуется
хлорметиловый эфир в количествах, превышающих порог чувствительности ![]() . Тем не менее,
Национальный институт безопасности и гигиены труда США (NIOSH) рекомендовал
обращаться с формальдегидом как с потенциальным промышленным канцерогеном,
поскольку некоторые тесты показали его мутагенную активность, а у крыс и мышей
он способен вызывать рак носовой полости, особенно в сочетании с парами соляной
кислоты.
. Тем не менее,
Национальный институт безопасности и гигиены труда США (NIOSH) рекомендовал
обращаться с формальдегидом как с потенциальным промышленным канцерогеном,
поскольку некоторые тесты показали его мутагенную активность, а у крыс и мышей
он способен вызывать рак носовой полости, особенно в сочетании с парами соляной
кислоты.
Глютаральдегид - относительно слабый аллерген, который может вызывать аллергический дерматит, а в сочетании с раздражающим действием его аллергенные свойства могут также стать причиной аллергических заболеваний органов дыхания. Это относительно сильный раздражитель кожи и глаз.
Глицидальдегид - высоко реактивный химикат, который относится IARC к группе 2B, как возможный канцероген для человека и установленный канцероген для животных. Таким образом, при работе с этим веществом должны соблюдаться те же меры предосторожности, что и для других канцерогенов.
Метацетальдегид при попадании внутрь может вызвать тошноту, сильную рвоту, боль в животе, напряженность мышц, конвульсии, кому и смерть от остановки дыхания. Глотание параацетальдегида обычно вызывает сон без угнетения дыхания, хотя известны смертельные случаи в результате остановки дыхания и нарушения циркуляции после приема больших доз. Диметоксиметан может вызывать поражение печени и почек, а при остром воздействии раздражающе действует на легкие.
ПРОИЗВОДНЫЕ КАРБОНОВЫХ КИСЛОТ
Из этой группы наиболее широкое распространение получили далапон, трихлорацетат натрия, амибен, банвел-Д, 2,4-дихлорфеноксиуксусная кислота (2,4-Д) и ее натриевая и аминная соли, бутиловый, кротиловый и октиловый эфиры; 2М-4Х, 2,4-М, 2М-4ХМ, 2М-4ХП, камбилен, дактал, пропанид, рамрод, солан и др. Во внешней среде они среднестабильны и оказывают слабое влияние на гидрохимический режим. Бутиловый эфир 2,4-Д придает воде “аптечный” запах при концентрации 1,62 мг/л и привкус — при 2,65 мг/л.
Токсичность. Производные карбоновых кислот обладают сходным механизмом действия. Они влияют на нервную систему рыб, вызывают функционально-морфологические изменения в печени, почках, кроветворной ткани, органах размножения и др. Пропанид и другие анилиды, кроме того, обладают гемолитическим действием. Препараты группы 2,4-Д нарушают воспроизводительную функцию животных [5,6].
ГЛАВА 4. МОИ УРОКИ
Урок: Кислородсодержащие органические соединения
Цели. Обобщить знания учащихся по данной теме, в игровой форме проверить их уровень знаний и навыки.
Оборудование. На демонстрационном столе – химические реактивы, косметические средства, душистые вещества, стиральные моющие средства, яблоко, хлеб, картофель, лекарственные препараты.
Девиз Если путь твой к познанию Мира ведет, –Как бы ни был он долог И труден – вперед! (Фирдоуси)
ХОД УРОКА
Учитель. «Я хочу стать химиком!» – так ответил гимназист Юстус Либих на вопрос директора Дармштадской гимназии о выборе будущей профессии. Это вызвало смех учителей и гимназистов, присутствовавших при разговоре. Дело в том, что во времена Либиха в Германии, да и в большинстве других стран к такой профессии не относились серьезно. Химию рассматривали как прикладную часть естествознания и, хотя были разработаны теоретические представления о веществах, эксперименту чаще всего не придавали должного значения.
В наше время желание стать химиком никого не рассмешит, напротив, химическая отрасль промышленности постоянно нуждается в людях, у которых обширные знания и экспериментальные навыки сочетаются с любовью к химии. Роль химии в различных областях техники и сельского хозяйства все время возрастает. Без многочисленных химических препаратов и материалов нельзя было бы повысить мощность механизмов и транспортных средств, расширить производство предметов потребления и увеличить производительность труда. Химико-фармацевтическая отрасль промышленности выпускает разнообразные медикаменты, укрепляющие здоровье и продлевающие жизнь человека.
Для улучшения благосостояния и более полного удовлетворения потребностей населения необходимы квалифицированные рабочие, инженеры и ученые. А все начинается со школьной лаборатории. Итак, первый тур.
I тур. Лаборатория школьника
Задание (1-я лаборатория). Получить альдегид.
Медную спираль накалить в пламени спиртовки и опустить в пробирку со спиртом. Ощущается резкий запах альдегида, спираль становится блестящей. Уравнение реакции:
![]()
Задание (2-я лаборатория). Получить карбоновую кислоту.
К 2 г ацетата натрия СН3СООNa прилить 1,5 мл H2SO4 (конц.), закрыть пробирку пробкой с газоотводной трубкой и нагревать смесь пламенем спиртовки. Происходит реакция:
![]()
Образующаяся уксусная кислота (tкип = 118 °С) отгоняется, ее собирают в пустую пробирку.
Задание (3-я лаборатория). Получить сложный эфир.
В пробирку налить по 1 мл CH3CООН и С2Н5OН, добавить 0,5 мл H2SO4 (конц.) и нагревать 5 мин пламенем спиртовки, не доводя до кипения. Содержимое пробирки охладить и вылить в другую пробирку с 5 мл воды. Наблюдается образование слоя несмешивающейся с водой жидкости – сложного эфира этилацетата. Уравнение реакции:
![]()
II тур. Благоухающая реторта
Учитель. «И она остановилась около торговца благовониями, и взяла у него десять разных вод: розовую воду, смешанную с мускусом, апельсиновую воду, воду из белых кувшинок, из цветков вербы и фиалок, и еще пять других. И она купила еще головку сахара, склянку для опрыскивания, мешок ладана, серую амбру, мускус и восковые свечи из Александрии и все это положила в корзину и сказала: “Возьми корзину и иди за мной…”»
Это отрывок из истории носильщика и трех женщин из Багдада, одной из прекраснейших сказок «Тысячи и одной ночи». Чудесная цветочная вода, благоухающие душистые вещества, так же как драгоценные камни и изысканные кушанья, в странах Востока когда-то были признаком богатства. Много веков назад арабы уже знали различные способы получения душистых веществ из растений и выделений животных. В парфюмерных лавках восточных базаров многочисленные торговцы предлагали богатейший выбор изысканных душистых веществ.
В средневековой Европе духи не использовали. После античных времен они снова появились только в эпоху Возрождения. Но уже при дворе Людовика XIV дамы обильно душились, чтобы заглушить неприятный запах, исходящий от тела, – мыться было не принято.
Мы всегда радуемся приятным ароматам. Однако вкусы изменились – одурманивающие благовония Востока и резкий, навязчивый аромат духов эпохи Возрождения уступили свое место тонким фантазийным (т. е. созданным фантазией парфюмеров) ароматам. И еще кое-что изменилось. Великолепные духи сегодня доступны всем женщинам. Если раньше приходилось на огромных полях возделывать розы, собирать их цветы и перерабатывать, чтобы получить всего лишь несколько килограммов розового масла, то сегодня химические заводы дают замечательные душистые вещества и к тому же нередко с совершенно новыми оттенками запахов. Природные душистые вещества можно получить из растений, в особых клетках которых они находятся обычно в виде маленьких капелек. Они встречаются не только в цветах, но и в листьях, в кожуре плодов и иногда даже в древесине.
Лаборатории демонстрируют изготовленные дома душистые вещества.
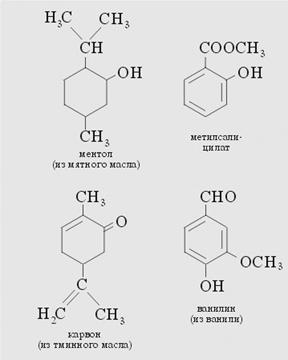
Масло перечной мяты (1-я лаборатория)
Из 50 г высушенной перечной мяты мы можем выделить 5–10 капель мятного масла. Оно содержит, в частности, ментол, который придает ему характерный запах.
Мятное масло используется в большом количестве для изготовления одеколона, туалетной воды и средств для волос, зубных паст и эликсиров.
Духи (2-я лаборатория)
Для получения приятного запаха понадобится, прежде всего, цитрусовое масло, которое мы получим из кожуры апельсинов или лимонов. С этой целью кожуру натрем на терке, завернем в кусочек прочной материи и тщательно выдавим. Смешаем 2 мл мутной жидкости, просочившейся через ткань, с 1 мл дистиллята, полученного из мыла.
|
|
Душистые вещества |
Теперь нам понадобится цветочный запах. Мы создадим его, добавляя к смеси 2–3 капли ландышевого масла. Капельки метилсалицилата, тминного масла, а также небольшая добавка ванильного сахара улучшают аромат. В заключение растворим эту смесь в 20 мл чистого спирта или в крайнем случае в равном объеме водки, и наши духи готовы.
Медовый крем для рук (3-я лаборатория)
Мы получим его нагреванием 3,5 части порошкообразного желатина с 65 частями розовой воды (лепестки роз выдерживают в воде несколько дней) и 10 частями меда. К нагретой смеси при перемешивании добавляют другую смесь, содержащую 1 часть духов, 1,5 части спирта и 19 частей глицерина. В холодном месте масса загустевает, и образуется готовый к употреблению желеобразный крем.
III тур - Продукты питания как химические соединения
Учитель. «Человек есть то, что он ест» – в этом высказывании Людвига Фейербаха вся суть наивного материализма. В наше время мы, конечно, не можем согласиться с таким мнением, которое не учитывает того, что человек представляет собой особую, качественно новую, высшую ступень развития живых организмов на Земле.
Но как бы там ни было, можно сказать, что человеческий организм поистине подобен химическому комбинату с чрезвычайно сложной технологией производства. В организме человека без применения сильных кислот, а также высоких давлений и температур с превосходным выходом осуществляются сложнейшие химические превращения.
Человеческий организм не только не может расти и развиваться, но и просто существовать без притока органических веществ. В отличие от растений он не может сам создавать органические соединения из неорганического сырья. Кроме того, организму требуется энергия – как для обеспечения соответствующей температуры тела, так и для совершения работы. Эти самые органические вещества поступают к нам в организм с пищей, при их распаде выделяется энергия.
Задание (1-я лаборатория). Доказать, что в спелом яблоке содержится глюкоза. (Провести реакцию серебряного зеркала с яблочным соком.) Задание (2-я лаборатория). Обнаружить крахмал в продуктах питания. (Провести йодкрахмальную реакцию, например на срезе картофелины.) Задание (3-я лаборатория). Определить уксусную кислоту. (Использовать индикатор – синий лакмус и порошок соды.)
Учитель. Благодаря йодкрахмальной реакции не раз удавалось вывести на чистую воду жуликов, которые торговали бутербродами, выдавая за масло маргарин. Выпускаемый промышленностью маргарин по техническим условиям должен содержать добавку кунжутного масла. Последнее дает красное окрашивание с фурфуролом и соляной кислотой. С 1915 г. было разрешено заменять кунжутное масло картофельным крахмалом. Маргарин содержит 0,2% крахмала.
IV тур. Стиральные моющие средства
Учитель. Моющие средства стали всем доступны только благодаря химии. В Древнем Риме в качестве самого распространенного моющего средства ценилась протухшая моча. В те времена ее специально собирали, она была предметом торговли и обмена.
Туалетное мыло в течение нескольких столетий было предметом роскоши. Эффективные моющие средства, туалетные мыла, жидкости для удаления пятен и многое другое, без чего мы не можем обойтись, были созданы химиками в исследовательских лабораториях. Эти средства необычайно облегчают наш домашний труд.
Задание (1-я лаборатория). Испытать растворы стиральных моющих средств фенолфталеином. Каким из моющих средств вы бы постирали изделия из шерсти или натурального шелка?
Задание (2-я лаборатория). Попробуйте растворить растительное масло в различных растворителях – воде, этаноле, бензине. Чем вы будете выводить жирное пятно?
Задание (3-я лаборатория). Опыты с жесткой водой – приливать к ней понемногу растворы различных моющих средств.
В каком случае приходится добавлять больше раствора до образования устойчивой пены? Какой препарат не утрачивает моющего действия в жесткой воде? В чем преимущество и каковы недостатки синтетических моющих средств?
|
|
Природные и синтетические моющие средства
Учитель. Итак, мы видим, что химия все быстрее шагает вперед, способствуя тому, чтобы наша жизнь становилась прекраснее и легче. Она вносит свой вклад в борьбу за то, чтобы наша земля смогла прокормить все человечество. Но ведь творцами химии завтрашнего дня станете вы, сегодняшние школьники. Вам предстоит – не без тяжелого труда – овладеть знаниями, чтобы потом, используя их, приносить пользу людям.
Подводятся итоги.
Открытый урок по химии: "Области применения спиртов, альдегидов и карбоновых кислот".
Цели урока:
· Обобщение знаний по применению спиртов, альдегидов и карбоновых кислот.
· Охрана окружающей среды и безопасности жизни в производстве и применении спиртов, альдегидов и карбоновых кислот.
· Расширение кругозора учащихся о предприятиях родного края (учащиеся готовят выступления заранее).
Девиз: Служение Отечеству – благородная роль химии.
Ход урока
Учитель: Сегодня на уроке мы поговорим не только о применении на практике некоторых органических веществ, но и о безопасности жизни людей. Большинство отраслей химической промышленности выпускают полезную продукцию (в этом мы не сомневаемся), но как сделать так, чтобы отходы от производств не загрязняли окружающую среду, неблагоприятно не влияли на здоровье людей.
Ученик: Метанол используют для получения большого количества разных органических веществ, в частности формальдегида
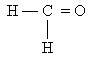
и метилметакрилата
 ,
,
которые используют в производстве фенолформальдегидных смол и органического стекла. Метанол используют как растворитель, экстрагент, а в ряде стран – в качестве моторного топлива, так как добавка его к бензину повышает октановое число топлива и снижает количество вредных веществ в выхлопных газах. В этом проявляется забота о людях. (Подготавливается подробный реферат о применении спиртов.)
Учитель: А сейчас, проведем “химическую эстафету”. (5 минут)
Учащиеся выполняют задание.
Составьте уравнения реакций, при помощи которых можно осуществить следующие превращения: этан – этилен – этиловый спирт – этаналь – уксусная кислота.
(Для проверки, на обратной стороне доски один ученик выполняет это же задание.)
С2Н6 —> С2Н4 —> С2Н5ОН —> СН3СНО —> СН3СООН
1. Ni С2Н6 —> С2Н4 + Н2 н+, кат.
2. С2Н4 + Н2О —> С2Н5ОН
3. С2Н5ОН + СuО —> СН3СНО + Сu + Н2О
4. СН3СНО + 2Сu(ОН)2 —> СН3СООН + Сu2О + 2Н2О
Учитель: Химия обладает огромными возможностями. Возьмем, к примеру, лекарства – вещества, так необходимые для здоровья человека. Даже они могут быть исключительно опасными, если использовать их неразумно, неграмотно, например, при самолечении.
Ученик: Химия очень тесно связана с медициной. Связь возникла давно. Еще в XVI веке широкое развитие получило медицинское направление, основоположником, которого стал немецкий врач Парацельс.
Аспирин, или ацетилсалициловая кислота
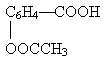 –
–
один из препаратов, который широко применяют как жаропонижающее, болеутоляющее и противоревматическое средство. Аспирин – это кислота, и его избыток может способствовать раздражению слизистой оболочки желудка и появлению язвы. Но забота о здоровье людей помогла найти выход из этого положения. Выяснилось, что вещества, содержащиеся в ягодах вишни, действуют лучше аспирина.
ОАО “Красногорсклексредства” выпускает не только фасованные лекарственные травы, но также жидкие лекарственные средства и травяные чаи. А добавление в чай сока лимона поможет снять сердечную боль.
Как утверждают ботаники, родиной лимона является Индия, где он растет в диком состоянии в горных местностях, у подножья Гималаев, откуда потом попал в страны Юго-Восточной Азии и значительно позднее – в Европу. В России по-настоящему с лимоном познакомились лишь во второй половине XVII в., когда его деревца впервые завезли из Голландии в Москву и посадили в кремлёвских “оранжерейных палатах”. В начале XVII в. в помещичьих усадьбах быстро распространилась “мода” на выращивание лимона с целью получения плодов.
Кстати, у нас в стране эта традиция поддерживается и сейчас. Так, например, в г. Павлове Нижегородской области многие имеют дома по 4–5 небольших деревцев лимона. Отсюда и произошел известный комнатный сорт – Павловский. Однако комнатное деревце этого лимона дает при заботливом, правильном уходе 10–16 плодов в год. Чем же определяется польза лимона? Прежде всего, конечно, аскорбиновой кислотой, или витамином С, лечебное значение которого известно многим. Этот витамин является средством против цинги. Еще во времена великих морских путешествий европейцы широко использовали для этой цели лимон. Известно, что прославленный мореплаватель Дж. Кук брал с собой на корабли запас этих плодов, а в 1795 году в Англии был издан указ, по которому экипажам кораблей предписывалось ежедневно выдавать порции лимонного сока.
Сегодня известно, что витамин С повышает сопротивляемость организма к инфекционным заболеваниям, особенно так называемого простудного характера. Вот почему лимоны могут рекомендовать (наряду с другими фруктами и овощами) как средство для неспецифической профилактики гриппа и гриппоподобных заболеваний. Тем более что насыщенность этим витамином повышает сопротивляемость к воздействию холода. Помимо этого, данный витамин обладает способностью ускорять заживление ран, ожогов и переломов костей, содействует более быстрому выздоровлению при ревматизме, туберкулезе, аллергических поражениях. По некоторым данным, больные различными инфекциями испытывают облегчение при лечении аскорбиновой кислотой.
Любопытно, что витамина С гораздо больше содержится в кожуре лимона нежели в его мякоти. Поэтому нужно съедать весь плод без остатка. Для того, чтобы удовлетворить суточную потребность взрослого человека в этом витамине, нужно ежедневно употреблять около 100 грамм лимона, т.е. два мелких или один крупный плод лимона. Однако не все любят кислое.
А лимон действительно кислый.
(Подготавливается подробный реферат.)
Учитель: А сейчас послушаем сообщение о косметических средствах.
Ученик: Раскопки древних поселений свидетельствуют о том, что у людей всегда была тяга к раскрашиванию своего тела.
В далеком прошлом в качестве косметических средств использовали лишь природные вещества. С развитием химии, помимо природных веществ, стали использовать и синтетические.
Для душистых веществ используются самые современные методы органического синтеза. В настоящее время разработаны методы синтеза почти всех душистых веществ, добывавшихся ранее из природного сырья, и создан ряд новых, не найденных в природе. Из химического, а не из природного сырья получают теперь ментол с запахом перечной мяты; цитраль, пахнущий лимоном; ванилин; ирон с нежным ароматом фиалки и многие другие.
Но ООО “Лорен косметик”, находящееся в г. Дедовске Московской области, выпускает продукцию из натурального сырья. Это возможные красящие шампуни, дезодоранты, которые не содержат фреоны и многое другое. (Подготавливается подробный реферат.)
Учитель: Давайте с вами послушаем сообщение о применение муравьиной и молочной кислотах.
Ученик: Муравьиная кислота.
Муравьи рода Formika используют различные кислоты как средство общения друг с другом, точно также, как многие общественные насекомые. Муравьиная кислота, выделяемая муравьями в момент опасности, служит сигналом для всех остальных особей этого вида и является средством защиты при нападении хищников. Благодаря этой кислоте муравьи имеют не так уж много врагов.
Муравьиная кислота полезна для крупных млекопитающих, так, медведи после зимней спячки избавляются от паразитов, ложась на муравейник. Муравьи, кусая его, впрыскивают муравьиную кислоту.
Молочная кислота
Молочная кислота (С3Н6О3) является промежуточным продуктом обмена веществ у теплокровных животных. Запах этой кислоты улавливается кровососущими насекомыми, в частности комарами, на значительном расстоянии. Это позволяет насекомым находить свою жертву.
Учитель: Последний вопрос, который мы разберем сегодня на уроке – это химия и пища.
Ученик: Человек – существо странное. Сначала он, вопреки здравому смыслу разрушает собственное здоровье, а затем стремится его поправить. Причина – элементарная безграмотность. Нашу страну захлестнула волна импортных продуктов питания. Поставщики Нидерланды, Дания, Германия, США, Франция, Израиль. Однако в каждой развитой стране существует три категории продуктов питания: для внутреннего рынка, для развитых стран, для развивающихся стран, в том числе, к сожалению, и для России. Как же обезопасить себя?
Необходимо знакомиться с надписями на упаковках кондитерских изделий, напитков, маргарина и т. д. Обратим внимание на букву Е.
· Е 100 – Е 182 – красители (кармин – красный; куркума – желтый; сахарный колер (карамель) – темно-коричневый).
· Е 200 – Е 299 – консерванты – это вещества, добавление которых позволяет замедлить или предотвратить развитие микрофлоры.
· Е 300 – Е 399 – вещества, которые замедляют процессы брожения.
· Е 400 – Е 409 –стабилизаторы, обеспечивают продуктам длительное хранение.
· Е 500 – Е 599 – эмульгаторы, эти вещества позволяют сохранить равномерность распределения дисперсной фазы в среде, например, растительные масла, пиво.
· Е 600 – Е 699 – ароматизаторы, т.е. соединения, усиливающие или придающие вкус пищевым продуктам.
· Е 900 – Е 999 – антифламинги, которые не позволяют слеживаться муке, соли, соде и т.д.
Госсанэпидемнадзор и общество защиты прав потребителей, не рекомендует употреблять продукты питания, содержащие добавки с маркировками:
· Е 131, Е 141, Е 215 –Е 218, Е 230 – Е 232, Е 239 – являются аллергенами;
· Е 121, Е 123 – способны вызвать желудочно-кишечные расстройства, а в больших дозах и пищевые отравления;
· Е 211, Е 240, Е 442 – содержат канцерогены, т.е. могут провоцировать образование опухолей.
Применение пищевых добавок допустимо только в том случае, если они, даже при длительном использовании, не угрожают здоровью человека.
Учитель: В подмосковном городе Красногорске есть кондитерская фабрика “КОНФАЭЛЬ”. На этой фабрике выпускают кондитерские изделия с натуральными наполнителями. Давайте послушаем сообщение об этой замечательной фабрике. (Ученик делает сообщение.)
Если останется время, то можно задать интеллектуальные вопросы. (5 минут)
· Это вещество, вернее его раствор, используется для консервирования биологических препаратов, а благодаря его парам, содержащимся в древесном дыме, коптят рыбу и колбасы.
Ответ: формальдегид.
· Современные рекомендации по правильному питанию не отличаются от высказанных более 4 тыс. лет назад в Библии и более 2,5 тыс. лет назад Гиппократом. Один из таких советов гласит: “Не следует жарить пищу, готовьте пищу на пару, варите, запекайте её”. Почему?
Ответ: При жарении образуются конденсированные ароматические вещества, например бензопирен (3,4 – бензирен).
· Содержание воды в организме ребенка 70%, у взрослого человека – 50–60%, у стариков – 40%. Если беременная женщина примет алкоголь, то где он будет накапливаться?
Ответ: Алкоголь хорошо растворяется в воде и будет накапливаться там, где её больше всего – в плоде, в головном мозге.
· Вещества каких классов органических соединений чаще всего используются в парфюмерной промышленности?
Ответ: эфиры, спирты, альдегиды, арены.
· Какие кислоты можно использовать в быту для выведения пятен от фруктов и ржавчины?
Ответ: лимонную, яблочную, уксусную, щавелевую.
или решить задачу.
В аптеке для растворения антибиотиков используют 10% раствор поваренной соли. Сколько дистиллированной воды потребуется для приготовления 100 г 10% раствора NаCl?
Решение:
1. 10% или 0,1
m (NaCI) = 100 . 0,1 = 10 (г)
2. m (H2O) = 100 – 10 = 90 (г)
Ответ: 90 г воды.
Учитель: Химия – удивительная наука, она вводит человека в мир различных веществ, который окружает нас. Учите химию, и вы добьетесь.
ЗАДАЧИ
Задача 1. При сгорании органического вещества массой 4,8 г образовалось 3,36 л CO2 (н.у.) и 5,4 г воды. Плотность паров органического вещества по водороду равна 16. Определите молекулярную формулу исследуемого вещества.
Решение. Продукты сгорания вещества состоят из трех элементов: углерода, водорода, кислорода. При этом очевидно, что в состав этого соединения входил весь углерод, содержащийся в CO2, и весь водород, перешедший в воду. А вот кислород мог присоединиться во время горения из воздуха, а мог и частично содержаться в самом веществе. Для определения простейшей формулы соединения нам необходимо знать его элементный состав. Найдем количество продуктов реакции (в моль):
n(CO2) = V(CO2) / VM = 3,36 л : 22,4 л/моль = 0,15 моль n(H2O) = m(H2O) / M(H2O) = 5,4 г : 18 г/моль = 0,3 моль Следовательно, в состав исходного соединения входило 0,15 моль атомов углерода и 0,6 моль атомов водорода: n(H) = 2n(H2O), так как в одной молекуле воды содержатся два атома водорода. Вычислим их массы по формуле: m = n х M
m(H) = 0,6 моль х 1 г/моль = 0,6 г
m(С) = 0,15 моль х 12 г/моль = 1,8 г
Определим, входил ли кислород в состав исходного вещества:
m(O) = 4,8 - (0,6 + 1,8) = 2,4 г
Найдем число моль атомов кислорода:
n(O) = m(O) / M(O) = 2,4 г : 16 г/моль = 0,15 моль
Соотношение числа атомов в молекуле исходного органического соединения пропорционально их мольным долям:
n(CO2) : n(H) : n(O) = 0,15 : 0,6 : 0,15 = 1 : 4 : 1
самую маленькую из этих величин (0,15) принимаем за 1, а остальные делим на нее.
Итак, простейшая формула исходного вещества CH4O. Однако по условию задачи требуется определить молекулярную формулу, которая в общем виде такова: (CH4O)х. Найдем значение x. Для этого сравним молярные массы исходного вещества и его простейшей формулы:
x = M(CH4O)х / M(CH4O)
Зная относительную плотность исходного вещества по водороду, найдем молярную массу вещества:
M(CH4O)х = M(H2) х D(H2) = 2 г/моль х 16 = 32 г/моль
x = 32 г/моль / 32 г/моль = 1
Есть и второй вариант нахождения x (алгебраический):
12x + 4x + 16x = 32; 32 x = 32; x = 1
Ответ. Формула исходного органического вещества CH4O.
Задача 2. Какой объем водорода (н.у.) получится при взаимодействии 2 моль металлического натрия с 96%-ным (по массе) раствором этанола в воде (V = 100 мл, плотность d = 0,8 г/мл).
Решение. В условии задачи даны количества обоих реагентов - это верный признак того, что какой-нибудь из них находится в избытке. Найдем массу этанола, введенного в реакцию:
m(раствора) = V х d = 100 мл х 0,8 г/мл = 80 г m(C2H5OH) = {m(раствора) х w%} : 100% = 80 г х 0,96 = 76,8 г
(1) 2C2H5OH + 2Na = 2C2H5ONa + H2
на 2 моль этанола -- 2 моль натрия -- 1 моль водорода
Найдем заданное количество этанола в моль:
n(C2H5OH) = m(C2H5OH) / M(C2H5OH) = 76,84 г : 46 г/моль = 1,67 моль
Поскольку заданное количество натрия составляло 2 моль, натрий в нашей задаче присутствует в избытке. Поэтому объем выделенного водорода будет определяться количеством этанола:
n1(H2) = 1/2 n(C2H5OH) = 1/2 х 1,67 моль = 0,835 моль V1(H2) = n1(H2) х VM = 0,835 моль х 22,4 л/моль = 18,7 л
Но это еще не окончательный ответ. Будьте внимательны! Вода, содержащаяся в растворе спирта, тоже реагирует с натрием с выделением водорода.
Найдем массу воды:
m(H2O) = {m(раствора) х w%} : 100% = 80 г х 0,04 = 3,2 г n(H2O) = m(H2O)/M(H2O) = 3,2 г : 18 г/моль = = 0,178 моль
(2) 2H2O + 2Na = 2NaOH + H2
на 2 моль воды -- 2 моль натрия -- 1 моль водорода
Количество натрия, оставшееся неизрасходованным после реакции с этанолом, составит: n(Na, остаток) = 2 моль - 1,67 моль = 0,33 моль Таким образом, и по сравнению с заданным количеством воды (0,178 моль) натрий все равно оказывается в избытке.
Найдем количество и объем водорода, выделившегося по реакции (2): n2(H2) = 1/2 n(H2O) = 1/2 х 0,178 моль = 0,089 моль V2(H2) = n2(H2) х VM = 0,089 моль х 22,4 л/моль = 1,99 л Общий объем водорода:
V(H2) = V1(H2) + V2(H2) = 18,7 л+ 1,99 л = 20,69 л
Ответ: V(H2) = 20,69 л
Задача 3. Вычислите массу уксусной кислоты, которую можно получить из 44,8 л (н.у.) ацетилена, если потери на каждой стадии получения составляют в среднем 20%.
Решение
C2H2 + H2O =>(Hg2+,H2SO4)=> CH3CHO =>([O])=> CH3COOH
1моль ==> 1 моль ==> 1 моль
n(CH3COOH)теор = n(C2H2) = V(C2H2) / VM = 44,8 л : 22,4 л/моль = 2 моль n(CH3COOH)практ = n(CH3COOH)теор х h1 х h2 = 2 моль х 0,8 х 0,8 = 1,28 моль Масса уксусной кислоты с учетом всех потерь составит: m(CH3COOH) = n(CH3COOH)практ х M(CH3COOH) = 1,28 моль х 60 г/моль = 76,8 г
Ответ. m(CH3COOH) = 76,8 г
Задача 4. При окислении смеси бензола и толуола подкисленным раствором перманганата калия при нагревании получено 8,54 г одноосновной органической кислоты. При взаимодействии этой кислоты с избытком водного раствора гидрокарбоната натрия выделился газ, объем которого в 19 раз меньше объема такого же газа, полученного при полном сгорании исходной смеси углеводородов. Определите массы веществ в исходной смеси.
Решение
Перманганатом калия окисляется только толуол, при этом образуется бензойная кислота:
5С6Н5-СН3 + 6KMnO4 + 9H2SO4 → 5С6Н5-СООН + 3K2SO4 + 6MnSO4 + 14Н2О
v(C6H5-COOH) = 8,54/122 = 0,07 моль = v(C6H5-CH3).
При взаимодействии бензойной кислоты с гидрокарбонатом натрия выделяется СО2:
С6Н5-СООН + NaHCO3 → C6H5-COONa + СО2↑ + Н2О.
v(CO2) = v(C6H5-COOH) = 0,07 моль.
При сгорании смеси углеводородов образуется 0,07*19 = 1,33 моль СО2. Из этого количества при сгорании толуола по уравнению
С6Н5-СН3 + 9О2 → 7СО2 + 4Н2О
образуется 0,07*7 = 0,49 моль СО2. Остальные 1,33-0,49 = 0,84 моль СО2 образуются при сгорании бензола:
С6Н6 + 7,5О2 → 6СО2 + ЗН2О.
v(C6H6) = 0,84/6 = 0,14 моль.
Массы веществ в смеси равны:
m(С6Н6) = 0,14-78 = 10,92 г, m(С6Н5-СН3) = 0,07*92 = 6,48 г.
Ответ. 10,92 г бензола, 6,48 г толуола.
Задача 5. Эквимолярная смесь ацетилена и формальдегида полностью прореагировала с 69,6 г оксида серебра (аммиачный раствор). Определите состав смеси (в % по массе).
Решение
Оксид серебра реагирует с обоими веществами в смеси:
НС ≡ СН + Аg2О → AgC ≡ CAg↓ + Н2О,
СН2О + 2Аg2О → 4Аg↓ + СО2 + Н2О.
(Уравнения реакции записаны в упрощенном виде).
Пусть в смеси содержалось по х моль С2Н2 и СН2О. Эта смесь прореагировала с 69,6 г оксида серебра, что составляет 69,6/232 = 0,3 моль. В первую реакцию вступило х моль Аg2О, во вторую — 2х моль Аg2О, всего — 0,3 моль, откуда следует, что х = 0,1.
m(C2H2) = 0,1 - 26 = 2,6 г; m(CH2O) = 0,1-30 = 3,0 г;
общая масса смеси равна 2,6+3,0 = 5,6 г. Массовые доли компонентов в смеси равны:
(С2Н2) = 2,6/5,6 = 0,464, или 46,4%; (СН2О) = 3,0/5,6 = 0,536, или 53,6%.
Ответ. 46,4% ацетилена, 53,4% формальдегида.
Задача 6. Через 10 г смеси бензола, фенола и анилина про пустили ток сухого хлороводорода, при этом выпало 2,59 г осадка. Его отфильтровали, а фильтрат обработали водным раствором гидроксида натрия. Верхний органический слой отделили, его масса уменьшилась на 4,7 г. Определите массы веществ в исходной смеси.
Решение
При пропускании через смесь сухого хлороводорода выпадает осадок хлорида фениламмония, который нерастворим в органических растворителях:
C6H5NH2 + HCl → C6H5NH3Cl ↓.
v ( C 6 H 5 NH 3 Cl ) = 2,59/129,5 = 0,02 моль, следовательно v ( C 6 H 5 NH 2 ) = 0,02 моль, m ( C 6 H 5 NH 2 ) = 0,02.93 = 1,86 г.
Уменьшение массы органического слоя на 4,7 г произошло за счет реакции фенола с гидроксидом натрия:
С6Н5ОН + NaOH → C6H5ONa + Н2О.
Фенол перешел в водный раствор в виде фенолята натрия. m (С6Н5ОН) = 4,7 г. Масса бензола в смеси составляет 10 - 4,7 -1,86 = 3,44 г.
Ответ. 1,86 г анилина, 4,7 г фенола, 3,44 г бензола.
Задача 7. Этиленовый углеводород присоединяет 6,72 л (н.у.) хлороводорода. При гидролизе продукта реакции водным раствором гидроксида натрия при нагревании образуется 22,2 г предельного одноатомного спирта, содержащего три метильные группы. Определите строение исходного углеводорода и полученного спирта.
Решение
Запишем уравнения реакций:
СnН2n + НСl → СnН2n+1Сl,
CnH2n+1Cl + NaOH → CnH2n+1OH + NaCl.
v(HCl) = 6,72/22,4 = 0,3 моль.
Согласно уравнениям реакций,
v(CnH2n+1OH) = v(CnH2n+1Cl) = v(HCl) = 0.3 моль.
Молярная масса спирта равна:
M(CnH2n+1OH) = 22,2/0,3 = 74 г/моль, откуда n = 4.
Следовательно, молекулярная формула спирта — С4Н9ОН.
Из четырех спиртов состава С4Н9ОН только третичный спирт (2-метилпропанол-2, или трет-бутиловый спирт) содержит три метильные группы. В состав молекулы этого спирта входит разветвленный углеродный скелет, следовательно, исходный алкен состава С4Н8 тоже имел разветвленный скелет. Это 2-метилпропен. Уравнения реакций:
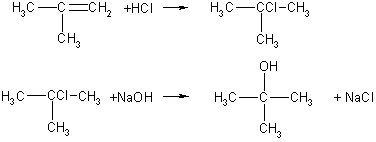
Ответ. 2-метилпропен; трет-бутанол.
Задача 8. Соединение неизвестного строения медленно реагирует с натрием, не окисляется раствором дихромата натрия, с концентрированной соляной кислотой реагирует быстро с образованием алкилхлорида, содержащего 33,3% хлора по массе. Определите строение этого соединения.
Решение
Характер реакций с Na, с Na2Cr2O7 и с HCl свидетельствует о том, что неизвестное вещество — третичный спирт, при реакции с HCl образуется третичный алкилхлорид:
ROH + HCl → RCl + Н2О.
Один моль RCl содержит один моль Cl массой 35,5 г, что составляет 33,3% от общей массы, следовательно молярная масса алкилхлорида равна: M(RCl) = 35,5/0,333 = 106,5 г/моль, а молярная масса углеводородного радикала равна: M(R) = 106,5-35,5 = 71 г/моль. Единственный радикал с такой молярной массой -С5Н11.
Третичные спирты имеют общую формулу:
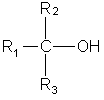
Один атом углерода из пяти соединен с гидроксильной группой, а четыре атома входят в состав трех радикалов. Разбить четыре атома углерода на три радикала можно единственным способом: два радикала СН3 и один радикал С2Н5. Искомый спирт 2-метилбутанол-2:
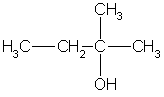
Ответ. 2-метилбутанол-2.
Задача 9. Расположите в порядке возрастания кислотности следующие вещества: фенол, сернистая кислота, метанол. Приведите уравнения химических реакций, подтверждающие правильность выбранной последовательности.
Решение
Правильный ряд выглядит так:
СН3ОН < С6Н5ОН < H2SO3.
Фенол сильнее метанола, поскольку фенол реагирует с растворами щелочей, а метанол — нет:
С6Н5ОН + NaOH = C6H5ONa + H2O , СН3ОН + NaOH —I→
Далее воспользуемся правилом, согласно которому более сильная кислота вытесняет более слабую из ее солей.
C6H5ONa + SO2 + H2O = С6Н5ОН + NaHSO3 .
Фенол вытесняется сернистой кислотой из фенолята натрия, следовательно, сернистая кислота сильнее фенола.
Задача 10. При действии избытка натрия на смесь этилового спирта и фенола выделилось 6,72 л водорода (н.у.). Для полной нейтрализации этой же смеси потребовалось 25 мл 40%-ного раствора гидроксида калия (плотность 1,4 г/мл). Определите массовые доли веществ в исходной смеси.
Решение. С натрием реагируют и этанол, и фенол:
2С2Н5ОН + 2Na → 2C2H5ONa + Н2↑,
2С6Н5ОН + 2Na → 2C6H5ONa + Н2↑,
а с гидроксидом калия -только фенол:
С6Н5ОН + KОН → С6Н5ОK + Н2О.
v(KOH) = 25-1,4-0,4 / 56 = 0,25 моль = v(C6H5OH).
Из 0,25 моль фенола в реакции с натрием выделилось 0,25/2 = 0,125 моль Н2, а всего выделилось 6,72/22,4 = 0,3 моль Н2. Оставшиеся 0,3-0,125 = 0,175 моль Н2 выделились из этанола, которого израсходовано 0,175-2 = 0,35 моль.
Массы веществ в исходной смеси:
m(С6Н5ОН) = 0,25-94 = 23,5 г, m(С2Н5ОН) = 0,35-46 = 16,1 г. Массовые доли: (С6Н5ОН) = 23,5 / (23,5+16,1) = 0,593, или 59,3%, (С2Н5ОН)= 16,1 /(23,5+16,1) = 0,407, или 40,7%.
Ответ. 59,3% фенола, 40,7% этанола.
Задача 11. Среди изомеров состава С7Н7ОK выберите такой, из которого в две стадии можно получить соединение состава С7Н6ОВr2.
Решение. Изомеры состава С7Н7ОK могут быть производными метилфенолов (крезолов) или бензилового спирта — простейшего ароматического спирта:
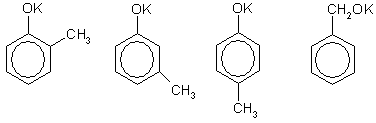
Вещество состава С7Н6ОВr2 - это дибромпроизводное от С7Н8О, которое можно получить по реакции с любой неорганической кислотой (фенол, его гомологи и ароматические спирты — очень слабые кислоты). Два атома водорода можно заместить на два атома брома в бензольном кольце под действием бромной воды, если с бензольным кольцом соединена группа ОН, и при этом одно из орто- и пара-положений по отношению г группе ОН занято группой СН3 (если все эти положения будут свободны от заместителей, то образуется трибромпроизводное). Этому условию удовлетворяют 2-метилфенол (о-крезол) и 4-метилфенол (n-крезол). Таким образом, схема реакций выглядит следующим образом (на примере 2-метилфенолята калия):
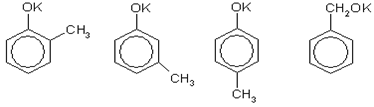
Аналогичная схема справедлива для 4-метилфенолята калия.
Ответ. 2-метилфенолят калия или 4-метилфенолят калия [7, 10, 11, 12].
ТЕСТЫ
1. Различить пробирки с бензольными растворами фенола и этанола можно с помощью:
а) натрия
б) гидроксида калия
в) бромной воды +
г) хлороводорода
2.Какие два органических вещества используются для получения фенола в промышленности?
а) толуол
б) бензол +
в) этилен
г) пропилен +
3.В отличие от этанола фенол реагирует с:
а) калием
б) водным раствором гидроксида калия +
в) хлороводородом
г) гидросульфатом калия
4. При взаимодействии предельных альдегидов с водородом образуются:
а) карбоновые кислоты
б) простые эфиры
в) вторичные спирты
г) первичные спирты +
5. При восстановлении пропаналя образуется:
а) пропановая кислота
б) пропанол-2
в) пропанол-1 +
г) изопропиловый спирт
5. Формалином называется:
а) 35-40%-ный раствор этанола в воде
б) 35-40%-ный раствор метаналя в воде +
в) 35-40%-ный раствор муравьиного альдегида в воде +
г) 35-40%-ный раствор формальдегида в воде +
6. Этаналь можно получить:
а) дегидрированием этанола +
б) окислением этанола кислородом в присутствии катализатора +
в) взаимодействием этилена с водой
г) взаимодействием ацетилена с водой +
7. Гомологами метаналя являются:
а) этаналь +
б) формалин
в) бутаналь +
г) этанол
8.Основной поставщик фенола и формальдегида в атмосферу:
а) медицина
б) деревообрабатывающая промышленность +
в) химическая промышленность +
г) пищевая промышленность
9. ПДК фенола в воздухе:
а) 1 мг/м3
б) 20 мг/м3
в) 17 мг/м3
г) 5 мг/м3 +
10. ПДК фенола в сточных водах:
а) 20 мг/м3
б) 1-2 мг/м3 +
в) 12 мг/м3
г) 4 мг/м3
11. ПДК формальдегида в воздухе:
а) 0,05 мг/м3
б) 0,007 мг/м3
в) 0,003 мг/м3 +
г) 2 мг/м3
12. Смертельная доза 35% водного раствора формальдегида равна:
а) 1 г
б) 100 г
в) 10-50г +
г) 200г
13. Алкоголятами называются продукты взаимодействия:
а) фенолов с активными металлами
б) спиртов с галогеноводородами +
в) спиртов с карбоновыми кислотами
г) спиртов с активными металлами +
14. Укажите названия первичных спиртов:
а) этанол +
б) изопропиловый
в) пропиловый +
г) изобутиловый
15. Укажите названия веществ, с которыми реагирует этанол:
а) бромоводород +
б) уксусная кислота
в) метанол
г) раствор брома в четыреххлористом углероде
16. Назовите по систематической номенклатуре соединение, которое преимущественно получается при взаимодействии водного раствора щелочи с 2- хлорбутаном:
а) 1- бутен
б) 2- бутен
в) 2- бутанол +
г) 1- метил-1- пропанол
17. Какие соединения могут получиться при дегидратации 1- пропанола в различных условиях:
а) пропилен +
б) метилпропиловый эфир
в) дипропиловый эфир +
г) 2- пропанол
18. Этиленгликоль можно получать:
а) взаимодействием ацетилена с водой +
б) взаимодействием этилена с водным раствором перманганата калия +
в) взаимодействием 1,2- дихлорэтана с водным раствором щелочи +
г) взаимодействием этилена с водой
19. С какими веществами реагирует глицерин?
а) нитрат калия
б) азотная кислота +
в) натрий +
г) свежеприготовленный гидроксид меди +
20. При окислении первичного спирта можно получить:
а) алкен
б) альдегид +
в) углекислый газ +
г) простой эфир
21. При дегидратации этилового спирта образуется:
а) этилен
б) ацетилен
в) пропилен +
г) пропин
22. Изомерами бутанола- 1 являются:
а) изопропиловый спирт
б) пропанол- 1
в) бутанол-2 +
г) 2-метилпропанол-2 +
23. Этаналь можно получить:
а) дегидрированием этанола +
б) окислением этанола кислородом в присугствии катализатора +
в) взаимодействием этилена с водой
г) взаимодействием ацетилена с водой +
24. Какой спирт образуется при восстановлении 3-метилбутаналя?
а) третичный бутиловый
б) 2-метилбуганол-1
в) 3-метилбуганол-1 +
г) 2-метилбутанол-4
25. Гомологами метаналя являются:
а) этаналь +
б) формалин
в) бутаналь +
г) этанол
26. Какое вещество является изомером 2-метилпропаналя?
а) 1-буганол
б) буганаль
в) валериановый альдегид +
г) пентаналь +
27. Какие из перечисленных веществ являются между собой гомологами?
а) масляный альдегид +
б) этанол
в) диметиловый эфир
г) пентаналь +
28. Какие соединения могут образоваться при окислении этаналя в различных условиях?
а) этанол
) этановая кислота
в) углекислый газ
г) пропионовая кислота
29. При окислении этилена кислородом в присутствии хлоридов палладия и меди преимущественно образуется:
а) этанол
б) этановая кислота +
в) ацетальдегид
г) этаналь
30. С какими веществами реагирует метановая кислота?
а) метанол +
б) алюминий +
в) карбонат натрия +
г) аммиачный раствор оксида серебра +
31. В отличие от других монокарбоновых кислот предельного ряда муравьиная кислота:
а) реагирует с натрием
б) жидкость при обычных условиях
в) легко окисляется +
г) представляет собой по строению альдегидокислоту +
32. При растворении в воде 1 моль уксусного ангидрида образуете
а) 2 моль этаналя
б) 2 моль этанола
в) 2 моль уксусной кислоты +
г) 1 моль метилацетата
33. С какими веществами реагирует ацетат натрия?
а) соляная кислота +
б) гидроксид натрия при нагревании +
в) угольная кислота
г) этан
34. При взаимодействии этанола и оксида углерода (П) соответствующих условиях получается?
а) этаналь
б) пропаналь
в) пропановая кислота +
г) метилацетат
35. С какими веществами реагирует муравьиная кислота?
а) хлорид меди (П)
б) сульфат натрия
в) гидрокарбонат калия +
г) аммиачный раствор оксида серебра +
36. В отличие от стеариновой кислоты олеиновая кислота:
а) жидкая при комнатной температуре +
б) растворима в воде
в) обесцвечивает бромную воду +
г) реагирует со щелочами
37. Какие вещества реагируют с водородом?
а) линолевая кислота +
б) этанол
в) пропаналь +
г) пропан
38. Какая реакция лежит в основе получения сложных эфиров?
а) нейтрализации
б) полимеризации
в) этерификации +
г) гидрирования
38. Какая кислота получается при окислении изобутилового спирта:
а) бутановая +
б) масляная
в) валериановая
г) 2- метилпропановая
39. Уксусную кислоту нельзя получить:
а) окислением ацетальдегида
б) восстановлением этаналя +
в) окислением бутанола +
г) окислением метана
40. Гомологи уксусной кислоты являются электролитами:
а) слабыми +
б) сильными
в) амфотерными
г) все предыдущие ответы неверны
41. С какими веществами реагирует как фенол, так и бензол?
а) бром +
б) нитрующая смесь
в) натрий +
г) водный раствор гидроксида натрия
42. Для обнаружения фенола используют:
а) хлороводород
б) свежеприготовленный раствор меди (II)
в) хлорид железа трехвалентный +
г) бромная вода +
43. Как называется альдегид
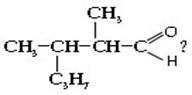 :
:
а) 2-Метил-3-пропилбутаналь; б) 2,3-диметилгексаналь; в) 4,5-диметилгексаналь; + г) 2-метил-2-пропилбутаналь.
44. С каким из веществ будет взаимодействовать этиловый спирт?
а) NaOH; + б) Na; в) СаСО3; + г) НСl.
45. Расположите вещества в порядке увеличения кислотных свойств.
Ответ: в, а, б
46. Расположите вещества в порядке увеличения кислотных свойств.
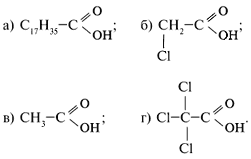
Ответ: а, в, г
47. Какая реакция протекает при термическом крекинге нефтепродуктов
а) гидратации
б) хлорирования
в) разрыва связи С-С +
г) гидрирования [8, 9, 10].
| Количество выполненных заданий, в % | Оценка |
| 35-40 | неудовлетворительно |
| 40-60 | удовлетворительно |
| 60-90 | хорошо |
| 90-100 | отлично |
ЛИТЕРАТУРА
1.Шишов С.Е., Кальней В.А. Школа: мониторинг качества образования. - М., 2000.
2.Горковенко М.Ю. Поурочные разработки по химии, Москва «ВАКО», 2005.
3.Ахметов Н.С. Учебник для 10класса общеобразовательных учреждений. М.: Просвещение, 1998 г.
4.Рудзитис Г.Е., Фельдман Р.Г. Учебник для 10 класса средней школы. М.: Просвещение, 1992.
5. Стадницкий Г.В., Родионов А.И. Экология: Учеб. пособие для вузов — 4-е изд., исправл. — СПб: Химия, 1997. - 240 с.: ил.
6. Мазур И.И., Молдаванов О.И. Курс инженерной экологии: Учеб. для вузов / Под ред. И.И. Мазура.— М.: Высш. шк., 1999.- 447 с.
7. Габриелян О.С., Остроумов И.Г., Остроумова Е.Е. Органическая химия в тестах, задачах, упражнениях. 10 класс: Учеб. пособие для общеобразовательных учреждений. – М.: Дрофа, 2004. – С. 190–215.
8. Энциклопедия для детей. Т. 17. Химия / Под ред. В.А. Володина. – М.: Аванта+, 2001. – С. 370–393
9. Барковский Е.В., Врублевский А.И. Тесты по химии, Минск, Юнипресс, 2002
10. Химия: Большой справочник для школьников и поступающих в вузы / Е.А. Алферова, Н.С. Ахметов, Н.В. Богомолова и др. М.: Дрофа, 1999.
11.Вивюрский В.Я. Вопросы, упражнения и задачи по органической химии с ответами и решениями. - М.: Гуманит. Изд. Центр ВАДОС, 1999. - 688с.
12. Патапов В.М., Татаринчик С.Н., Аверина А.В. Задачи и упражнение по органической химии. - М.: «Химия», 1997. - 144с.
Перепечатка материалов без ссылки на наш сайт запрещена