Реферат: Лазеры и их применение в медицине
Реферат: Лазеры и их применение в медицине
СОДЕРЖАНИЕ
ВВЕДЕНИЕ
1 ЛАЗЕРЫ И ИХ ПРИМЕНЕНИЕ В МЕДИЦИНЕ
2 ОСНОВНЫЕ НАПРАВЛЕНИЯ И ЦЕЛИ МЕДИКО-БИОЛОГИЧЕСКОГО ИСПОЛЬЗОВАНИЯ ЛАЗЕРОВ
3 ФИЗИЧЕСКИЕ ОСНОВЫ ПРИМЕНЕНИЯ ЛАЗЕРОВ В МЕДИЦИНСКОЙ ПРАКТИКЕ
4 МЕРЫ ЗАЩИТЫ ОТ ЛАЗЕРНОГО ИЗЛУЧЕНИЯ
5 ПРОНИКНОВЕНИЕ ЛАЗЕРНОГО ИЗЛУЧЕНИЯ В БИОЛОГИЧЕСКИЕ ТКАНИ
6 ПАТОГЕНЕТИЧЕСКИЕ МЕХАНИЗМЫ ВЗАИМОДЕЙСТВИЯ ЛАЗЕРНОГО ИЗЛУЧЕНИЯ С БИОЛОГИЧЕСКИМИ ТКАНЯМИ
7 МЕХАНИЗМЫ ЛАЗЕРНОЙ БИОСТИМУЛЯЦИИ
ИСПОЛЬЗОВАННАЯ ЛИТЕРАТУРА
ВВЕДЕНИЕ
Основными инструментами, которые применяет хирург для диссекции тканей, являются скальпель и ножницы, т. е. режущие инструменты. Однако раны и разрезы, производимые скальпелем и ножницами, сопровождаются кровотечением, требующим применения специальных мер гемостаза. Кроме того, при контакте с тканями режущие инструменты могут распространять микрофлору и клетки злокачественных опухолей вдоль линии разреза. В связи с этим с давних пор хирурги мечтали иметь в своем распоряжении такой инструмент, который производил бы бескровный разрез, одновременно уничтожая патогенную микрофлору и опухолевые клетки в операционной ране. Вмешательства на «сухом операционном поле» являются идеалом для хирургов любого профиля.
Попытки создать «идеальный» скальпель относятся к концу прошлого века, когда был сконструирован так называемый электронож, работающий с использованием токов высокой частоты. Этот прибор в более совершенных вариантах в настоящее время применяют довольно широко хирурги различных специальностей. Однако по мере накопления опыта выявлены отрицательные стороны «электрохирургии», основной из которых является слишком большая зона термического ожога тканей в области проведения разреза. Известно, что чем шире зона ожога, тем хуже заживает хирургическая рана. Кроме того, при использовании электроножа возникает необходимость включения тела больного в электрическую цепь. Электрохирургические аппараты отрицательно влияют на работу электронных приборов и устройств слежения за жизнедеятельностью организма во время операции. Криохирургические аппараты также вызывают значительное повреждение тканей, ухудшающее процесс заживления. Скорость рассечения тканей криоскальпелем очень низка. Фактически при этом происходит не рассечение, а деструкция тканей. Значительную зону ожога наблюдают и при использовании плазменного скальпеля. Если принять во внимание, что луч лазера обладает выраженными гемостатическими свойствами, а также способностью герметизировать бронхиолы, желчевыводящие протоки и протоки поджелудочной железы, то применение лазерной техники в хирургии становится исключительно перспективным. Кратко перечисленные некоторые достоинства применения лазеров в хирургии относятся прежде всего к лазерам на углекислом газе (С02-лазерам). Кроме них, в медицине применяют лазеры, работающие на других принципах и на других рабочих веществах. Эти лазеры обладают принципиально другими качествами при воздействии на биологические ткани и применяющих по сравнительно узким показаниям, в частности в сердечно-сосудистой хирургии, в онкологии, для лечения хирургических заболеваний кожи и видимых слизистых оболочек и др.
1 ЛАЗЕРЫ И ИХ ПРИМЕНЕНИЕ В МЕДИЦИНЕ
Несмотря на общую природу световых и радиоволн, многие годы оптика и радиоэлектроника развивались самостоятельно, независимо друг от друга. Казалось, что источники света — возбужденные частицы и генераторы радиоволн — имеют мало общего. Лишь с середины XX столетия появились работы по созданию молекулярных усилителей и генераторов радиоволн, которые положили начало новой самостоятельной области физики — квантовой электронике.
Квантовая электроника изучает методы усиления и генерации электромагнитных колебаний с использованием вынужденного излучения квантовых систем. Достижения в этой области знаний находят все большее применение в науке и технике. Ознакомимся с некоторыми явлениями, лежащими в основе квантовой электроники и работы оптических квантовых генераторов — лазеров.
Лазеры представляют собой источники света, работающие на базе процесса вынужденного (стимулированного, индуцированного) испускания фотонов возбужденными атомами или молекулами под воздействием фотонов излучения, имеющих ту же частоту. Отличительной чертой этого процесса является то, что фотон, возникающий при вынужденном испускании, идентичен вызвавшему его появление внешнему фотону по частоте, фазе, направлению и поляризации. Это определяет уникальные свойства квантовых генераторов: высокая когерентность излучения в пространстве и во времени, высокая монохроматичность, узкая направленность пучка излучения, огромная концентрация потока мощности и способность фокусироваться в очень малые объемы. Лазеры создаются на базе различных активных сред: газообразной, жидкой или твердой. Они могут давать излучение в весьма широком диапазоне длин волн - от 100 нм (ультрафиолетовый свет) до 1.2 мкм (инфракрасное излучение) - и могут работать как в непрерывном, так и в импульсном режимах.
Лазер состоит из трех принципиально важных узлов: излучателя, системы накачки и источника питания, работа которых обеспечивается с помощью специальных вспомогательных устройств.
Излучатель предназначен для преобразования энергии накачки (перевода гелий-неоновой смеси 3 в активное состояние) в лазерное излучение и содержит оптический резонатор, представляющий собой в общем случае систему тщательно изготовленных отражающих, преломляющих и фокусирующих элементов, во внутреннем пространстве которого возбуждается и поддерживается определенный тип электромагнитных колебаний оптического диапазона. Оптический резонатор должен иметь минимальные потери в рабочей части спектра, высокую точность изготовления узлов и их взаимной установки.
Создание лазеров оказалось возможным в результате реализации трех фундаментальных физических идей: вынужденного излучения, создания термодинамически неравновесной инверсной населенности энергетических уровней атомов и использования положительной обратной связи .
Возбужденные молекулы (атомы) способны излучать фотоны люминесценции. Такое излучение является спонтанным процессом . Оно случайно и хаотично по времени, частоте (могут быть переходы между разными уровнями), по направлению распространения и поляризации. Другое излучение — вынужденное, или индуцированное — возникает при взаимодействии фотона с возбужденной молекулой, если энергия фотона равна разности соответствующих уровней энергии. При вынужденном (индуцированном) излучении число переходов, совершаемых в секунду, зависит от числа фотонов, попадающих в вещество за это же время, т. е. от интенсивности света, а также от числа возбужденных молекул. Другими словами, число вынужденных переходов будет тем больше, чем выше населенность соответствующих возбужденных энергетических состояний.
Индуцированное излучение тождественно падающему во всех отношениях, в том числе и по фазе, поэтому можно говорить о когерентном усилении электромагнитной волны, что используется в качестве первой основополагающей идеи в принципах лазерной генерации.
Вторая идея, реализуемая при создании лазеров, заключается в создании термодинамически неравновесных систем, в которых вопреки закону Больцмана, на более высоком уровне находится больше частиц, чем на более низком. Состояние среды, в котором хотя бы для двух энергетических уровней оказывается, что число частиц с большей энергией превосходит число частиц с меньше энергией, называется состоянием с инверсной населенностью уровней, а среда — активной. Именно активная среда, в которой фотоны взаимодействуют с возбужденными атомами, вызывая их вынужденные переходы на более низкий уровень с испускание квантов индуцированного (вынужденного) излучения, является рабочим веществом лазера. Состояние с инверсной населенностью, уровней формально получается из распределения Больцмана для Т < О К, поэтому иногда называется состоянием с «отрицательной» температурой. По мере распространения света в активной сред интенсивность его возрастает, имеет место явление, обратное поглощению, т. е. усиление света. Это означает, что в законе Бугера kX < 0, поэтому инверсная населенность соответствует среде с отрицательным показателем поглощения.
Состояние с инверсной населенностью можно создать, отбирая частицы с меньшей энергией или специально возбуждая частицы, например, светом или электрическим разрядом. Само по себе состояние с отрицательной температурой долго не существует.
Третья идея, используемая в принципах лазерной генерации, возникла в радиофизике и заключается в использовании положительной обратной связи. При ее осуществлении часть генерируемого вынужденного излучения остается внутри рабочего вещества и вызывает вынужденное излучение все новыми и новыми возбужденными атомами. Для реализации такого процесса активную среду помещают в оптический резонатор, состоящий обычно из двух зеркал, подобранных так, чтобы возникающее в нем излучение многократно проходило через активную среду, превращая ее в генератор когерентного вынужденного излучения.
Первый такой генератор в диапазоне СВЧ (мазер) был сконструирован в 1955 г. независимо советскими учеными Н. Г. Басоиым и А. М. Прохоровым и американскими — Ч. Таунсом и др.. Так как работа этого прибора была основана на вынужденном излучении молекул аммиака, то генератор был назван молекулярным.
В 1960 г. был создан первый квантовый генератор видимого диапазона излучения — лазер с кристаллом рубина в качестве рабочего вещества (активной среды). В том же году был создан газовый гелий-неоновый лазер. Все огромное многообразие созданных в настоящее время лазеров можно классифицировать по видам рабочего вещества: различают газовые, жидкостные, полупроводниковые и твердотельные лазеры. В зависимости от типа лазера энергия для создания инверсной населенности сообщается разными способами: возбуждение очень интенсивным светом — «оптическая накачка», электрическим газовым разрядом, в полупроводниковых лазерах — электрическим током. По характеру свечения лазеры подразделяют на импульсные и непрерывные.
Рассмотрим принцип работы твердотельного рубинового лазера. Рубин — это кристалл окиси алюминия Аl203, содержащий в виде примеси примерно 0,05% ионов хрома Сг3+. Возбуждение ионов хрома осуществляют методом оптической накачки с помощью импульсных источников света большой мощности. В одной из конструкций применяют трубчатый отражатель, имеющий в сечении форму эллипса. Внутри отражателя помещены прямая ксеноновая импульсная лампа и рубиновый стержень, расположенные вдоль линий, проходящих через фокусы эллипса (рис. 1). Внутренняя поверхность алюминиевого отражателя хорошо отполирована или посеребрена. Основное свойство эллиптического отражателя заключается в том, что свет, вышедший из одного его фокуса (ксеноновой лампы) и отраженный от стенок, попадает в другой фокус отражателя (рубиновый стержень).
Рубиновый лазер работает по трехуровневой схеме (рис. 2 а). В результате оптической накачки ионы хрома переходят с основного уровня 1 в короткоживущее возбужденное состояние З. Затем происходит безызлучательный переход в долгоживущее (метастабильное) состояние 2, с которого вероятность спонтанного излучательного перехода относительно мала. Поэтому происходит накопление возбужденных ионов в состоянии 2 и создается инверсная населенность между уровнями 1 и 2. В обычных условиях переход со 2-го на 1-й уровень происходит спонтанно и сопровождается люминесценцией с длиной волны 694,3 нм. В резонаторе лазера есть два зеркала (см. рис. 1), одно из которых имеет коэффициент отражения R интенсивности отраженного и падающего на зеркало света), другое зеркало полупрозрачное и пропускает часть падающего на него излучения {R < 100%). Кванты люминесценции в зависимости от направления их движения либо вылетают из боковой поверхности рубинового стержня и теряются, либо, многократно отражаясь от зеркал, сами вызывают вынужденные переходы. Таким образом, пучок, перпендикулярный зеркалам, будет иметь наибольшее развитие и выходит наружу через полупрозрачное зеркало. Такой лазер работает в импульсном режиме.
Наряду с рубиновым лазером, работающим по трехуровневой схеме, широкое распространение получили четырехуровневые схемы лазеров на ионах редкоземельных элементов (неодим, самарий и др.), внедренных в кристаллическую или стеклянную матрицы (рис. 24, б). В таких случаях инверсная населенность создается между двумя возбужденными уровнями: долгоживущий уровнем 2 и короткоживущим уровнем 2'.
Очень распространенным газовым лазером является гелий-неоновый, возбуждение в котором возникает при электрическом разряде. Активной средой в нем служит смесь гелия и неона в соотношении 10:1 и давлении около 150 Па. Излучающими являются атомы неона, атомы гелия играют вспомогательную роль. На рис. 24, в показаны энергетические уровни атомов гелия и неона. Генерация происходит при переходе между 3 и 2 уровнями неона. Для того чтобы создать между ними инверсную населенность, необходимо заселить уровень 3 и опустошить уровень 2. Заселение уровня 3 происходит с помощью атомов гелия. При электрическом разряде электронным ударом происходит возбуждение атомов гелия в долгоживущее состояние (со временем жизни около 10 3 с). Энергия этого состояния очень близка к энергии уровня 3 неона, поэтому при соударении возбужденного атома гелия с невозбужденным атомом неона происходит передача энергии, в результате чего заселяется уровень 3 неона. Для чистого неона время жизни на этом уровне мало и атомы переходят на уровни 1 или 2, реализуется больцмановское распределение. Опустошение уровня 2 неона происходит в основном за счет спонтанного перехода его атомов в основное состояние при соударениях со стенками разрядной трубки. Так обеспечивается стационарная инверсная населенность уровней 2 и 3 неона.
Основным конструктивным элементом гелий-неонового лазер-(рис. 3) является газоразрядная трубка диаметром около 7 мм. В трубку вмонтированы электроды для создания газового разряда и возбуждения гелия. На концах трубки под углом Брюстера расположены окна, благодаря которым излучение оказывается плоскополяризованным. Плоскопараллельные зеркала резонатора монтируются вне трубки, одно из них полупрозрачное (коэффициент отражения R < 100%). Таким образом, пучок вынужденного излучения выходит наружу через полупрозрачное зеркало. Это лазер непрерывного действия.
Зеркала резонатора делают с многослойными покрытиями, и вследствие интерференции создается необходимый коэффициент отражения для заданной длины волны. Чаще всего используются гелий-неоновые лазеры, излучающие красный свет с длиной волны 632,8 нм. Мощность таких лазеров небольшая, она не превышает 100 мВт.
Применение лазеров основано на свойствах их излучения: высокая монохроматичность ( ~ 0,01 нм), достаточно большая мощность, узость пучка и когерентность.
Узость светового пучка и малая его расходимость позволили использовать лазеры для измерения расстояния между Землей и Луной (получаемая точность — около десятков сантиметров), скорости вращения Венеры и Меркурия и др.
На когерентности лазерного излучения основано их применение в голографии. .На основе гелий-неонового лазера с использованием волоконной оптики разработаны гастроскопы, которые позволяют голографически формировать объемное изображение внутренней полости желудка.
Монохроматичность лазерного излучения очень удобна при возбуждении спектров комбинационного рассеяния света атомами и молекулами .
Широкое применение лазеры нашли в хирургии, стоматологии, офтальмологии, дерматологии, онкологии. Биологические эффекты лазерного излучения зависят как от свойств биологического материала, так и от свойств лазерного излучения.
Все лазеры, используемые в медицине, условно подразделяются на 2 вида: низкоинтенсивные (интенсивность не превышает 10 Вт/см2, чаще всего составляет около 0,1 Вт/см2) — терапевтические и высокоинтенсивные — хирургические. Интенсивность наиболее мощных лазеров может достигать 1014 Вт/см2, в медицине обычно используются лазеры с интенсивностью 102— 106 Вт/см2.
Низкоинтенсивные
лазеры — это такие, которые не вызывают заметного деструктивного действия на
ткани непосредственно во время облучения. В видимой и ультрафиолетовой областях
спектра их эффекты обусловлены фотохимическими реакциями и не отличаются от
эффектов, вызываемых монохроматическим светом, полученным от обычных,
некогерентных источников. В этих случаях лазеры являются просто удобными
монохроматическими источниками света, обеспечивающими точную![]()
![]()
![]() локализацию и
дозированность воздействия. Примерами может служить использование света
гелий-неоновых лазеров для лечения трофических язв, ишемической болезни сердца
и др., а также криптоновых и др. лазеров для фотохимического повреждения
опухолей в фотодинамической терапии.
локализацию и
дозированность воздействия. Примерами может служить использование света
гелий-неоновых лазеров для лечения трофических язв, ишемической болезни сердца
и др., а также криптоновых и др. лазеров для фотохимического повреждения
опухолей в фотодинамической терапии.
Качественно новые явления наблюдаются при использовании видимого или ультрафиолетового излучения высокоинтенсивных лазеров. В лабораторных фотохимических экспериментах с обычными источниками света, а также в природе при действии солнечного света обычно осуществляется однофотонное поглощение. Об этом говорится во втором законе фотохимии, сформулированном Штарком и Эйнштейном: каждая молекула, участвующая в химической реакции, идущей под действием света, поглощает один квант излучения, который вызывает реакцию. Однофотонность поглощения, описываемая вторым законом, выполняется потому, что при обычных интенсивностях света практически невозможно одновременное попадание в молекулу, находящуюся в основном состоянии, двух фотонов. Если бы такое событие осуществилось, то выражение приобрело бы вид:
2hv = Et - Ek,
что означало бы суммирование энергии двух фотонов для перехода молекулы из энергетического состояния Ek в состояние с энергией Ег. Не происходит также поглощения фотонов электронно-возбужденными молекулами, так как их время жизни мало, а обычно используемые интенсивности облучения невелики. Поэтому концентрация электронно-возбужденных молекул низка, и поглощение ими еще одного фотона чрезвычайно маловероятно.
Однако если увеличить интенсивность света, то становится возможным двухфотонное поглощение. Например, облучение растворов ДНК высокоинтенсивным импульсным лазерным излучением с длиной волны около 266 нм приводило к ионизации молекул ДНК, подобной вызываемой у-излучением. Воздействие ультрафиолета с низкой интенсивностью ионизации не вызывало. Установлено, что при облучении водных растворов нуклеиновых кислот или их оснований пикосекундными (длительность импульса 30 пс) или наносекундными (10 нс) импульсами с интенсивностями выше 106 Вт/см2 приводило к электронным переходам, завершавшимся ионизацией молекул. При пикосекундных импульсах (рис. 4, а) заселение высоких электронных уровней происходило по схеме (S0 —> S1 —> Sn), а при hv hv наносекундных (рис. 4., б) — по схеме (S0 —> S1 -► Тг -> Тп). В обоих случаях молекулы получали энергию, превышающую энергию ионизации.
Полоса поглощения ДНК располагается в ультрафиолетовой области спектра при < 315 нм, видимый свет нуклеиновые кислоты совсем не поглощают. Однако воздействие высокоинтенсивным лазерным излучением около 532 нм переводит ДНК в электронно-возбужденное состояние за счет суммирования энергии двух фотонов (рис. 5).
Поглощение любого излучения приводит к выделению некоторого количества энергии в виде тепла, которое рассеивается от возбужденных молекул в окружающее пространство. Инфракрасное излучение поглощается главным образом водой и вызывает в основном тепловые эффекты. Поэтому излучение высокоинтенсивных инфракрасных лазеров вызывает заметное немедленное тепловое действие на ткани. Под тепловым воздействием лазерного излучения в медицине понимают в основном испарение (резание) и коагуляцию биотканей. Это касается различных лазеров с интенсивностью от 1 до 107 Вт/см2 и с продолжительностью облучения от миллисекунд до нескольких секунд. К ним относятся, например, газовый С02-лазер (с длиной волны 10,6 мкм), Nd:YAG-лазep (1,064 мкм) и другие. Nd:YAG-лазep — наиболее широко исполь-зуемый твердотельный четырехуровневый лазер. Генерация осуществляется на переходах ионов неодима (Nd3+),введенных в кристаллыY3Al5012 иттрий-алюминиевого граната (YAG).
Наряду с нагревом ткани происходит отвод части тепла за счет теплопроводности и тока крови. При температурах ниже 40 °С не обратимые повреждение не наблюдаются. При температуре 60 °С начинается денатурация белков, коагуляция тканей и некроз. При 100- 150 °С вызывается обезвоживание и обугливание, а при температурах свыше 300 °С ткань испаряется.
Когда излучение исходит от высокоинтенсивного сфокусированного лазера, количество выделяющегося тепла велико, в ткани возникает температурный градиент. В месте падения луча ткань испаряется, в прилегающих областях пронсходит обугливание и коагуляция (рис. 6). Фотоиспарение является способом послойного удаления или разрезания ткани. В результате коагуляции завариваются сосуды и останавливается кровотечение. Так сфокусированным лучом непрерывного С02-лазера ( ) с мощностью около 2 • 103 Вт/см2 пользуются как хирургическим скальпелем для разрезания биологических тканей.
Если уменьшать длительность воздействия (10 - 10 с) и увеличивать интенсивность (выше 106 Вт/см2), то размеры зон обугливания и коагуляции становятся пренебрежимо малыми. Такой процесс называют фотоабляцией (фотоудалением) и используют для послойного удаления ткани. Фотоабляция возникает при плотностях энергии 0,01—100 Дж/см2.
При дальнейшем повышении интенсивности (10 Вт/см и выше) возможен еще один процесс — «оптический пробой». Это явление заключается в том, что из-за очень высокой напряженности электрического поля лазерного излучения (сравнимой с напряженностью внутриатомных электрических полей) материя ионизации, образуется плазма и генерируются механические ударные волны. Для оптического пробоя не требуется поглощения квантов света веществом в обычном смысле, он наблюдается прозрачных средах, например в воздухе.
2 ОСНОВНЫЕ НАПРАВЛЕНИЯ И ЦЕЛИ МЕДИКО-БИОЛОГИЧЕСКОГО ИСПОЛЬЗОВАНИЯ ЛАЗЕРОВ
Современные направления медико-биологического применения лазеров могут быть разделены на две основные группы Первая — использование лазерного излучения в качестве инструмента исследования. В этом случае лазер играет роль уникального светового источника при спектральных исследованиях, лазерной микроскопии, голографии и др. Вторая группа — основные пути использования лазеров в качестве инструмента воздействия на биологические объекты. Можно выделить три типа такого воздействия.
Первый тип — воздействие на ткани патологического очага импульсным или непрерывным лазерным излучением при плотности мощности порядка 105 Вт/м2, недостаточной для глубокого обезвоживания, испарения тканей и возникновения в них дефекта. Этому типу воздействия соответствует, в частности, применение лазеров в дерматологии и онкологии для облучения патологических тканевых образований, которое приводит к их коагуляции. Второй тип— рассечение тканей, когда под влиянием излучения лазера непрерывного или частотно-периодического (импульсы, следующие с большой частотой) действия часть ткани испаряется и в ней возникает дефект. В этом случае плотность мощности излучения может превосходить используемую при коагуляции на два порядка (107 Вт/м2) и более. Этому типу воздействия соответствует применение лазеров в хирургии. Третий тип — влияние на ткани и органы низкоэнергетического излучения (единицы или десятки ватт на квадратный метр), обычно не вызывающего явных морфологических изменений, но приводящего к определенным биохимическим и физиологическим сдвигам в организме, т. е. воздействие физиотерапевтического типа. К этому типу следует отнести применение гелий-неонового лазера с целью биостимуляции при вяло текущих раневых процессах, трофических язвах и др.
Задача исследований механизма биологического действия лазерной радиации сводится к изучению тех процессов, которые лежат в основе интегральных эффектов, вызываемых облучением: коагуляции тканей, их рассечения, биостимуляционных сдвигов в организме.
3 ФИЗИЧЕСКИЕ ОСНОВЫ ПРИМЕНЕНИЯ ЛАЗЕРОВ В МЕДИЦИНСКОЙ ПРАКТИКЕ
Принцип действия лазеров основан на квантово-механических процессах, протекающих в объеме рабочей среды излучателя, объяснение которым дает квантовая электроника — область физики, исследующая взаимодействие электромагнитного излучения с электронами, входящими в состав атомов и молекул рабочей среды.
Согласно принципам квантовой электроники любая атомная система в процессе своего внутреннего движения находится в состояниях с определенными значениями энергии, называемых квантовыми, т. е. имеет строго определенные (дискретные) значения энергии. Набор этих значений энергии образует энергетический спектр атомной системы.
При отсутствии внешнего возбуждения атомная система стремится к состоянию, в котором ее внутренняя энергия минимальна. При внешнем возбуждении переход атома в состояния с большей энергией сопровождается поглощением порции энергии, равной разности энергий конечного Ет и начального Е„ состояний. Этот процесс записывается в следующем виде:
Em — En=nV mn, (1)
где V mn — частота перехода из состояния п в состояние m; h — постоянная Планка.
Как правило, средняя продолжительность пребывания (время жизни) атома в возбужденном состоянии мала и возбужденный атом самопроизвольно (спонтанно) переходит в состояние с меньшей энергией, испуская при этом квант света (фотон) с энергией, определяемой по формуле (1). При спонтанных переходах атомы испускают кванты света хаотически, не взаимосвязано. Они разлетаются равномерно во всех направлениях. Процесс спонтанных переходов наблюдается при свечении нагретых тел, например, ламп накаливания и др. Такое излучение немонохроматично.
При взаимодействии возбужденного атома с внешним излучением, частота которого соответствует частоте перехода атома из состояния с большей энергией в состояние с меньшей энергией, существует вероятность (тем большая, чем выше интенсивность внешнего излучения) перевода этим внешним излучением атома в состояние с меньшей энергией. При этом атом излучает квант света, имеющий те же частоту vmn, фазу, направление распространения и поляризацию, что и вынуждающий этот переход квант света внешнего излучения.
Такие переходы называются вынужденными (индуцированными). Именно наличие вынужденного излучения обеспечивает возможность генерирования когерентного излучения в оптических квантовых генераторах-лазерах.
Теперь рассмотрим, что произойдет при распространении света через систему, в которой имеются атомы с энергией Ет и Еn (для определенности примем Em>En). Число атомов с энергией Ега обозначим Nm, а число атомов с энергией En—N„. Числа Nm и N„ принято называть населенностью уровней с энергией Еш и Еп соответственно.
В естественных условиях на более высоком энергетическом уровне частиц меньше, чем на более низком для любого значения температуры. Поэтому для любого нагретого тела а — величина отрицательная и в соответствии с формулой (2) распространение света в веществе сопровождается его ослаблением. Для усиления света необходимо иметь Nm>Nn. Такое состояние вещества называют состоянием с инверсией населенности. В этом случае распространение света через вещество сопровождается его усилением за счет энергии возбужденных атомов.
Таким образом, для процесса усиления излучения необходимо обеспечить превышение населенности верхнего уровня перехода над нижним.
Для создания инверсии населенности применяют различные способы, заключающиеся в использовании внешнего источника возбуждения.
Атомную систему с инверсией населенности принято называть активной средой. Для получения генерации излучения необходимо решить проблему обратной связи. Активную среду помещают в оптический резонатор, который в наиболее простом случае представляет собой два взаимно параллельных плоских зеркала, ограничивающих с двух противоположных сторон активную среду. При этом одно из зеркал резонатора частично пропускает излучение генерации и через него осуществляется вывод излучения из резонатора, а другое зеркало полностью отражает падающее на него излучение.
Процесс развития генерации в резонаторе представляется в следующем виде. После создания внешним источником возбуждения в рабочей среде инверсии населенности участвовать в развитии процесса генерации будет только то излучение, которое распространяется вдоль оси резонатора. Это излучение, достигнув поверхности полностью отражающего зеркала резонатора и отразившись от него, снова попадает в активную среду и, распространяясь в ней, за счет вынужденных переходов усиливается. Отразившись от частично отражающего зеркала резонатора, часть усиленного излучения возвращается в активную среду и снова усиливается, а часть излучения выходит из резонатора. Далее указанные процессы повторяются многократно, пока существует внешний источник возбуждения атомной системы.
Для того чтобы процесс генерации излучения был устойчивым, необходимо, чтобы усиление излучения в активной среде за двойной проход в резонаторе было равно или больше полных потерь излучения на том же пути. В полные потери входят потери в активной среде и то излучение, которое выводится из резонатора через частично отражающее зеркало.
Пропущенное частично отражающим зеркалом лазерное излучение выходит за пределы резонатора во внешнее пространство в виде светового пучка с высокой степенью направленности, что обусловлено тем, что в активной среде усиливается в основном излучение, направление распространения которого совпадает с осью резонатора (рис. 2).
В современных лазерах угол расхождения (9) лазерного пучка может достигать дифракционного предела и составлять по порядку величин от нескольких угловых секунд до десятков угловых минут.
Мощность лазерного излучения, снимаемая с единицы объема активной среды, в конечном счете определяется мощностью внешнего источника возбуждения, подводимой к единице объема активной среды. Максимальная полная мощность (энергия) лазерного излучения в довольно широких пределах пропорциональна объему активной среды и максимальной мощности (энергии) источника внешнего возбуждения (накачки).
Основными особенностями лазерного излучения, делающими его перспективным для применения в различных областях медицины, являются высокие направленность, монохроматичность и энергоемкость.
Высокая направленность лазерного излучения характеризуется тем, что угловое расхождение его пучка в свободном пространстве достигает величин, измеряемых десятками угловых секунд. Благодаря этому возможна передача лазерного излучения в пучке на значительные расстояния без существенного увеличения его диаметра. Высокие монохроматичность и направленность как импульсного, так и непрерывного лазерного излучения позволяют фокусировать его в пятна, соизмеримые с длиной волны излучения самого лазера. Столь острая фокусировка делает возможным облучение медико-биологических объектов на клеточном уровне. Кроме того, такая фокусировка позволяет получать требуемый лечебный эффект при небольших энергиях лазерного излучения. Последнее особенно важно при использовании лазерного излучения для обработки биообъектов, чувствительных к свету.
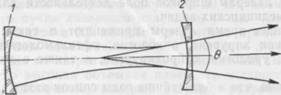
2. Угол расхождения лазерного пучка (6).
1 — непрозрачное зеркало, 2 — полупрозрачное зеркало, 3 — лазерный световой пучок.
Использование острой фокусировки при больших мощностях и энергиях облучения позволяет осуществлять испарение и разрез биоткани, что и обусловило применение лазера в хирургии.
Для объектов, малочувствительных к свету (злокачественные опухоли), возможно облучение мощным излучением на больших площадях.
Во всех случаях характер воздействия лазерного излучения на биологические ткани зависит от длины волны, плотности мощности и режима излучения — непрерывного или импульсного.
Излучение в красной и инфракрасной областях спектра при поглощении биотканями преобразуется в теплоту, которая может расходоваться на испарение вещества, генерацию акустических колебаний, вызывать биохимические реакции.
Излучение в видимой области спектра, помимо тепловых эффектов, обеспечивает условия для стимуляции фотохимических реакций. Так, применение низкоинтенсивного излучения гелий-неонового лазера (длина волны излучения 0,63 мкм) оказывает клинически достоверное действие, приводящее к ускорению заживления трофических и гнойных ран, язв и др. Однако механизм действия этого вида излучения до конца не изучен. Несомненно, что исследования в этом направлении будут способствовать более эффективному и осмысленному применению этого вида излучения в клинической практике.
При использовании лазеров, работающих в непрерывном режиме излучения, преобладает в основном тепловое действие, которое проявляется при средних уровнях мощностей в эффекте коагуляции, а при больших мощностях в эффекте испарения биоткани.
В импульсном режиме действие излучения на биологические объекты более сложно. Взаимодействие излучения с живой тканью здесь носит взрывной характер и сопровождается как тепловыми (коагуляция, испарение) эффектами, так и образованием в биоткани волн сжатия и разрежения, распространяющихся в глубь биоткани. При высоких плотностях мощности возможна ионизация атомов биоткани.
Таким
образом, отличие в параметрах лазерного излучения ведет к отличию в механизме и
результатах взаимодействия![]()
![]() , обеспечивая лазерам широкое поле
деятельности для решения различных медицинских задач.
, обеспечивая лазерам широкое поле
деятельности для решения различных медицинских задач.
В настоящее время лазеры применяют в таких областях медицины, как хирургия, онкология, офтальмология, терапия, гинекология, урология, нейрохирургия, а также с диагностической целью.
В хирургии лазерный луч нашел широкое применение в качестве универсального скальпеля, превосходящего по своим режущим и кровоостанавливающим свойствам электронож. Механизм взаимодействия лазерного скальпеля с биотканями характеризуется следующими особенностями.
1. Отсутствие прямого механического контакта инструмента с биотканью, устраняющее опасность инфицирования оперируемых органов и обеспечивающее проведение операции на свободном операционном поле.
2. Гемостатическое действие излучения, позволяющее получить практически бескровные разрезы, останавливать кровотечение из кровоточащих тканей.
3. Собственное стерилизующее действие излучения, являющееся активным средством борьбы с инфицированием ран, что предотвращает осложнения в послеоперационном периоде.
4. Возможность управления параметрами лазерного излучения, позволяющая получать различные эффекты при взаимодействии излучения с биотканями.
5. Минимальное воздействие на близлежащие ткани.
Разнообразие проблем, существующих в хирургии, обусловило необходимость всестороннего изучения возможностей применения лазеров с различными параметрами и режимами излучения.
В хирургии в качестве светового скальпеля наиболее широкое применение нашли газовые углекислотные лазеры (длина волны излучения 10,6 мкм), работающие в импульсном и непрерывном режиме с мощностью излучения до 100 Вт.
Механизм действия излучения С02-лазера заключается в нагреве биоткани за счет сильного поглощения ею лазерного излучения. Глубина проникновения этого излучения не превышает 50 мкм. В зависимости от плотности мощности излучения его воздействие проявляется в эффектах разреза или поверхностной коагуляции биоткани.
Разрез ткани осуществляют сфокусированным лазерным лучом за счет послойного испарения ее. Объемная плотность мощности при этом достигает нескольких сотен киловатт на 1 см3. Поверхностная коагуляция тканей достигается воздействием на нее расфокусированным лазерным излучением при объемных плотностях порядка нескольких сотен ватт на 1 см3.
При мощности лазерного излучения 20 Вт, диаметре сфокусированного пучка лазерного излучения 1 мм (поверхностная плотность мощности 2,5 кВт/см2) и глубине проникновения излучения 50 мкм объемная плотность мощности лазерного излучения, идущая на нагрев биоткани, достигает 500 кВт/см3. Такая чрезвычайно высокая объемная плотность мощности лазерного излучения обеспечивает быстрый нагрев и разрушение биоткани в зоне действия лазерного луча. При этом вначале происходит разложение биоткани с испарением жидкой и карбонизацией твердой фаз. Полная карбонизация биоткани наблюдается в интервале температур 200—220 °С. Карбонизированный каркас биоткани существует до температур 400—450 °С и при дальнейшем повышении температуры — выгорает. При горении карбонизированного каркаса температура газообразных продуктов сгорания составляет 800—1000 °С.
Глубина разреза определяется скоростью перемещения границ слоя разрушения биоткани в глубь ее. При этом скорость перемещения указанной границы зависит от скорости перемещения точки фокусировки лазерного луча вдоль линии разреза. Чем ниже скорость перемещения точки фокусировки вдоль линии разреза, тем больше глубина разреза, и наоборот.
В отличие от излучения с ,= 10,6 мкм излучение АИГ-Nd-лазера обладает на порядок большей глубиной проникновения в биоткани, что, несомненно, является благоприятным фактором при коагуляции больших кровеносных сосудов при массивных кровотечениях, а также для разрушения глубоколежащих опухолей.
Таким образом, излучение АИГ-Nd-лазера обладает ярко выраженным коагулирующим (режущее действие излучения этого лазера значительно уступает таковому С02-лазера) действием, что и определяет его область практического применения.
4 МЕРЫ ЗАЩИТЫ ОТ ЛАЗЕРНОГО ИЗЛУЧЕНИЯ
При работе с лазерными установками потенциальную опасность для организма человека (пациента, медицинского персонала) представляет неконтролируемое прямое и рассеянное лазерное излучение. Наибольшую опасность оно представляет для зрения оператора, работающего с лазерной установкой. Однако рассеянное инфракрасное лазерное излучение непрерывных углекислотных лазеров установок «Скальпель-1», «Ромашка-1», «Ромашка-2» полностью задерживается слоями слезной жидкости и роговицы глаза и не достигает глазного дна. Поскольку глубина проникновения лазерного излучения не превышает 50 мкм, около 70% его энергии поглощается слезной жидкостью и около 30% —роговицей.
Высокоинтенсивное излучение углекислотного лазера, особенно если оно сфокусировано, может вызывать локальное ожоговое поражение кожи открытых частей тела —рук, лица. Воздействие лазерного излучения на организм человека не проявляется только при интенсивности облучения ниже безопасного уровня, которое для углекислотного лазера непрерывного действия составляет для глаз 0,1 Вт/см2. Известно, что в клинических условиях для достижения требуемого клинического эффекта применяют уровни прямого облучения, в сотни и тысячи раз превышающие безопасный уровень, поэтому при работе с углекислотными лазерными установками необходимо соблюдение определенных мер защиты.
В помещении, где выполняют операции с использованием углекислотного лазера, целесообразно стены и потолок покрыть материалом с минимальной отражающей способностью, а_ аппаратуру и приборы с гладкими блестящими поверхностями разместить таким образом, чтобы на них ни при каких обстоятельствах не мог попасть прямой луч, или отгородить их ширмами, с матовыми темными поверхностями. Перед входом в помещение, в котором находится установка, должно быть установлено световое табло («Не_входить»__«Включен лазер»), включаемое во время лазерной операции.
Защита глаз больных и персонала от прямого или отраженного излучения углекислотного лазера надежно гарантируется очками из обычного оптического стекла. Желательно, чтобы очки были изготовлены таким образом, чтобы исключалась возможность попадания лазерного излучения через щели между оправой и лицом и обеспечивалось широкое поле зрения. Очки надевают только на время выполнения лазерного этапа хирургического вмешательства, чтобы предотвратить непосредственное воздействие лазерного облучения на глаза.
При работе с углекислотными лазерными установками использование лазерных хирургических инструментов повышает опасность повреждения кожи рук и лица хирурга за счет отражения от инструментов лазерного луча. Эта опасность резко снижается при применении инструментов, имеющих специальное «чернение». «Черненые» инструменты поглощают около 90% попадающего на них лазерного излучения с длиной волны 10,6 мкм. Другие инструменты — ранорасширители, кровоостанавливающие зажимы, пинцеты, сшивающие аппараты — также могут отражать лазерный луч. Однако в руках опытного хирурга любое хирургическое вмешательство может быть выполнено без направления лазерного луча на эти инструменты. Существует также опасность возгорания операционного материала, салфеток, простыней и др. при попадании на них прямо направленного лазерного излучения, поэтому при работе с ним необходимо в зоне предполагаемой лазерной обработки использовать мягкий материал, смоченный в изотоническом растворе хлорида натрия._ Целесообразно также в момент выполнения лазерного этапа операции удалять из поля действия лазерного излучения приборы и инструменты, изготовленные из пластических масс, способных возгораться при высокой температуре.
Не следует также забывать, что лазерная установка одновременно является и устройством, работающим с использованием электроэнергии. В связи с этим при работе с ней необходимо соблюдать правила электробезопасности, выполняемые при эксплуатации электроустановок потребителей.
![]() Персонал, работающий с лазерными
установками, должен пройти специальную подготовку и иметь соответствующую
квалификацию. Все лица, работающие с лазерным излучением, регулярно, не менее
одного раза в год, должны подвергаться медицинскому обследованию, включающему
осмотр офтальмологом, терапевтом и невропатологом. Кроме того, необходим
клинический анализ крови с проверкой уровня гемоглобина, числа лейкоцитов и
лейкоцитарной формулы. Проводят также основные печеночные пробы.
Персонал, работающий с лазерными
установками, должен пройти специальную подготовку и иметь соответствующую
квалификацию. Все лица, работающие с лазерным излучением, регулярно, не менее
одного раза в год, должны подвергаться медицинскому обследованию, включающему
осмотр офтальмологом, терапевтом и невропатологом. Кроме того, необходим
клинический анализ крови с проверкой уровня гемоглобина, числа лейкоцитов и
лейкоцитарной формулы. Проводят также основные печеночные пробы.
При аккуратном соблюдении изложенных выше правил опасность повреждения органов, тканей и биологических сред человеческого организма практически отсутствует. Так, за 10-летний период работы с различными лазерными установками, которыми в общей сложности было выполнено несколько тысяч различных операций, мы не наблюдали ни одного случая поражения глаз и кожи лазерным излучением, а также изменений в состоянии здоровья ни у одного из сотрудников учреждения, связанных с работой на лазерных установках.
5 ПРОНИКНОВЕНИЕ ЛАЗЕРНОГО ИЗЛУЧЕНИЯ В БИОЛОГИЧЕСКИЕ ТКАНИ
Закономерности, управляющие проникновением излучения в ткани, имеют непосредственное отношение к проблеме механизма биологического действия лазерной радиации. Одна из причин того, что излучение проникает на ограниченную глубину, состоит в поглощении лазерного излучения биологическими тканями, а оно является, за редким исключением, обязательным начальным звеном, которое предшествует цепи изменений, развивающихся в облученном организме. Глубина проникновения лазерного излучения в ткани весьма важна в практическом отношении, так как она является одним из факторов, определяющих границы возможного применения лазеров в клинике.
Поглощение — не единственный процесс, приводящий к ослаблению лазерного излучения при прохождении его через биологические ткани. Одновременно с поглощением излучения происходит ряд других физических процессов, в частности отражение света от поверхности между двумя средами, преломление при прохождении границы, разделяющей две оптически разнородные среды, рассеяние света частицами ткани и др. Таким образом, можно говорить об общем ослаблении излучения, включающем, помимо поглощения, потери за счет других явлений, и об истинном поглощении излучения. При отсутствии рассеяния поглощение в среде характеризуется двумя параметрами: поглощательной способностью и глубиной поглощения. Поглощательная способность определяется как отношение энергии, поглощенной в среде, к энергии излучения, падающей на поверхность среды. Это отношение всегда меньше 1, так как излучение частично проходит сквозь нее. Глубина поглощения характеризует пространственное распределение поглощенной энергии в среде. В простейшем случае (экспоненциальное затухание света в веществе) она равна расстоянию, на котором мощность излучения уменьшается в 2,718 раза по отношению к мощности излучения на поверхности среды. Величина, обратная глубине поглощения, называется коэффициентом поглощения. Он имеет размеренность см-1. Если наряду с поглощением происходит рассеяние света, то расстояние, на котором в результате совместного действия этих процессов излучение затухает в раз, представляет собой глубину ослабления или проникновения излучения, а обратная ей величина — коэффициент ослабления, также имеющий размерность см-1.
При теоретическом рассмотрении вопросов поглощения лазерного излучения тканями для упрощения задачи можно принять, что излучение представляет собой плоскую волну, падающую на ровную поверхность объекта, а коэффициент поглощения на всем облучаемом участке одинаков и не зависит от интенсивности света. В этом случае энергия (мощность) излучения по мере увеличения глубины будет уменьшаться экспоненциально, и распределение ее выражается уравнением:
Р=Р0ехр (1)
где Р — мощность излучения на глубине ; Ро — мощность излучения, падающего на поверхность ткани; — коэффициент поглощения ткани (пренебрегаем потерями на отражение света от гкани).
В реальных условиях при облучении биологических объектов такое простое соотношение между толщиной слоя ткани и количеством поглощенной энергии нарушается, например за счет различий в коэффициентах поглощения разных участков облучаемой ткани. Так, коэффициент поглощения меланиновых гранул сетчатки глаза в 1000 раз больше, чем окружающей ткани. Учитывая, что светопоглощение представляет собой молекулярный процесс, который в конечном счете зависит от концентрации поглощающих излучение молекул, величина поглощения на клеточном и субклеточном уровнях может значительно изменяться даже от органеллы к органелле. Наконец, поглощение является функцией длины волны, следовательно, коэффициент поглощения широко варьирует для лазеров, излучающих в различных областях спектра.
В ряде ранних исследований о величине поглощения биологических тканей судили на основании результатов измерений их светопропускания. При этом в большинстве случаев опыты были проведены с рубиновым и неодимовым лазерами. Так, при облучении рубиновым лазером мышей было установлено, что через кожу проникает от 45 до 60% энергии, а через кожу и подлежащие мышцы — от 20 до 30%. Разработке метода определения коэффициентов пропускания и отражения тканей были посвящены исследования Г. Г. Шамаевой и др. (1969). Данные, полученные с помощью этого метода при облучении крыс неодимовым лазером, были использованы для расчета коэффициента поглощения кожи, составившего 9,9 см-1.
Л. И. Дерлеменко (1969), М. И. Данко и др. (1972) с помощью интегрального фотометра определяли поглощение излучения неодимового лазера тканями мышц и печени крыс. Через слой ткани толщиной 1 мм при облучении мышц проходило 27— 32% излучения, а печени — 20—23%. Для слоев ткани толщиной 6 мм эти значения составили соответственно 3 и 1,5%.
Приведенные данные демонстрируют зависимость поглощения лазерного излучения от степени окрашенности ткани: обильно пигментированная ткань поглощает излучение интенсивнее, чем ткань мышцы. Та же закономерность проявлялась и в опытах по облучению рубиновым и неодимовым лазерами различных опухолей у животных. Наибольшее поглощение характерно для меланом вследствие наличия в них меланина.
А. М. Уразаев и др. (1978) сравнили степень ослабления излучения гелий-неонового (длина волны 632,8 нм) и аргонового (488 нм) лазеров при прохождении через различные участки тела живых депилированных крыс или через препараты, приготовленные из органов забитых животных. Прошедшее излучение измеряли с помощью фотоэлемента и полученные данные использовали для расчета глубины проникновения лазерного излучения. Почти во всех вариантах опыта излучение красной области спектра проникало на большую глубину, чем сине-зеленое, причем наиболее резко эта разница была выражена при прохождении через интенсивно васкуляризованные органы с обильным кровенаполнением.
Сравнение глубины проникновения в биологические ткани излучения азотного (длина волны 337,1 нм), гелий-кадмиевого (441,6 нм) и гелий-неонового (632,8 нм) лазеров проведено в серии исследований других авторов. Измерения были выполнены на срезах различных органов мышей с помощью двух методов; с применением фотометрического шара или светового зонда. В первом случае фотометрически определяли коэффициент отражения и коэффициент ослабления лазерного излучения в ткани, а последний позволял рассчитать глубину проникновения излучения; во втором в облучаемый образец ткани с противоположной стороны от лазерного луча соосно с ним вводили тонкий (диаметр 0,75 мм) стеклянный световод, соединенный с фотоумножителем. Отодвигая кончик световода на различные известные расстояния от точки падения луча на поверхность ткани и измеряя плотность светового потока, получали кривые распределения интенсивности лазерного излучения в ткани и определяли глубину его проникновения.
Оба примененных метода дали схожие результаты. Наибольшей проникающей способностью отличалось излучение гелий-неонового лазера, наименьшей — гелий-кадмиевого. Во всех случаях глубина проникновения не превышала 2—2,5 мм.
Интересная задача была поставлена в опытах, проведенных В. А. Дубровским и О. Г. Астафьевой (1979), в которых сравнивали величину поглощения красного излучения гемолизатом крови с различными физическими свойствами: поляризованного когерентного излучения гелий-неонового лазера; поляризованного некогерентного излучения лампы накаливания, пропущенного через поляроид и спектральные фильтры; неполяризованного и некогерентного излучения лампы накаливания, пропущенного только через спектральные фильтры. Было установлено, что пространственная когерентность не отражается на поглощении. Выраженное влияние на него оказывают ширина спектра и поляризационные свойства излучения: поляризованное излучение поглощается менее активно, чем неполяризованное.
Наряду с приведенными данными о поглощении биологическими тканями излучения лазеров, которые генерируют в ближней ультрафиолетовой (азотный), видимой (гелий-кадмиевый, аргоновый, гели й-неоновый, рубиновый) и ближней инфракрасной (неодимовый) спектральных областях, практически важной является информация о поглощении излучения СОз-лазера, генерирующего в инфракрасной области на длине волны 10 600 нм. Поскольку это излучение интенсивно поглощается водой, а последняя составляет около 80% массы большинства клеток, при воздействии на биологические ткани излучением СОг-лазера оно практически полностью поглощается поверхностными слоями клеток .
Как отмечалось выше, проникновение лазерного излучения в глубину тканей ограничено вследствие не только поглощения, но и других процессов, в частности отражения излучения от по-нерхности ткани. По данным Б. А. Кудряшова (1976), с. Д. Плетнева (1978) и др., отраженное белой кожей человека и животных излучение лазеров, генерирующих в ближней ультрафиолетовой и видимой областях спектра (азотный, гелий-кадмиевый, аргоновый, гелий-неоновый, рубиновый), составляет 30—40%; для инфракрасного излучения неодимового лазера эта величина не-(колько меньше (20—35%), а в случае более далекого инфракрасного излучения СОг-лазера она уменьшается приблизительно до 5%. Для различных внутренних органов животных величина коэффициента отражения света (633 нм) колеблется от 0,18 (печень) до 0,60 (мозг)
Вследствие ослабления лазерного излучения глубина его проникновения в биологические ткани не превышает нескольких миллиметров, и при практическом применении лазеров нужно исходить из этих условий. Однако наряду с изложенными материалами известны данные, позволяющие сделать более оптимистические выводы. Речь идет о том, что во всех рассмотренных выше исследованиях удалось оценить роль рассеяния излучения в глубине ткани. Когда, например, с помощью фотометрического шара определяли коэффициенты пропускания и отражения образца ткани, выявленная разница в интенсивности излучения, падавшего на поверхность образца и прошедшего сквозь него, представляла собой (за вычетом отраженного излучения) сумму потерь на поглощение и рассеивание, причем доля каждого из этих процессов оставалась неизвестной. В другом случае, когда интенсивность излучения, достигшего данной точки в глубине ткани, измеряли с помощью светового зонда, торец последнего воспринимал только излучение, которое падало «спереди» .На самом деле рассматриваемая точка внутри ткани освещается со всех сторон излучением, рассеянным частицами, окружающими ее. Следовательно, с помощью указанного метода получали заниженные показатели распределения интенсивности излучения по глубине, что не позволяло учесть рассеянный свет. Вместе с тем в интенсивно рассеивающих средах, каковыми являются биологические ткани, доля рассеянного излучения весьма значительна .
С учетом этих положений в серии обстоятельных исследований. Dougherty и соавт. (1975, 1978) была сделана попытка выяснить влияние светорассеивания на глубину проникновения излучения в ткани. Авторы с помощью фотоэлемента определяли долю светового излучения ксеноновой лампы (выделялась область 620—640 нм),прошедшего сквозь срезы различной толщины, которые были получены из перевивной опухоли молочной железы мышей или из их нормальных тканей. Полученные величины коэффициента светопропускания использовали для вычисления коэффициентов рассеяния (S) и поглощения (К) из соотношений, установленных P. Kubelka (1964) и F. Kottler (I960). Значения, полученные для опухолевой ткани, составляли S = 13,5 и К = 0,04, откуда видно, что доля рассеянного света намного превышает долю поглощенного. I
Во второй работе, проведенной в 1978 г. той же группой исследователей, были применены два метода, которые позволяли псе величины внутритканевой интенсивности света, как найденные без учета рассеивания, так и включающие его, получить прямым экспериментальным путем. В случае использования одного из методов в глубину свежеиссеченной опухоли (рабдомиоифкомы крыс) вводили волоконный световод толщиной 0,8 мм и его конец, выступающий из ткани, направляли луч гелий-неонового лазера мощностью 2 мВт. С противоположной стороны образца вводили другой световод, соединенный с фотометром. Приводя сначала световоды в соприкосновение, а затем раздвигая их па известные расстояния, измеряли интенсивность излучения, прошедшего сквозь слой ткани фиксированной толщины. Как и в описанных выше опытах, этот метод не позволял учесть рассеянный нет.
Вторая методика была актинометрической (фотохимической) и состояла в том, что в опухолевую ткань на определенную глубину вводили несколько капиллярных трубок диаметром 1 мм, заполненных раствором фоточувствительной смеси. Облучая затем образец ткани светом известной интенсивности с помощью лампы накаливания (длины волн более 600 нм), определяли количество продукта фотохимической реакции, которое было прямо пропорционально интенсивности света и являлось функцией глубины расположения трубок. Очевидно, при такой схеме проведения экспериментов на ход реакции влияло все излучение, дошедшее до данной точки в глубине ткани, в том числе и рассеянный свет. Данные, представленные на рис. 2, позволяют сопоставить результаты, полученные с помощью этих методов. Из графика видно, что интенсивность излучения в опухолевой ткани на одной и той же глубине, определенная актинометрическим способом, существенно выше той, которую устанавливали с помощью волоконнооптической техники. Так, из кривой актинометрических измерений видно, что на глубине 2 см в ткань еще проникает около 8% излучения, тогда как, согласно второй кривой, эта величина составляет менее 0,1% К
Таким образом, значительное преобладание рассеяния видимого света при прохождении его через биологические ткани над поглощением позволяет сделать заключение, что способность лазерного излучения проникать в ткани выше, чем принято считать. Если учесть возможность проведения лазерного излучения вглубь тканей с помощью волоконной оптики и последующее распределение его в толще облучаемого очага благодаря рассеянию, можно попытаться значительно раздвинуть рамки клинического применения лазеров.
6 ПАТОГЕНЕТИЧЕСКИЕ МЕХАНИЗМЫ ВЗАИМОДЕЙСТВИЯ ЛАЗЕРНОГО ИЗЛУЧЕНИЯ С БИОЛОГИЧЕСКИМИ ТКАНЯМИ
Монохроматичность, строгая направленность, когерентность и свойство концентрировать большое количество энергии на малых площадях дают возможность избирательно коагулировать, испарять и резать биологические ткани бесконтактно, с хорошим гемостазом, стерильностью и абластичностью.
При взаимодействии лазерного излучения с биологическими тканями наблюдается целый ряд эффектов: термический, обусловленный селективным поглощением квантов света, возникновение волн сдавления и упругого удара в среде, действие мощных электромагнитных полей, сопровождающих в ряде случаев лазерное излучение, а также ряд других эффектов, обусловленных оптическими свойствами самой среды.
Высокое содержание воды в большинстве биологических тканей в значительной степени объясняет тот факт, что именно термический эффект имеет существенное значение в характеристике их повреждения, особенно при действии излучения в красной и инфракрасной областях спектра, так как поглощение в этой части спектра обусловлено практически полностью водой.
При воздействии лазерного излучения на ткани важное значение имеет степень его фокусировки . Во время прохождения сфокусированного луча лазера через живые ткани интенсивность излучения быстро падает и для мышечной ткани на глубине 4 см составляет лишь 1—2% начальной энергии. Степень и результат биологического действия лазерного излучения на разные клетки, ткани и органы зависят не только от особенностей излучения (тип лазера, длительность и плотность мощности излучения, частота импульсов и др.), но и от физико-химических и биологических особенностей облучаемых тканей или органов/(интенсивность кровотока, гетерогенность, теплопроводность, коэффициент поглощения и отражения различных промежуточных поверхностей внутри среды и др.). Наиболее чувствительными и легко разрушающимися под воздействием лазерного излучения структурами оказались внутриклеточные компоненты клетки .
Возможность концентрации лазерного излучения в узкий пучок привела к созданию лазерного скальпеля, позволяющего производить практически бескровные разрезы различных тканей. В настоящее время уже накоплен большой опыт использования лазерного излучения в экспериментальной и клинической медицине.
Гемостатические свойства лазерного излучения можно повысить, применяя специальные компрессионные зажимы и лазерные хирургические инструменты, обеспечивающие кратковременное сдавливание и обескровливание тканей по линии предполагаемого разреза. Принцип дозированной компрессии позволяет также значительно уменьшить объем термического некроза тканей, так как в условиях компрессии значительно повышается теплопроводность тканей. В связи с этим одна и та же плотность энергии сфокусированного луча лазера дает возможность более быстро осуществить рассечение тканей при компрессии, обеспечивающей локальную ишемию тканей.
Использование лазера в комплексе со специальными инструментами обеспечивает не только рассечение тканей, но и так называемую биологическую сварку их. Эффект сварки клеточных и тканевых структур отмечен исследователями, применявшими лазерный луч для рассечения различных органов. Однако только с созданием специальной лазерной хирургической аппаратуры удалось наиболее полно реализовать эффект биологической сварки тканей полых органов во время их рассечения. В облучаемой зоне наблюдается повышенная светоабсорбция за счет большей оптической плотности сжатых тканей и многократного отражения света от внутренних частей аппарата, образующих замкнутое пространство. «Сварка» тканей полых органов происходит послойно вдоль линии разреза в зоне локального сжатия тканей, производимого этими аппаратами.
Морфологическим проявлением изменений, лежащих в основе этого феномена, является коагуляционный термический некроз подвергнутых компрессии тканей с образованием по краю разреза пленки из коагулированных тканевых и клеточных элементов, соединяющей на одном уровне все анатомические слои органа
Следствием трансформации световой энергии излучения в термическую в слизистой оболочке является деформация и укорочение желез, сморщивание эпителиальных клеток с компактным расположением их ядер. Образовавшиеся структуры напоминают «частокол». В мышечной оболочке морфологические изменения менее выражены. Подслизистая основа в зоне «сварки»
![]() Таблица 1
Таблица 1
Глубина (мкм) термических повреждений стенки желудка при гастротомии с помощью углекислотного лазера (по данным световой микроскопии)
| Стенка желудка | Коагуляционный некроз | Зона дистрофических изменений и микроциркуляторных расстройств |
|
Слизистая оболочка Подслизистая основа Мышечная оболочка |
36,5±5,6 46,4+5,8 32,6+4,8 |
87,6±6,1 128,6+9,4 56,7+6,3 |
становится слабо различимой. Ширина зоны коагуляционного некроза по краю рассекаемых тканей в этих случаях находится в пределах 1—2 мм. Объем некротических повреждений может быть уменьшен как благодаря увеличению количества жидкости в рассекаемых тканях, так и путем использования адекватной лазерной аппаратуры. Например, при рассечении скелетной мышцы углекислотным лазером ширина зоны коагуляционного некроза, достигающая 1,1—1,2 мм, после предварительного введения жидкости в мышцу уменьшается на 28—40%
В свою очередь применение усовершенствованной в последние годы специальной лазерной хирургической аппаратуры также позволяет сократить зону коагуляционного термического некроза до 30—60 мкм (табл. 1).
В связи с исключительно высокой температурой, присущей лазерному излучению, происходит чрезвычайно быстрое испарение межтканевой и внутриклеточной жидкости, а затем сгорание сухого остатка. Глубина и степень дистрофических изменений тканей при воздействии различных видов лазерного излучения зависят как от их спектральных характеристик, так и от суммарной энергии (продолжительность воздействия) излучения. При небольших экспозициях деструкции подвергаются лишь поверхностные слои тканей. Последовательное увеличение времени воздействия излучения сопровождается увеличением объема поврежденных тканей вплоть до перфорации органа. Перемещение лазерного луча в продольном или поперечном направлении ведет к испарению тканей и формированию линейного разреза органа.
В зоне коагуляционного термического некроза происходит коагуляция стенок сосудов и крови с образованием коагуляционного гиалиноподобного тромба, закупоривающего просвет сосуда и обеспечивающего адекватный гемостаз. В условиях дозированной компрессии при использовании лазерных хирургических аппаратов гемостатический эффект лазерного излучения в значительной степени усиливается, так как
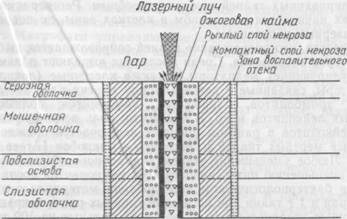
Схематическое изображение лазерной раны желудка
Сосуды с редуцированным кровообращением моментально коагулируются .
Морфология лазерной раны имеет характерные черты, резко отличающие ее от ран другого происхождения. Подвергшиеся термическому воздействию ткани представлены коагуляционным некрозом, формирующим лазерный термический струп. Последний плотно прикрывает поверхность раны. Непосредственно после лазерного воздействия трудно определить полный объем некротизированных тканей. Граница подвергшихся коагуляционному некрозу тканей стабилизируется в основном через сутки. В этот период в узкой зоне сохранившихся тканей на границе с термическим некрозом обнаруживают отек и различной степени выраженности расстройства кровообращения, проявляющиеся гиперемией, стазами, периваскулярными диапедезными кровоизлияниями.
На основе гистологических исследований выделены следующие зоны лазерного воздействия: зона коагуляционного некроза, периферическую часть которой составляет узкий рыхлый («спонгиозный») слой, а центральную — широкий, компактный, и зона воспалительного отека (рис.23).
Отмечены микроциркуляторные расстройства, наиболее выраженные при воздействии излучения АИГ-Nd-лазера и аргонового лазера (при гемостазе острых кровоточащих язв желудка). Процесс рассечения тканей углекислотным лазером сопровождается строго локальной коагуляцией последних по линии разреза, предотвращая тем самым повреждение окружающих тканей.
В лазерных
ранах в отличие от ран другого происхождения слабо выражены или даже отсутствуют
переходные зоны от![]()
![]() коагулированных тканей к
жизнеспособным. Регенерация в этих случаях начинается в основном в клетках
зоны, не поврежденной лазерным излучением.
коагулированных тканей к
жизнеспособным. Регенерация в этих случаях начинается в основном в клетках
зоны, не поврежденной лазерным излучением.
Известно, что повреждение тканей сопровождается выбросом медиаторов воспаления. Среди последних выделяют плазменные (циркулирующие) медиаторы, а также клеточные (локальные) медиаторы, связанные с деятельностью многих клеток — лаброцитов, тромбоцитов, макрофагов, лимфоцитов, полиморфно-ядерных лейкоцитов и др. В частности, роль полиморфно-ядерных лейкоцитов в раневом процессе заключается прежде всего в лизисе мертвых тканей и фагоцитозе микробов. Любое уменьшение степени микробного обсеменения ведет к уменьшению интенсивности всех компонентов воспаления. При бактериологическом исследовании материала с поверхности ран и 1 г ткани при иссечении гнойных ран и некрэктомии с помощью углекислотного лазера у 62 больных из 100 наблюдалась полная стерильность, а в остальных случаях отмечалось снижение содержания микробов ниже критического уровня (105).
Уменьшение степени микробного обсеменения лазерной раны, коагуляционный характер термического некроза и тромбоз сосудов в зоне некроза способствуют снижению экссудативного компонента воспаления. Наличие слабо выраженной лейкоцитарной реакции, а порой и полное ее отсутствие в краях лазерной раны подтверждено работами большинства исследователей. Коагулированные ткани не являются источником вазоактивных посредников, в частности кининов, играющих столь важную роль в становлении и развитии экссудативной фазы воспалительной реакции.
По данным В. И. Елисеенко (1980—1985), для лазерных ран характерна активная ранняя пролиферация клеточных элементов макрофагального и фибробластического ряда, обусловливающая ход репаративного процесса по типу асептического продуктивного воспаления. Пролиферация макрофагов и фибробластов в очаге продуктивного воспаления, начинающаяся с первых суток после воздействия лазерного излучения, лежит в основе формирующейся грануляционной ткани.
Однако имеются данные о том, что заживление лазерных ран может идти обычным путем, т. е. включая фазу лейкоцитарного расплавления некротизированных тканей. Заживление лазерных ран, по данным Ю. Г. Пархоменко (1979, 1983), протекает в основном под лазерным струпом. Преобразование лазерного струпа заключается в постепенной его организации и рассасывании (в паренхиматозных органах — печени и поджелудочной железе) или отторжении (в органах желудочно-кишечного тракта) по мере созревания грануляционной ткани.
Существенное значение в процессе заживления лазерных ран имеют клетки системы мононуклеарных фагоцитов — макрофаги. Макрофаги управляют дифференцировкой гранулоцитов и моноцитов из стволовой клетки, влияют на функциональную активность Т- и В-лимфоцитов, а также принимают участие а их кооперации. Они секретируют шесть первых компонентов комплемента, являясь, таким образом, посредниками привлечения иммунной системы в воспалительную реакцию. Макрофаги индуцируют роль фибробластов и синтез коллагена, т. е. являются стимуляторами завершающей фазы репаративной реакции) при воспалении. В частности, обнаружены клеточные контакты между макрофагами и фибробластами грануляционной ткани.
Можно предположить, что интенсивная и продолжительная макрофагальная реакция в лазерных ранах, связанная с длительной сохранностью коагулированных тканей, является фактором, активно стимулирующим процесс коллагенообразования..По мнению В. И. Елисеенко и соавт. (1982, 1985), функциональная роль пролиферирующих макрофагов заключается в «программировании» всего хода процесса заживления лазерных хирургических ран.
Фибробластическая реакция в процессах раннего заживления лазерных ран занимает одно из ведущих мест.
В лазерных ранах в период активного роста грануляционной ткани (5—10-е сутки) высокая плотность расположения фибробластов сочетается с наиболее резким увеличением активности НАД (НАДФ)-липоамид-дегидрогеназы (устар. диафоразы) в этих клетках, что в определенной степени может отражать повышение в них уровня энергетических и синтетических процессов. Позднее ферментативная активность этих клеток постепенно снижается, что свидетельствует об их созревании.
В формирующемся рубце лазерной раны происходит быстрое, диффузное накопление гликозаминогликанов основного вещества соединительной ткани, что свидетельствует о созревании грануляционной ткани. Известно, что после максимального увеличения числа фибробластов и их созревания усиливается и синтез коллагеновых волокон.
В процессе заживления лазерных хирургических ран органов желудочно-кишечного тракта прослеживается отчетливая взаимосвязь созревания соединительной ткани с ростом эпителия.
Таким образом, реакция макрофагов, пролиферация фибробластов и коллагеногенез проявляются очень рано и выражены тем сильнее, чем менее выражена лейкоцитарная инфильтрация, отсутствие которой обеспечивает заживление лазерных ран первичным натяжением.
7 МЕХАНИЗМЫ ЛАЗЕРНОЙ БИОСТИМУЛЯЦИИ
Отдельно следует рассмотреть вопрос о природе биостимулирующей активности низкоэнергетического лазерного излучения красной области спектра, которое получают главным образом с помощью гелий-неоновых лазеров. Благотворное влияние этого излучения было установлено в экспериментах на разных биологических объектах.
В 70-х годах были сделаны попытки объяснить явление лазерной биостимуляции особыми свойствами («биополе», «биоплазма»), которые якобы присущи живым организмам и придают специфическим характеристикам лазерного излучения биологическую значимость. В 1979 г. было выдвинуто предположение, что биологические эффекты низкоэнергетического лазерного излучения связаны с естественными процессами световой регуляции, наблюдающимися у животных. Молекулярная основа начальных этапов таких процессов лучше изучена у растений, для которых установлены не только сам факт фоторегуляции, но и химическая природа одного из первичных акцепторов света— фитохрома. Этот хромопротеид существует в двух формах, одна из которых поглощает свет вблизи 660 нм, а другая — 730 нм. Вследствие взаимопревращения этих форм при освещении меняется их количественное соотношение, что является пусковым механизмом в цепи процессов, приводящих в конечном счете к прорастанию семян, образованию почек, зацветанию растений и другим формообразовательным эффектам. Хотя не вызывает сомнения тот факт, что и у животных в основе таких явлений, как цикличность полового размножения или приуроченность ряда приспособительных реакций (линька и спячка млекопитающих, перелеты птиц) к определенным периодам года, лежат фоторегуляторные процессы, молекулярные механизмы их неясны
Представления о существовании в клетках животных определенной фоторегуляторной системы, возможно, напоминающей фитохромную систему растений, позволяют предположить, что биостимуляционная активность излучения гелий-неонового лазера является следствием простого совпадения его спектральных характеристик с областью поглощения компонентов этой системы. В этом случае следовало ожидать, что монохроматический красный свет некогерентных источников будет также биологически эффективным. Для экспериментальной проверки этого и других вопросов были необходимы чувствительные тесты, дающие количественные, хорошо воспроизводимые и точно измеряемые результаты. Подавляющее большинство исследований с гелий-неоновым лазером было проведено на животных или непосредственно на больных в условиях, не отвечающих этим требованиям.
При выборе подходящей модельной системы исходили из двух предпосылок: 1) клетки, развивающиеся или переживающие в условиях in vitro, представляют собой сравнительно простой тест-объект, позволяющий проводить точный учет условий воздействия и его результатов; 2) особого внимания заслуживает реакция поверхностной мембраны клеток, высокая чувствительность которого установлена ранее в опытах с низкоэнергетическим красным излучением рубинового лазера .
В исследованиях, проведенных Н. Ф. Гамалея и др. было изучено влияние излучения гелий-неонового лазера на поверхностную мембрану лимфоцитов, выделенных из крови человека. С этой целью оценивали способность лимфоцитов образовывать Е-розетки — взаимодействовать с эритроцитами барана. Установлено, что при низких дозах облучения (плотность мощности 0,1—0,5 Вт/м2, экспозиция 15 с), которые на полтора —два порядка ниже, чем используемые в клинических работах с гелий-неоновым лазером, происходит небольшое, но статистически достоверное повышение розеткообразовательной способности (в 1,2—1,4 раза) у облученных лимфоцитов по сравнению с контролем. Параллельно с цитомембранными изменениями повышалась функциональная активность лимфоцитов, в частности в 2— 6 раз возрастала их способность к делению, которую определяли в реакции бласттрансформации с фитогемагглютинином [Новиков Д. К., Новикова В. И., 1979], оценивая по накоплению клетками 3Н-тимидина. В экспериментах на лейкоцитах крови человека было установлено, что при воздействии на них излучения гелий-неонового лазера в таких же низких дозах в 1,5—2 раза усиливается фагоцитоз клетками кишечной палочки (как захватывание, так и переваривание). Излучение гелий-неонового лазера оказывало стимулирующее действие также на другие клетки. Так, в культуре опухолевых клеток мыши (L) задержка их роста в 1-е сутки после облучения сменялась его ускорением, которое было особенно заметно на 3—4-е сутки, когда количество делящихся клеток в 2 раза больше, чем в контроле
Таким образом, было показано, что излучение гелий-неонового лазера очень низкой интенсивности вызывает изменения в мембране клеток разных типов и стимуляцию их функциональной активности. Изменения цитоплазматической мембраны в культивируемых клетках китайского хомячка, облученных гелий-неоновым лазером, выявили также А. К. Абдвахитова и др. (1982) с помощью метода флюоресцентных зондов, хотя использованные ими дозы излучения на два порядка превышали примененные нами.
В гипотезе, выдвинутой венгерским хирургом Е. Местером совместно с группой физиков, предпринята попытка объяснить биостимуляционную активность лазерного излучения исключительно его поляризованностью: благодаря поляризации излучения оно способно реагировать с полярными молекулами липидов в двойном липидном слое цитоплазматической мембраны, что и запускает цепь изменений в клетке. Согласно предложенной модели, стимулирующий эффект не должен зависеть от длины волны излучения. Однако экспериментальные данные этого не подтверждают.
Надежная воспроизводимость биостимуляционного эффекта позволила пойти дальше и попытаться выяснить, вызывается ли этот эффект только лазерным (когерентным, поляризованным) излучением и как он зависит от длины волны. С этой целью путем применения теста на розеткообразование было оценено влияние на лимфоциты крови человека монохроматического красного света (633 ± 5 нм), полученного от ксеноновой лампы с помощью дифракционного монохроматора. Установлено, что при сравнимой дозе некогерентного красного света (3 Дж/м3) процесс розеткообразования стимулировался так же, как и при использовании гелий-неонового лазера.
Далее эффект красного света был сопоставлен с действием излучения других узких спектральных участков видимой области. При этом активность света оценивали по его влиянию на три процесса: образование Е-розеток лимфоцитами человека, размножение клеток культуры L и выделение в среду лимфоцитами мышей вещества с максимумом поглощения 265 нм. (Последний тест являлся развитием результатов проведенных наблюдений и основывался на том, что из подвергнутых лазерному облучению клеток усиливается выделение определенного химического фактора, имеющего полосу поглощения в области 260— 265 нм.) Опыты показали , что стимуляция всех трех процессов отмечается при облучении монохроматическим светом одних и тех же спектральных участков: красного (633 нм), зеленого (500 и 550 нм) и фиолетового (415 нм).
Таким образом проведенные исследования позволили выявить у разных клеток человека и животных наличие высокой световой чувствительности, даже значительно большей, чем можно было ожидать на основании клинических результатов лазерной биостимуляционной терапии. Эта чувствительность не была обусловлена когерентностью и поляризацией света и не ограничивалась красной областью спектра: наряду с максимумом в этой области имелись два других — в фиолетовом и зеленом участках спектра.
Используя иной методический подход (определение интенсивности синтеза ДНК в клетках культуры HeLa по включению меченого тимидина), Т. Й. Кару и др. (1982, 1983) также показали, что эффект биостимуляции не связан с когерентностью и поляризацией света. В выполненных ими опытах с облучением клеток красным светом максимальная стимуляция синтеза ДНК наблюдалась при дозе 100 Дж/м2 и эффект быстро снижался при ее изменении в любую сторону. При сравнении активности излучения в различных участках спектра были установлены три максимума: вблизи 400, 630 и 760 нм.
К механизму световой биостимуляции. может иметь отношение образование в облученных клетках и выделение ими того химического фактора, который обнаруживали в среде по пику светоабсорбции вблизи 265 нм. Для выяснения природы этого фактора были проведены хроматография на бумаге и электрофорез в агарозном геле с визуализацией зон бромистым этидием, позволившие обнаружить в выделяемом клетками материале двуспиральную ДНК с молекулярной массой. Двуспиральность структуры ДНК подтверждалась появлением гиперхромного эффекта при нагревании.
Приводимые в литературе сведения о способности нуклеиновых кислот ускорять восстановление поврежденных тканей [Белоус А. М. и др., 1974] подтверждали возможную причастность выделяемого клетками ДНК-фактора к световой биостимуляции. Для проверки этой гипотезы был поставлен эксперимент на клетках линии L, часть из которых облучали гелий-неоновым лазеpoм, а другую часть, которая не была облучена, помещали, однако, в среду, взятую от облученных клеток и, следовательно, содержавшую ДНК-фактор. Определение скорости роста (митотической активности) клеток показало, что в обеих группах развитие клеток по сравнению с контролем стимулировалось одинаково Более того, разрушение ДНК в среде, взятой от облученных клеток, с помощью фермента ДНКазы лишало эту среду биостимулирующей активности. Сама ДНКаза на рост клеток практически не влияла .
Следовательно, можно думать, что и при действии на ткани целостного организма (например, при лазерной терапии трофических язв) облучение клеток на периферии патологического очага приводит к выделению ими ДНК-фактора, который стимулирует рост фибробластических элементов в тканях, окружающих язву, тем самым ускоряя ее заживление. Однако однозначное доказательство этого может быть получено лишь в опытах на животных.
Таким образом, представленные данные, по-видимому, являются обоснованием целесообразности применения лазерной (или вообще световой биостимуляции) в лечебных целях и указывают пути дальнейшего развития этого метода. Эти данные имеют и более широкое фитобиологическое значение, состоящее в том, что впервые установлена специфическая световая чувствительность неретинальных (незрительных) клеток человека и животных, которая характеризуется рядом особенностей. Эта чувствительность спектрально зависима и чрезвычайно высока: использованные нами плотности мощности, равные десятым долям ватта на квадратный метр, сравнимы с теми, которые являются эффективными для фоторегуляторных систем растений .Как удалось установить с помощью теста на выделение ДНК-фактора, такой фоточувствительностью обладают клетки человека и животных разной видовой принадлежности, взятые из тканей и органов: лимфоциты мыши, собаки и человека, печеночные клетки крысы, клетки культур, полученных из фибробластов человека, почки хомяка и озлокачествленных фибробластов мыши.
Все эти факты подтверждают предположение о том, что у млекопитающих имеется специальная система восприятия света, возможно, подобная фитохромной системе растений и также выполняющая регуляторные функции. О сходстве предполагаемой фоточувствительной системы животных с системой фитохромной регуляции свидетельствует сравнение их основных особенностей.Помимо высокой световой чувствительности, фитохромной системе свойственны недозовый (триггерный) характер действия, который заставляет вспомнить и, может быть, объясняет большую вариабельность доз (с различиями в два порядка), используемых клиницистами для лазерной биостимуляции; сопряженность фитохромной системы (так же, как и описанных нами эффектов) с клеточными мембранами; контроль фитохромной системы над синтезом ДНК,РНК и белка, образование которых в тканях, облученных гелий-неоновым лазером, по данным многих авторов, также усиливается.
В том случае, если в клетках животных действительно имеется специализированная фоточувствительная система, тогда с помощью опытов по определению спектра действия (зависимости величины биологической реакции от длины волны) можно попытаться установить спектр поглощения (а по нему — и химическую индивидуальность) того соединения, которое является первичным акцептором света и запускает цепь процессов, приводящих в конечном итоге к фоторегуляторным эффектам. Соответствие между спектрами действия и спектром поглощения светоакцептора достигается, однако, лишь в том случае, если при постановке экспериментов выполняется ряд методических условий, что на практике является весьма сложной задачей
Тем не менее нельзя не обратить внимание на сходство всех трех кривых, характеризующих спектральную зависимость различных апробированных нами биологических эффектов, с типичным спектром поглощения порфириновых соединений. Это позволяет полагать, что светоакцептором в гипотетической системе фоторегуляции животных клеток служит какое-то соединение из группы порфиринов, являющихся, как известно, составной частью многих важных биохимических компонентов организма животных — гемоглобина, цитохромов, ряда ферментов и др. С. М. Зубкова (1978) высказала предположение, что биостимулирующее действие излучения гелий-неонового лазера связано с его поглощением порфиринсодержащим ферментом каталазой, имеющим максимум светоабсорбции ~628 нм. Облучение клеток на периферии патологического очага приводит к выделению ими ДНК-фактора, который стимулирует рост фибробластических элементов в тканях, окружающих язву, тем самым ускоряя ее заживление. Однако однозначное доказательство этого может быть получено лишь в опытах на животных.
Таким образом, представленные данные, по-видимому, являются обоснованием целесообразности применения лазерной (или вообще световой биостимуляции) в лечебных целях и указывают пути дальнейшего развития этого метода. Эти данные имеют и более широкое фитобиологическое значение, состоящее в том, что впервые установлена специфическая световая чувствительность неретинальных (незрительных) клеток человека и животных, которая характеризуется рядом особенностей. Эта чувствительность спектрально зависима и чрезвычайно высока: использованные плотности мощности, равные десятым долям ватта на квадратный метр, сравнимы с теми, которые являются эффективными для фоторегуляторных систем растений [Shropshire W., 1977]. Как удалось установить с помощью теста на выделение ДНК-фактора, такой фоточувствительностью обладают клетки человека и животных разной видовой принадлежности, взятые из тканей и органов: лимфоциты мыши, собаки и человека, печеночные клетки крысы, клетки культур, полученных из фибробластов человека, почки хомяка и озлокачествленных фибробластов мыши.
Все эти факты подтверждают предположение о том, что у млекопитающих имеется специальная система восприятия света, возможно, подобная фитохромной системе растений и также выполняющая регуляторные функции. О сходстве предполагаемой фоточувствительной системы животных с системой фитохромной регуляции свидетельствует сравнение их основных особенностей. Помимо высокой световой чувствительности, фитохромной системе свойственны недозовый (триггерный) характер действия, который заставляет вспомнить и, может быть, объясняет большую вариабельность доз (с различиями в два порядка), используемых клиницистами для лазерной биостимуляции; сопряженность фитохромной системы (так же, как и описанных нами эффектов) с клеточными мембранами; контроль фитохромной системы над синтезом ДНК,РНК и белка, образование которых в тканях, облученных гелий-неоновым лазером, по данным многих авторов, также усиливается.
В том случае, если в клетках животных действительно имеется специализированная фоточувствительная система, тогда с помощью опытов по определению спектра действия (зависимости величины биологической реакции от длины волны) можно попытаться установить спектр поглощения (а по нему — и химическую индивидуальность) того соединения, которое является первичным акцептором света и запускает цепь процессов, приводящих в конечном итоге к фоторегуляторным эффектам. Соответствие между спектрами действия и спектром поглощения светоакцептора достигается, однако, лишь в том случае, если при постановке экспериментов выполняется ряд методических условий, что на практике является весьма сложной задачей [Mitrakos К., Shropshire W., 1972].
ИСПОЛЬЗОВАННАЯ ЛИТЕРАТУРА
1. А. Н. РЕМИЗОВ «МЕДИЦИНСКАЯ И БИОЛОГИЧЕСКАЯ ФИЗИКА»
2. «ЛАЗЕРЫ В ХИРУРГИИ» ПОД РЕДАКЦИЕЙ ПРОФ. О.К. СКОБЕЛКИНА
3. «ЛАЗЕРЫ В КЛИНИЧЕСКОЙ МЕДИЦИНЕ» ПОД РЕДАКЦИЕЙ С. Д. ПЛЕТНЕВА
Перепечатка материалов без ссылки на наш сайт запрещена